大黃素對布魯菌感染 BALB/c 小鼠模型的治療作用
周小仙,朱 珠,陳澤慧,陳安林,楊智芳
(1.遵義醫科大學附屬醫院 檢驗科,貴州 遵義 563003;2.遵義醫科大學 檢驗醫學院,貴州 遵義 563006)
布魯菌是一種兼性細胞內寄生菌,人體感染后可引起復發性發熱和流感樣癥狀,并導致多器官受累,家畜感染后可引起流產和不孕。布魯菌作為胞內寄生的隱匿性病原體,對宿主免疫機制具有調節作用。布魯菌感染后,宿主中性粒細胞幾乎不能被激活,導致其能通過抵抗吞噬細胞殺傷機制而逃避天然免疫系統和特異性免疫系統的清除作用[1-3]。大部分抗菌藥物不能滲透巨噬細胞膜而發揮抗菌作用,以上這些因素均可能導致布魯菌感染治療失敗率高、復發率高、周期長、副作用大[3],甚至已有強力霉素耐藥和利福平耐藥的布魯菌出現[4]。因此,尋找一種安全有效、毒副作用小且能夠透過細胞膜而用于治療布魯菌病的藥物具有十分重要的意義。大黃素是一種蒽醌類化合物,具有水溶性差、脂溶性好的特點[5],對金黃色葡萄球菌、銅綠假單胞菌等病原菌具有一定的抑菌作用[6]。本課題組前期研究發現,大黃素可通過增加IL-6、TNF-α 和IFN-γ 的表達量,增強巨噬細胞對布魯菌的殺傷能力[7]。為了進一步證實其療效,本課題組通過構建布魯菌感染BALB/c小鼠模型以觀察大黃素對布魯菌感染小鼠的治療效果,以期為大黃素抗布魯菌感染提供實驗依據。
1 材料與方法
1.1 實驗動物 BALB/c 小鼠,雌雄各半,SPF級6~8周,購自第三軍醫大學實驗動物中心,體重18~20 g。
1.2 試劑 大黃素(純度 ≥ 99.0%)購自美國Sigma公司;胰蛋白胨大豆瓊脂、胰蛋白胨大豆肉湯平板購自青島高科園海博生物科技有限公司;基因組DNA 提取試劑盒及PCR 擴增試劑盒購自上海生工生物公司;Mueller-Hinton Broth 肉湯購自英國OXOID 公司;試管凝集試驗試劑盒購自北京賽諾利康生物技術有限公司。
1.3 儀器設備 VITEK 2 Compact全自動微生物分析系統及比濁儀為法國梅里埃公司產品;T100TMThermal Cycler PCR 擴增儀為德國BIO RAD 公司產品;DYCP-31DN 型電泳儀為北京六一儀器廠產品;FA1104B 電子天平為美國奧豪斯公司產品。
1.4 方法
1.4.1 實驗菌株分離培養鑒定 采用VITEK 2 Compact 全自動微生物鑒定儀對臨床分離菌株進行初步鑒定,16S rDNA 分子技術對該菌株再次進行菌種鑒定,16S rDNA 進行PCR 擴增的引物序列為:27 F:5'-AGAGTTTGATCMTGGCTCAG-3';1492 R: 5'-TACGYTACCTTGTTACGACTT-3'。
1.4.2 構建布魯菌感染小鼠模型 70 只BALB/c 小鼠隨機分為對照組和實驗組(1×102、1×103、1×104、1×105、1×106和1×107CFU/mL菌液),每組10 只,雌雄各半。對照組,每只小鼠腹腔注射200 μL PBS 溶液,實驗組每只小鼠腹腔注射200 μL按照上述分組設定的菌液構建小鼠感染模型[8]。注射菌液后第1周和第2周脫頸處死小鼠,進行血清試管凝集試驗(Serum tube agglutination test,SAT)和脾臟載菌量檢測(取脾臟研碎稀釋后接種于平板上,觀察是否有細菌生長,并采用VITEK 2 Compact 全自動微生物鑒定儀和16S rDNA分子技術對其進行細菌學鑒定),確定成功構建布魯菌感染小鼠模型的菌液濃度及時間。
1.4.3 布魯菌感染小鼠不同時間對肝脾的影響 將40 只小鼠隨機分為對照組和實驗組,每組20 只,雌雄各半。對照組每只腹腔注射200 μL 生理鹽水,實驗組注射上述成功構建小鼠感染模型濃度的布魯菌液200 μL。分別于1、2、4、6周時脫頸處死小鼠,取出肝脾組織,稱量肝脾濕重后,計算肝脾指數(指數=臟器濕重/小鼠體重×100 %),HE 染色觀察肝脾組織病理變化。
1.4.4 大黃素對布魯菌感染小鼠的治療效果 將50 只布魯菌感染小鼠隨機分為磷酸鹽緩沖溶液(Phosphate buffer solution,PBS) 組、多西環素組和大黃素組(2、4、8 mg/mL),每組10 只,雌雄各半。第1周每只小鼠每天用1 mL相應藥物灌胃1次,第2~3周每3 d灌胃1次。最后一次灌胃結束1 d脫頸處死小鼠,通過體重稱量、腹腔積液菌落計數、肝脾指數測量及肝脾組織HE 染色觀察病理變化。

2 結果
2.1 實驗菌株鑒定結果 實驗菌株經VITEK 2 Compact全自動微生物鑒定儀GN 鑒定卡鑒定該菌株為羊布魯菌 ,生物編碼為0000001300001001,置信度99% 。16S rDNA分子技術鑒定結果中,PCR擴增該菌的目的基因片段長度為1 500 bp(見圖1),與文獻報道一致[9],并將此PCR 擴增產物送北京六合華大基因科技有限公司進行測序,所得序列(見圖2)經Blast 對比分析,其與羊布魯同源性為97%(見圖3)。
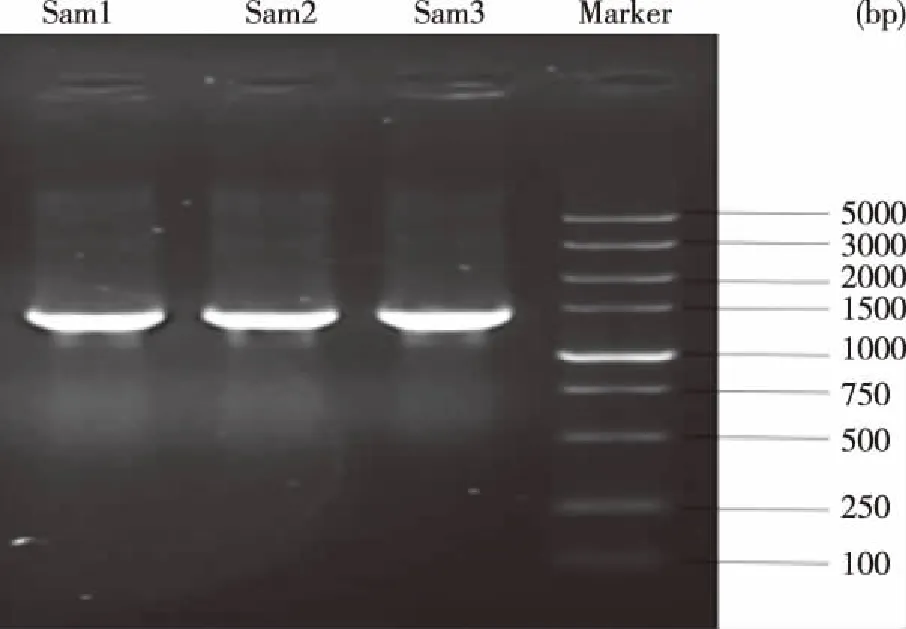
Sam1、Sam2和 Sam3為重復實驗菌株。 圖1 實驗菌株16S rDNA PCR擴增產物瓊脂糖凝膠電泳結果
圖2 實驗菌株16S rDNA PCR擴增產物測序結果

圖3 實驗菌株16S rDNA PCR擴增產物序列比對結果
2.2 成功構建布魯菌感染小鼠模型菌液濃度 以1×105CFU/mL菌液腹腔注射小鼠2周時,出現SAT(++)、脾臟載菌(+),由此判定小鼠感染布魯菌的菌液濃度可能為1×105CFU/mL(見表1)。細菌學檢查發現,1×105CFU/mL菌液腹腔注射小鼠2周后在脾臟組織中檢出羊布魯菌,而對照組無細菌檢出,表明通過腹腔注射1×105CFU/mL菌液2周可成功構建布魯菌感染小鼠模型。
2.3 布魯菌感染小鼠不同時間對肝脾指數的影響 布魯菌感染小鼠2周后開始出現肝脾指數增加,且隨著時間延長,增加越明顯。1、2、4、6周時,對照組的肝臟指數分別為5.835±0.626、5.665±0.131、6.258±0.621和6.410±0.993,實驗組肝臟指數分別為6.002±0.459、7.157±0.203、8.429±0.954和8.305±0.756;1、2、4、6周時,對照組的脾臟指數分別為0.478±0.033、0.494±0.043、0.537±0.111和0.478±0.047,實驗組脾臟指數分別為0.547±0.061、0.752±0.070、1.083±0.197和1.931±0.236(見圖4)。
表1不同濃度的布魯菌液感染小鼠不同時間SAT和脾臟載菌情況
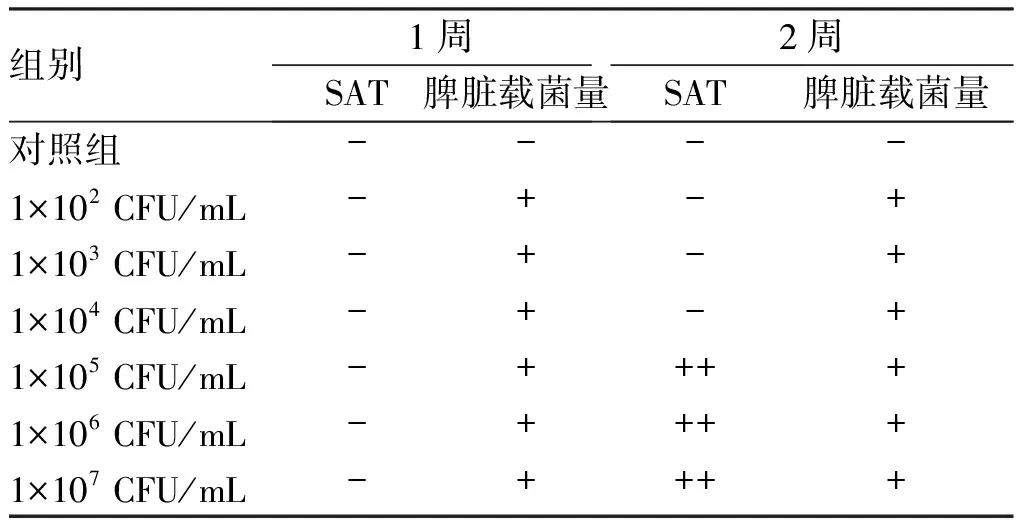
組別1周SAT脾臟載菌量2周SAT脾臟載菌量對照組----1×102 CFU/mL-+-+1×103 CFU/mL-+-+1×104 CFU/mL-+-+1×105 CFU/mL-++++1×106 CFU/mL-++++1×107 CFU/mL-++++
SAT“++”及以上血清稀釋度判斷為該血清抗體陽性。
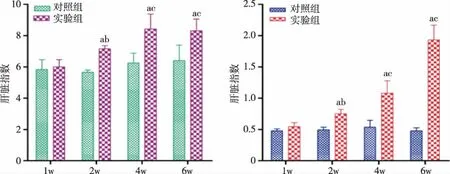
a: 與相應時間的對照組比,P <0.05;b: 與第1周的實驗組比,P <005;c: 與第1周的實驗組比,P <0.01。圖4 布魯菌感染小鼠不同時間對肝脾指數的影響
2.4 布魯菌感染小鼠的肝脾組織病理變化 實驗組肝細胞結構排列紊亂,細胞間隙增寬,胞漿發生脂肪樣變性,細胞核固縮;脾臟結構紊亂,脾小體、脾小粱基本不可見,紅、白髓分界不明,白髓區明顯減少,其間出現纖維樣改變(見圖5)。
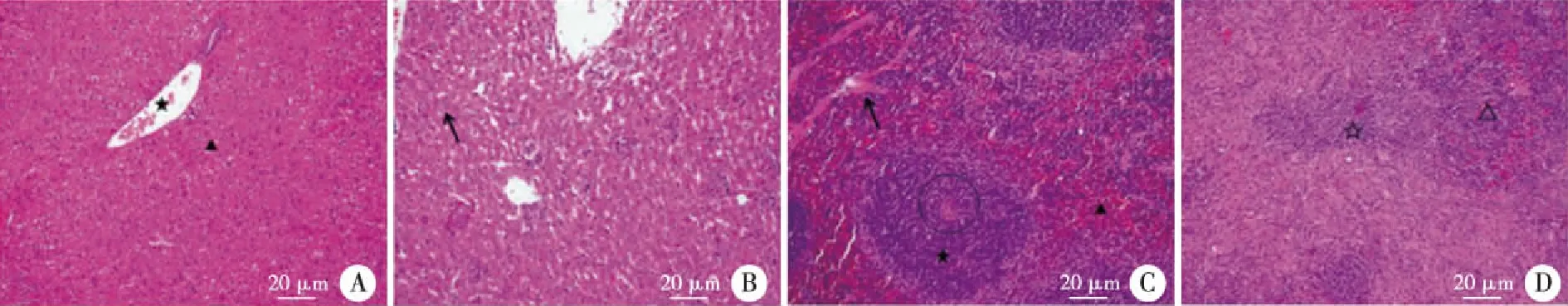
以上病理組織切片均采自布魯菌感染小鼠4周的組織病理切片,其中肝臟組織病理切片中,★為中央靜脈,▲和↖均為肝細胞。脾臟組織病理切片中★和☆均為白髓,▲和△均為紅髓,○為中央動脈,↖為脾小粱。圖5 布魯菌感染小鼠肝脾組織的病理變化
2.5 大黃素對布魯菌感染小鼠體重和腹腔載菌量的影響 與PBS 組相比,大黃素組(2、4、8 mg/mL)和多西環素組小鼠腹腔細菌量明顯減少(P<0.05),體重明顯增加(P<0.05),且8 mg/mL大黃素組和多西環素組無統計學差異(P> 0.05)。PBS組、多西環素組和大黃素組(2、4、8 mg/mL)的腹腔載菌量(lg CFU值)分別為5.161±0.501、4.003±0.093、5.175±0.361、4.771±0.498和4.023±0.199;PBS組、多西環素組和大黃素組(2、4、8 mg/mL)的體重分別為(18.047±0.418)g、(18.921±0.291)g、(19.043±0.252)g、(18.816±0.445)g和(19.008±0.430)g(見圖6)。

a:與PBS組相比,P <0.05; b:與多西環素組相比,P <0.05。圖6 不同濃度大黃素對布魯菌感染小鼠體重和腹腔載菌量的影響
2.6 大黃素對布魯菌感染小鼠肝脾的影響 8 mg/mL大黃素組小鼠肝臟指數較PBS 組小鼠明顯降低,病理切片見中性粒細胞、淋巴細胞和漿細胞等各種炎癥細胞浸潤明顯減少,肝細胞排列緊密而規則,分界清楚,未見變性和壞死(見表2和圖7)。
大黃素組(2、4、8 mg/mL)和多西環素組脾臟指數較PBS組小鼠明顯減低(P<0.05),且8 mg/mL大黃素組和多西環素組差異無統計學意義(P> 0.05),小鼠脾臟組織變化顯示,大黃素組(2、4、8 mg/mL)和多西環素組均有不同程度改善,結構排列規則有序,紅白髓分界清楚,脾小體數量曾多。其中8 mg/mL大黃素組和多西環素組小鼠脾臟組織結構接近正常組小鼠(見圖8和表2)。
表2大黃素對布魯菌感染小鼠肝脾指數的檢測結果
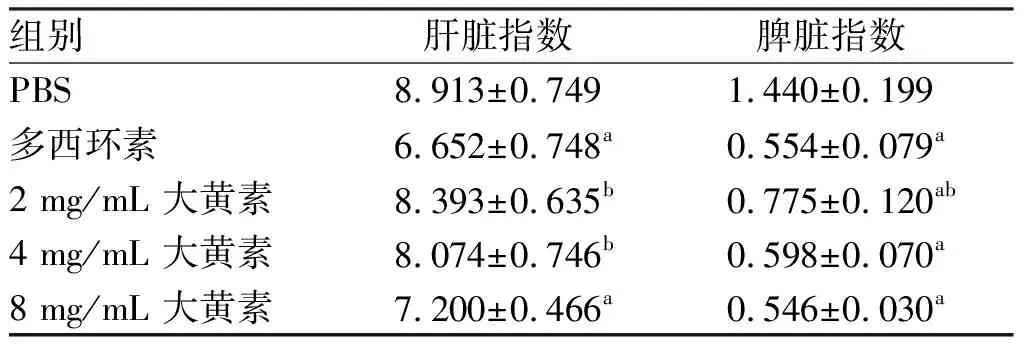
組別肝臟指數脾臟指數PBS8.913±0.7491.440±0.199多西環素6.652±0.748a0.554±0.079a2 mg/mL 大黃素8.393±0.635b0.775±0.120ab4 mg/mL 大黃素8.074±0.746b0.598±0.070a8 mg/mL 大黃素7.200±0.466a0.546±0.030a
a: 與PBS組相比,P<0.05;b:與多西環素組相比,P<0.05。
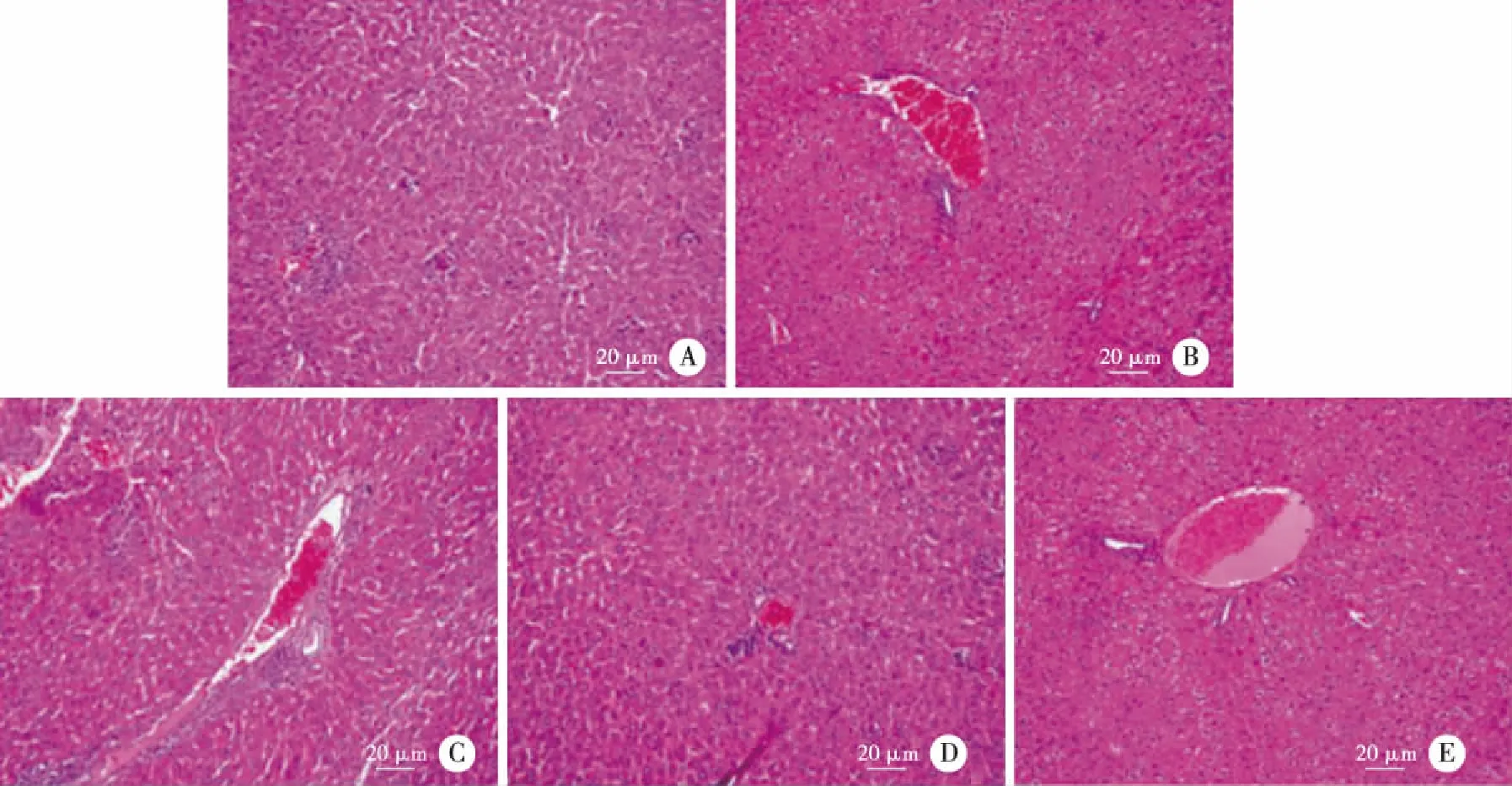
A:PBS組;B:多西環素組;C:2 mg/mL大黃素組;D:4 mg/mL大黃素組;E:8 mg/mL大黃素組。圖7 不同濃度大黃素對布魯菌感染小鼠肝臟組織病理學變化
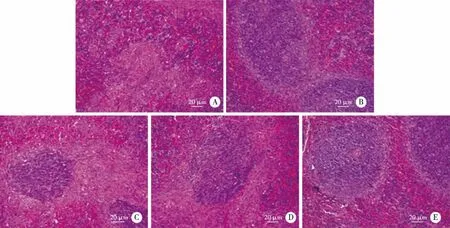
A:PBS組;B:多西環素組;C:2 mg/mL大黃素組;D:4 mg/mL大黃素組;E:8 mg/mL大黃素組。圖8 不同濃度大黃素對布魯菌感染小鼠脾臟組織病理學變化
3 討論
布魯菌屬是高致病性病原體,而羊布魯菌又是布魯菌屬中最常見、毒性最強、病情最嚴重的亞種,人們常通過接觸被感染牲畜或被污染牲畜產品引起致病,其感染后可在人體肝脾、淋巴結等器官中生存繁殖,導致全身各個系統不可逆的損害[2]。臨床上常根據布魯菌生化反應、基因組及蛋白組學的不同進行細菌學鑒定,但因單一鑒定方法容易出現錯誤鑒定結果,最好采用兩種方法同時進行鑒定[9]。本次研究通過采用VITEK 2 Compact 全自動微生物鑒定儀及16S rDNA基因序列分析兩種方法均鑒定為羊布魯菌,確保了試驗結果的可靠性。
布魯菌可經呼吸道、消化道和皮膚接觸等多種途徑引起宿主感染,采用肺遞送、滴鼻和腹腔注射3 種方式均可構建小鼠感染模型[8,10-11],此次研究中通過腹腔注射1x105CFU/mL菌液200 μL成功構建小鼠感染模型,結果與付湘云和韋超等報道一致,均顯示布魯菌感染的小鼠肝脾組織發生了病理損傷[10-11]。布魯菌感染導致肝脾損傷的原因可能是,布魯菌感染機體后,主要寄生在巨噬細胞、胎盤滋養層細胞和樹突細胞中,菌體的脂多糖(LPS)、T4SS 分泌系統和BvrR/BvrS 系統等毒力因子可與宿主細胞表面相互作用,形成含有布魯菌的空泡對宿主細胞產生損傷[12]。宿主感染布魯菌以細胞免疫為主[13],參與細胞免疫的專職抗原提呈細胞主要是巨噬細胞和樹突細胞[14]。在巨噬細胞上有較多的布魯菌識別受體,當布魯菌感染宿主后優先侵染巨噬細胞,通過減少胞內TNF-α 的分泌而抑制其凋亡。布魯菌與巨噬細胞內溶酶體融合,形成布氏小體,逃逸機體的免疫監視、免疫應答和免疫殺傷作用,為自己創造在細胞內生存繁殖的良好生存環境[15]。肝脾又是巨噬細胞最豐富的器官,小鼠被布魯菌感染后可能會造成肝脾損傷。
目前,臨床對布魯菌感染的治療仍以聯合應用抗菌藥物為主,WHO 推薦多西環素聯合利福平6周、多西環素聯用強力霉素45 d、多西環素和鏈霉素聯用21 d治療布魯菌感染患者[16]。多西環素、利福平等抗菌藥物長期服用增加藥物毒副作用,尤其是對肝臟的損害。近年來隨著大量抗菌藥物的使用,逐漸出現了利福平、復方新諾明對布魯菌耐藥的報道[4],所以尋找新的藥物治療布魯菌病已成為研究熱點。大黃素是一種分離自大黃、虎杖、何首烏、蘆薈和決明子等中藥的天然蒽醌類產物,具有抗病毒,抗菌,抗炎,抗過敏,抗腫瘤,抗骨質疏松,治療糖尿病,免疫抑制和保護神經等多種藥理活性[17]。朱珠等[7]研究發現,大黃素能增強巨噬細胞對布魯菌的殺傷能力。本次研究發現,大黃素可減少小鼠腹腔積液中細菌的量,增加體重,改善肝脾組織的病理損傷,且8 mg/mL大黃素與多西環素的治療效果相同。大黃素作為天然植物提取物,與臨床常用的抗生素、激素等相比,在使用時不易產生耐藥性,可從干擾核糖、蛋白、能量轉化、細胞壁和細胞膜的完整性等各個環節而抑制布魯菌生長[18-19]。研究發現,大黃素僅在較高劑量(4 000 mg/kg)作用下才可引起不可逆的病理改變,產生 肝毒性、腎毒性和生殖毒性,低中劑量不會造成病理改變[20]。而此次研究顯示所需大黃素為8 mg/mL以下就有抗感染效果,遠遠低于中毒劑量。因此,臨床上針對布魯菌感染患者,可選用大黃素輔以治療,減少抗菌藥物的毒副作用及耐藥性。

