姜黃素通過TLR4-MAPK/NF-κB信號通路對巨噬細胞極化及炎癥反應的影響
唐彪 周瑤瑤
巨噬細胞作為一類具有可塑性、異質性的免疫細胞,根據周圍微環境的不同刺激可呈現出一系列不同的表型(主要分為M1型和M2型),即巨噬細胞的極化現象[1-2]。姜黃素是姜黃根中的多酚成分,具有抗氧化、抗炎、抗微生物和抗凋亡等多種藥理活性[3-5]。我們之前的研究證實姜黃素可抑制脂多糖(lipopolysaccharide,LPS)聯合干擾素γ誘導的巨噬細胞中各種炎癥因子的表達[6]。然而,姜黃素是否能影響巨噬細胞的極性及其具體的抗炎機制尚不十分明確[7]。因此,本研究擬通過觀察姜黃素對LPS誘導的M1型巨噬細胞的極性及炎癥因子表達的影響,進一步研究姜黃素對巨噬細胞TLR4-MAPK/NF-κB信號通路的作用,為姜黃素在免疫調節、抗炎治療等方面提供一定的理論依據,現報道如下。
1 材料和方法
1.1 實驗材料 單核細胞株RAW264.7按照美國典型物培養中心(ATCC)的說明,采用含10%FBS的DMEM培養基,在37℃,5%CO2培養箱中培養。將姜黃素溶于DMSO中制成濃度為100mM的濃縮液,設置不同濃度,分別為 0μmol/L(LPS組)、6.25μmol/L(姜黃素 6.25μmol/L 組)、12.5μmol/L(姜黃素 12.5μmol/L 組)、25μmol/L(姜黃素 25μmol/L組)預處理巨噬細胞2h后加入LPS(1μg/ml)。為研究TLR4-MAPK/NF-κB信號通路在巨噬細胞極化中的作用,將未加入姜黃素的細胞分為對照組、LPS組、vector組、siTLR4組、JNK抑制劑組、ERK 抑制劑組和p38抑制劑組,后4組分別加入siTLR4、JNK抑制劑、ERK抑制劑和p38抑制劑,繼續培養24h,收集細胞,用于提取細胞的蛋白質和RNA。
1.2 實驗試劑及儀器 實驗試劑包括RAW264.7巨噬細胞(中科院上海生化細胞所細胞庫);DMEM高糖培養基及FBS(美國Hyclone公司);LPS、姜黃素(美國Sigma-Aldrich公司);抗體(美國Abcam公司);JNK 抑 制 劑 (SP600125)、ERK 抑 制 劑(SCH772984)及 p38抑制劑(SKepinone-L)(美國Selleck Chemicals公司);一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗體(美國 CST公司);CD206抗體(美國Abcam公司);TRIzol(美國Invitrogen公司);逆轉錄試劑盒(美國MBI Fermentas公司)、Quant qRT-PCR(SYBR Green I)試劑盒(美國TIANGEN公司);引物由上海生工生物工程有限公司設計合成,其他各種化學試劑均為進口或國產分析純。實驗儀器包括層流超凈操作臺(無錫一凈公司);LX70倒置顯微鏡(日本OLYMPUS公司);低溫高速離心機(德國Sigma公司);超低溫冰箱(日本SANYO公司);恒溫CO2培養箱(美國Quene公司);RNA定量分析儀(美國BIO-RAD公司);逆轉錄PCR基因擴增儀(美國Applied Biosystems公司);Real-Time PCR儀(美國ABI公司);凝膠成像系統Gel Doc EZ、化學發光成像儀(美國Bio-Rad公司)。
1.3 方法
1.3.1 實時熒光定量PCR(real-time PCR)法檢測腫瘤壞死因子α(tumornecrosis factor alpha,TNF-α)及白介素 -6(interleukin-6,IL-6)mRNA 的表達按Trizol說明書提取各組細胞的總RNA,采用紫外分光光度法檢測RNA的純度和濃度,按RT-PCR試劑盒操作步驟將各組mRNA逆轉錄為cDNA。反應條件如下:65℃ 5min,42℃ 1h,70℃ 5min。同時,通過比對TNF-α及IL-6和內參在Genebank中相應的基因全長cDNA序列分別設計引物,序列如下:TNF-α正向引物TTGCCCTGTGAGGAGGAC,反向引物TGAGCCAGAAGAGGTTGAGG;IL-6正向引物CTTCGGTCCAGTTGCCTTCT,反向引物GTGAGTGGCTGTCTGTGTGG;β-actin 正 向 引 物 CATGTACGTTGCTATCCAGGC,反向引物CTCCTTAATGTCACGCACGAT。使用熒光定量聚合酶鏈反應儀及Quant qRT-PCR(SYBR Green I)試劑盒,以β-actin為內參,確認擴增曲線和融解曲線,分別得出Ct值,并采用2-ΔΔCt計算TNF-α及IL-6 mRNA的相對表達量。每個實驗重復3次。
1.3.2 Western blot法檢測 iNOS、CD206 及p38/ERK/JNK/IKK/IκBα/p65的總體及磷酸化水平 上述分組的巨噬細胞經處理后,RIPA裂解液裂解細胞并提取細胞總蛋白,BCA試劑盒測定各組樣品蛋白濃度,加入蛋白上樣緩沖液煮沸備用。蛋白經10%SDS-PAGE凝膠電泳后轉膜,染色洗膜后用脫脂奶粉封閉,結合一抗,室溫下搖動1h,4℃孵育過夜。經PBST洗膜后加入HRP標記的二抗,室溫孵育1h,再次洗膜后用ECL化學發光顯色。結果用凝膠圖像處理系統分析目標條帶與內參條帶的光密度值。
1.4 統計學處理 采用SPSS17.0統計軟件,符合正態分布的計量資料以表示,多組比較采用單因素方差分析,兩獨立樣本間比較采用t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組巨噬細胞M1型極化及相關炎癥因子TNF-α、IL-6的比較 見圖1。

圖1 各組巨噬細胞M1型極化及相關炎癥因子TNF-α、IL-6的比較(A:各組巨噬細胞iNOS及CD206蛋白表達的電泳圖;B:各組巨噬細胞iNOS及CD206蛋白表達水平的比較;C:各組巨噬細胞TNF-α mRNA表達水平的比較;D:各組巨噬細胞IL-6 mRNA表達水平的比較;與 LPS 組比較,*P<0.05,**P<0.01)
由圖1可見,與對照組相比,LPS組iNOS和CD206的表達水平均顯著升高(P<0.05),TNF-α、IL-6 mRNA的表達水平也顯著升高(P<0.05)。與LPS組相比,隨著姜黃素干預組中藥物濃度的升高,iNOS的表達水平顯著降低(P<0.05或0.01),而CD206的表達水平無明顯變化(均P>0.05);TNF-α、IL-6 mRNA表達水平下降(P<0.05或0.01)。
2.2 各組巨噬細胞TLR4及p38/ERK/JNK/IKK/IκBα/p65表達水平的比較 見圖2。
由圖2可見,在LPS的刺激下,TLR4 mRNA的表達水平較對照組顯著增加(P<0.05);另一方面,隨著姜黃素濃度的升高,TLR4 mRNA的表達水平下降(均P<0.01)。與對照組相比,LPS組p38/ERK/JNK/IκBα/p65的磷酸化水平顯著增加(P<0.01),而總體表達差異無統計學意義(P>0.05)。與LPS組相比,姜黃素25μmol/L組可顯著抑制LPS引起的TLR4-MAPK/NF-κB通路的激活,具體表現為p38/ERK/JNK/IκBα/p65磷酸化水平的回落(P<0.05,圖2C-D)。
2.3 各組巨噬細胞TNF-α和IL-6表達水平的比較 見圖3。
由圖3可見,通過siTLR4以及下游通路關鍵分子的抑制劑分別下調相應分子的表達,從而在不同水平阻斷該信號通路的傳導,與vector組相比,siTLR4能顯著降低其下游蛋白的磷酸化水平(P<0.05);同時,JNK的抑制劑SP600125、ERK的抑制劑SCH772984以及p38的抑制劑Skepinone-L也能分別在不同水平阻斷MAPK通路的傳導(P<0.05)(圖3A-B)。與vector組相比,siTLR4組巨噬細胞TNF-α和IL-6的表達水平顯著降低(均P<0.01);另外,JNK的抑制劑 SP600125、ERK的抑制劑SCH772984以及p38的抑制劑Skepinone-L也能顯著降低TNF-α、IL-6 mRNA的表達水平(P<0.05或0.01,圖 3C)。
3 討論
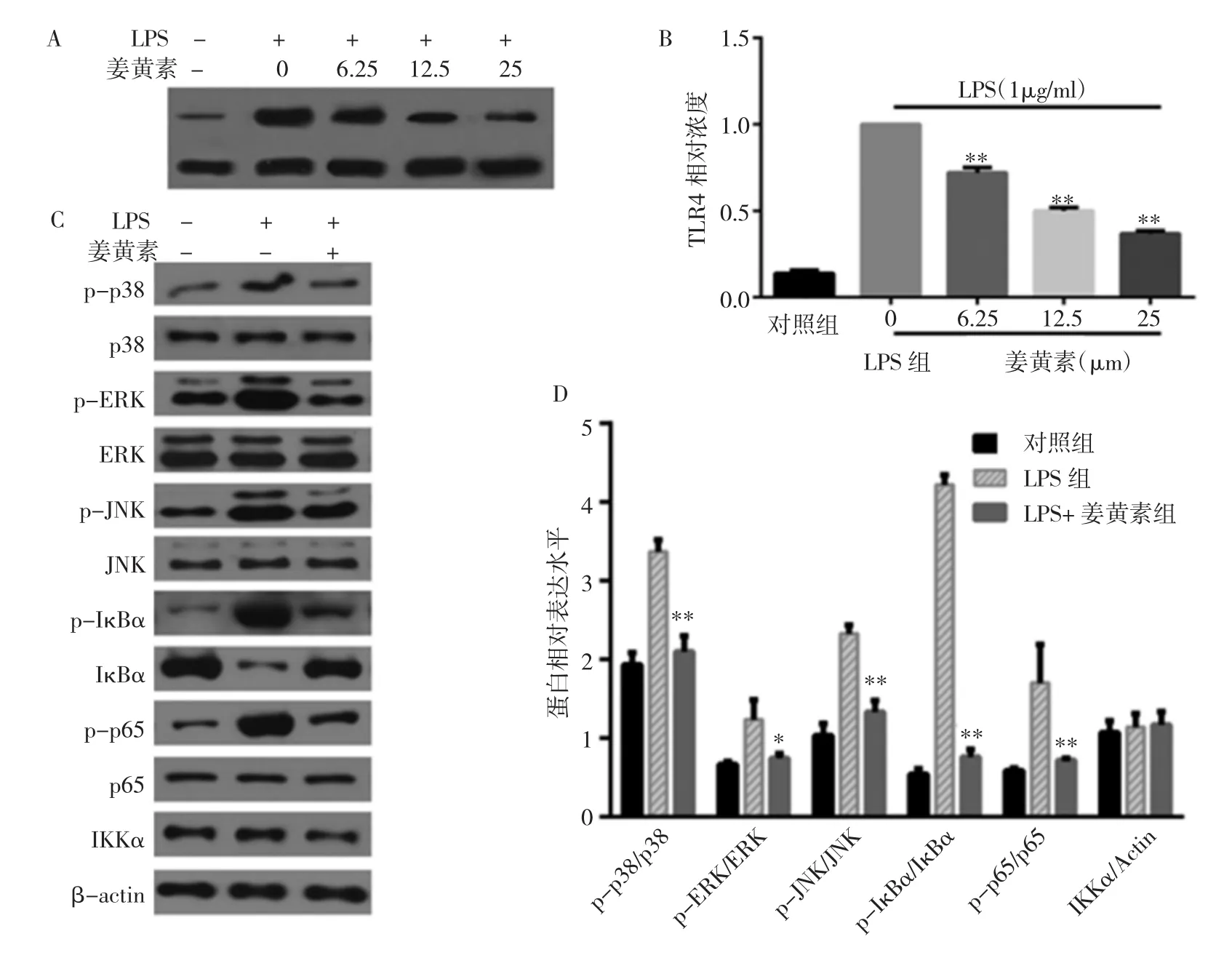
圖2 各組巨噬細胞TLR4及p38/ERK/JNK/IKK/IκBα/p65表達水平的比較(A:各組巨噬細胞TLR4蛋白表達的電泳圖;B:各組巨噬細胞TLR4蛋白表達水平的比較;C:各組巨噬細胞p38/ERK/JNK/IKK/IκBα/p65蛋白表達的電泳圖;D:各組巨噬細胞p38/ERK/JNK/IKK/IκBα/p65蛋白表達水平的比較;與LPS組比較,*P<0.05,**P<0.01)

圖3 各組巨噬細胞TNF-α和IL-6表達水平的比較(A:各組巨噬細胞p38/ERK/JNK/IKK/IκBα/p6蛋白表達的電泳圖;B:各組巨噬細胞p38/ERK/JNK/IKK/IκBα/p6蛋白水平的比較;C:各組巨噬細胞TNF-α和IL-6 mRNA表達水平的比較;與LPS組比較,*P<0.05,**P<0.01)
巨噬細胞作為一群具有可塑性的免疫細胞,可因不同的環境刺激分化為功能各異的亞型[8]。根據不同的細胞特征和功能,巨噬細胞通常被分為M1型巨噬細胞和M2型巨噬細胞。M1型巨噬細胞是由LPS和干擾素γ等微生物產物或促炎因子激活的。它們通過產生促炎細胞因子,如IL-1、誘導iNOS和TNF-α等,促進持續的炎癥反應并引發組織損傷[9]。另一方面,M2型巨噬細胞是由IL-4或IL-13誘導的,通過分泌各種抗炎因子,起到減輕炎癥反應和修復組織的作用[10]。識別這兩種巨噬細胞的方式主要依賴于各自的生物標記,如M1型(iNOS,CD11c,MARCO)和 M2 型(Arg1、CD68、CD206)[11]。本文中iNOS和CD206分別作為M1型巨噬細胞和M2型巨噬細胞的生物學標志。其中,M1型及M2型巨噬細胞分別執行著“破壞”及“修復”的功能[12]。M1型巨噬細胞可通過釋放大量的促炎因子引發炎癥反應、促進細胞凋亡。M2型巨噬細胞則分泌抗炎因子以減輕過度的炎癥反應[13]。因此,通過調控巨噬細胞的極性達到免疫平衡將成為治療炎癥相關疾病的有效手段。
姜黃素作為一種相對安全的植物多酚,具有廣泛的藥理作用,可用于防治心血管疾病、腫瘤、炎癥性腸病、缺血性腦卒中等疾病[14-15]。大量的實驗研究表明,姜黃素具有強大的免疫調節及抗炎作用[5,16]。有研究發現,姜黃素可通過增加M2型巨噬細胞、減少M1型巨噬細胞,從而影響巨噬細胞功能,減輕炎癥反應[17-19]。本研究顯示姜黃素可抑制巨噬細胞向M1型極化,減少巨噬細胞中促炎因子(TNF-α及IL-6)的表達。
本研究通過Western blot方法分別檢測p38/ERK/JNK/IKK/IκBα/p65 的總體水平及磷酸化水平,結果提示姜黃素可抑制TLR4-MAPK/NF-κB信號通路的激活,后者被證實參與調控M1型細胞因子(TNF-α及IL-6)的表達。姜黃素可通過作用于多種分子靶點(包括各種蛋白質激酶和轉錄因子)調控細胞的炎癥及免疫反應[20]。TLR4作為一種病原模式識別受體,在巨噬細胞炎癥反應的發生、發展中起到至關重要的作用[21]。通常情況下,TLR4可被LPS激活,通過調控下游信號通路促使巨噬細胞向M1型極化,進而引發細胞的炎癥反應[22]。本研究也提示LPS能顯著激活TLR4及其下游的MAPK以及NF-κB信號通路。NF-κB作為一種廣泛存在的轉錄因子,參與轉錄各種與炎癥和免疫反應相關的基因。最近的研究證實,姜黃素可以通過阻斷TLR4/MyD88/NF-κB信號通路減輕急性炎癥損傷[23-25]。另一項研究表明,姜黃素可通過抑制TLR4的激活、ERK1/2及p38 MAPK的磷酸化、NF-κB的核移位減少炎癥介質的過度表達。本研究結果也表明,M1型細胞因子(TNF-α及 IL-6) 的表達依賴于TLR4/MAPK信號通路的激活。
綜上所述,姜黃素可通過抑制TLR4-MAPK/NF-κB信號通路的激活,從而抑制巨噬細胞向M1型極化并減少炎癥因子TNF-α及IL-6的表達。該結果將為姜黃素在炎癥相關疾病防治領域中的應用提供進一步的理論依據。