鉤吻素子對大鼠神經(jīng)病理性痛行為學(xué)和脊髓機制研究
金桂林,何賽娣,岳榮彩,許 盈,葉麗香,俞昌喜
神經(jīng)病理性疼痛(neuropathic pain, NP)是臨床常見的慢性疼痛,其發(fā)病機制復(fù)雜,治療困難,常伴有睡眠障礙、焦慮、抑郁等神經(jīng)精神疾病,嚴(yán)重影響患者的工作和生活質(zhì)量[1]。目前臨床治療NP的常用藥物有抗癲癇藥、抗抑郁藥及阿片類鎮(zhèn)痛藥等,但因其治療作用有限或毒副作用較大而不能讓人滿意,因此新型抗NP藥物亟待研發(fā)。
鉤吻素子為胡蔓藤科植物鉤吻(GelsemiumelegansBenth)中含量較高的一種吲哚類生物堿[2]。本課題組前期研究發(fā)現(xiàn),鉤吻素子具有較好的抗炎和鎮(zhèn)痛作用,且具有高效低毒的特征,具有創(chuàng)制新型鎮(zhèn)痛藥的潛能,但其作用機制尚不清楚[3-5]。本研究選用大鼠坐骨神經(jīng)分支選擇性損傷(spared nerve injury, SNI)所引起的NP模型,進(jìn)一步明確鉤吻素子的抗NP作用,并探討其可能的作用機制。
1 材料與方法
1.1材料
1.1.1動物 體質(zhì)量為200~250 g的雄性SD大鼠[由上海斯萊克實驗動物有限責(zé)任公司提供,許可證號: SCXK(滬)2009-0005]。實驗操作經(jīng)動物倫理委員會批準(zhǔn)并遵循國際和本地相關(guān)條例。
1.1.2試劑 鉤吻素子鹽酸鹽(由本課題組從國產(chǎn)鉤吻中分離純化,實驗室批號KM201309,純度99%以上);加巴噴丁(上海信合化工有限公司),純度99%;水合氯醛。
1.1.3儀器 機械測痛儀(Dynamic Plantar Aesthesiometer 37450型,意大利UGO Basile公司);酶標(biāo)儀(Epoch,美國BioTek公司);免疫印跡成像系統(tǒng)(Carastream公司);電泳儀(美國BIO-RAD公司)。
1.2方法
1.2.1大鼠機械痛閾值測定 參照文獻(xiàn)[6]的方法,使用測痛儀測定大鼠的機械痛閾值。待大鼠適應(yīng)環(huán)境30 min后,用刺激絲垂直刺激大鼠后足測痛點。儀器加壓速度為2 g/s,持續(xù)時間25 s,最大刺激強度為50 g。按開始鍵,儀器自動記錄機械刺激力度數(shù)值。兩次測量間隔不少于5 min,每只動物測量3次,取平均值。
1.2.2大鼠SNI誘導(dǎo)NP模型的制備及給藥 大鼠SNI模型的建立方法參照文獻(xiàn)[7]。大鼠腹腔注射10%的水合氯醛,消毒處理后依次暴露,并分離左側(cè)后肢肱二頭肌、坐骨神經(jīng)主干、脛神經(jīng)、腓總神經(jīng)及腓腸神經(jīng),絲線結(jié)扎脛神經(jīng)和腓總神經(jīng),并切斷靠近結(jié)扎的遠(yuǎn)側(cè)端。假手術(shù)組僅作暴露神經(jīng)處理。術(shù)后大鼠逐層縫合,注射青霉素預(yù)防感染。模型成功判斷標(biāo)準(zhǔn):基礎(chǔ)痛閾合格的動物,于SNI手術(shù)后第3天,術(shù)側(cè)痛閾值低于非術(shù)側(cè)65%,認(rèn)定為SNI模型合格動物;術(shù)側(cè)痛閾值高于非術(shù)側(cè)痛閾值65%的動物不用于該實驗。SNI合格及假手術(shù)大鼠,隨機分為假手術(shù)組、模型組、鉤吻素子低劑量及高劑量組(0.6和3.0 mg/kg)以及加巴噴丁對照組(800 mg/kg),連續(xù)給藥7 d后,測機械痛閾值。
1.2.3Western-blot法測定膠質(zhì)纖維酸性蛋白(glial fibrillary acidic protein,GFAP) 大鼠測痛結(jié)束后,取L4~L6的脊髓組織置于1 mL勻漿器中勻漿。裂解液裂解后提取總蛋白,BCA法測定蛋白濃度。轉(zhuǎn)膜結(jié)束后,取出PVDF膜,用5%脫脂奶粉室溫封閉1~2 h;加入一抗4 ℃孵育過夜:小鼠抗GAPDH(1∶5 000)、兔抗GFAP(1∶1 000)、兔抗LC3B(1∶1 000)、兔抗Beclin 1(1∶1 000)、兔抗p62(1∶1 000)。棄去一抗,TBST清洗10 min×3次;加入辣根過氧化物酶標(biāo)記的二抗,室溫孵育1~2 h:山羊抗小鼠(1∶5 000)、山羊抗兔(1∶5 000);TBST清洗10 min×3次。用超敏ECL發(fā)光試劑盒顯影,顯影時間為1~5 min。GAPDH作為內(nèi)參,采用Image J對條帶進(jìn)行吸光度的分析。
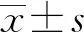
2 結(jié) 果
2.1鉤吻素子對SNI大鼠的鎮(zhèn)痛作用 假手術(shù)組術(shù)側(cè)和對側(cè)痛閾值差別無統(tǒng)計學(xué)意義(P=0.982);SNI手術(shù)組術(shù)側(cè)痛閾值顯著低于對側(cè)(P<0.01),且顯著低于假手術(shù)組術(shù)側(cè)(P<0.001);SNI大鼠和假手術(shù)大鼠對側(cè)痛閾值差別無統(tǒng)計學(xué)意義(P>0.05,圖1)。各給藥組大鼠痛閾值變化如圖2所示,SNI模型組大鼠痛閾值顯著低于假手術(shù)組(P<0.001);與SNI模型組比較,鉤吻素子(3.0 mg/kg)組和加巴噴丁(800 mg/kg)組顯著降低機械痛閾值,差別具有統(tǒng)計學(xué)意義(P<0.001和P<0.05),但此兩組對SNI大鼠的鎮(zhèn)痛效應(yīng)差別卻無統(tǒng)計學(xué)意義(圖2)。
2.2鉤吻素子對SNI大鼠脊髓星形膠質(zhì)細(xì)胞活化的作用 與假手術(shù)組比較,模型組的GFAP水平顯著升高(P<0.01);與模型組比較,鉤吻素子可顯著降低GFAP水平(P<0.01)。鉤吻素子高、低劑量組對GFAP的影響差別有統(tǒng)計學(xué)意義(P<0.05,圖3)。將各組大鼠最后一次的痛閾值與GFAP水平作相關(guān)性分析,顯示二者呈中度負(fù)相關(guān),相關(guān)系數(shù)為-0.717(P<0.01)。

SNI:分支選擇性損傷. 與假手術(shù)組術(shù)側(cè)比較,##:P<0.01,###:P<0.001;與SNI模型組對側(cè)比較,☆☆:P<0.01;☆☆☆:P<0.001.

SNI:分支選擇性損傷. 與假手術(shù)組比較,###:P<0.001;與SNI模型組比較,☆:P<0.05;☆☆:P<0.01.
2.3鉤吻素子對SNI大鼠脊髓自噬水平的影響 SNI大鼠脊髓LC3-Ⅱ/Ⅰ蛋白表達(dá)比正常大鼠高,鉤吻素子可以顯著增加LC3-Ⅱ在脊髓水平。SNI大鼠脊髓Beclin 1蛋白表達(dá)和正常大鼠比較差別無統(tǒng)計學(xué)意義,鉤吻素子對Beclin 1在脊髓水平的表達(dá)無影響。SNI大鼠脊髓p62蛋白表達(dá)和正常大鼠比較差別無統(tǒng)計學(xué)意義,低劑量鉤吻素子對p62在脊髓水平的表達(dá)影響較小(P>0.05),高劑量鉤吻素子對SNI大鼠脊髓水平p62的表達(dá)和正常大鼠比較差別有統(tǒng)計學(xué)意義(P<0.05,圖4~5)。

SNI:分支選擇性損傷;GFAP:膠質(zhì)纖維酸性蛋白. A:各組大鼠脊髓GFAP蛋白表達(dá)水平;B:各組大鼠脊髓GFAP蛋白吸光度值. 與假手術(shù)組比較,#:P<0.01;與SNI模型組比較,☆:P<0.01.

圖4 鉤吻素子對SNI誘導(dǎo)神經(jīng)病理性疼痛鼠脊髓自噬相關(guān)蛋白表達(dá)的影響
3 討 論
NP是一種嚴(yán)重影響人類身心健康的疾病,其生理和病理機制極其復(fù)雜,目前尚不完全清楚。近年來,大量證據(jù)提示,膠質(zhì)細(xì)胞介導(dǎo)的神經(jīng)炎癥反應(yīng)在NP的發(fā)生發(fā)展過程中起著關(guān)鍵作用[8-10]。神經(jīng)膠質(zhì)細(xì)胞,主要為小膠質(zhì)細(xì)胞和星形膠質(zhì)細(xì)胞在NP過程中迅速活化,釋放大量致炎細(xì)胞因子和趨化因子等物質(zhì),并加重神經(jīng)元和膠質(zhì)細(xì)胞的活化,造成多種神經(jīng)細(xì)胞形成正反饋調(diào)節(jié)網(wǎng)絡(luò),進(jìn)一步加重疼痛[11]。因此,抑制膠質(zhì)細(xì)胞活化,減少中樞炎癥水平,可顯著抑制NP。

A:LC3; B:Beclin 1; C:p62. 與假手術(shù)組比較,##:P<0.01;與SNI模型組比較,☆:P<0.05,☆☆:P<0.01,☆☆☆:P<0.001.
本研究在SNI誘導(dǎo)的大鼠NP模型上,觀察到灌胃給予的鉤吻素子可呈劑量和時間依賴性地對抗SNI大鼠機械超敏作用,且鉤吻素子3.0 mg/kg組和加巴噴丁800 mg/kg組對SNI大鼠的痛敏改善作用相當(dāng)。本實驗選取加巴噴丁為陽性對照藥,加巴噴丁為抗驚厥藥物,主要作用于神經(jīng)細(xì)胞膜表面鈣離子通道,可減少谷氨酸、去甲腎上腺素及p物質(zhì)等的釋放,可緩解疼痛。但在本實驗中,加巴噴丁對SNI誘導(dǎo)的NP鎮(zhèn)痛作用劑量較大,這也提示鉤吻素子有較好的抗NP作用。在連續(xù)給藥過程中,鉤吻素子無耐受現(xiàn)象,且可能有藥效累加效應(yīng)。相對于阿片類鎮(zhèn)痛藥,鉤吻素子無身體依賴性和精神依賴性,這也是其作為鎮(zhèn)痛藥的一個優(yōu)點[12]。除此之外,本課題組前期研究發(fā)現(xiàn),鉤吻素子還具有抗焦慮作用[13],可緩解NP患者的緊張焦慮情緒。這都為鉤吻素子作為抗慢性疼痛新藥開發(fā)提供有利條件。
鑒于較好的鎮(zhèn)痛作用,從鉤吻素子抑制星形膠質(zhì)細(xì)胞的活化來探討其鎮(zhèn)痛作用機制,發(fā)現(xiàn)鉤吻素子抑制星形膠質(zhì)細(xì)胞活化與其抗慢性疼痛的作用呈相關(guān)性。因GFAP是星形膠質(zhì)細(xì)胞的骨架蛋白,也是星形膠質(zhì)細(xì)胞活化的標(biāo)志物。因此,本實驗通過Western-blot測定脊髓中的GFAP水平來觀察脊髓星形膠質(zhì)細(xì)胞的活化情況,同時以大鼠脊髓自噬相關(guān)蛋白LC3-Ⅱ,Beclin 1及p62表達(dá)水平為指標(biāo),觀察在SNI疼痛模型中自噬水平的變化以及不同濃度鉤吻素子對SNI大鼠在脊髓水平自噬的影響。小膠質(zhì)細(xì)胞活化主要發(fā)生在NP發(fā)生的初始階段,而星形膠質(zhì)細(xì)胞與慢性疼痛的持續(xù)關(guān)系密切[14]。文獻(xiàn)報道,星形膠質(zhì)細(xì)胞活化抑制劑氟代檸檬酸可顯著減輕NP[15],提示抑制星形膠質(zhì)細(xì)胞活化是治療NP的研究方向。星形膠質(zhì)細(xì)胞作為中樞數(shù)量最龐大的細(xì)胞,是致炎細(xì)胞因子的主要來源之一。星形膠質(zhì)細(xì)胞的激活在多種慢性疼痛模型上都被證實,表現(xiàn)為細(xì)胞數(shù)量增加,GFAP表達(dá)增加[16-17]。通過注射GFAP反義核苷酸妨礙GFAP轉(zhuǎn)錄,或通過注射星形膠質(zhì)細(xì)胞活化抑制劑都可改善外周神經(jīng)損傷引起的NP[18]。本研究發(fā)現(xiàn),鉤吻素子可顯著降低SNI大鼠的GFAP水平,提示星形膠質(zhì)細(xì)胞可能是鉤吻素子鎮(zhèn)痛作用的靶細(xì)胞。同時,本研究探索了鉤吻素子對SNI大鼠脊髓的自噬水平。自噬是細(xì)胞吞噬自身細(xì)胞質(zhì)蛋白或降解細(xì)胞器實現(xiàn)自我更新的過程,也是細(xì)胞自我保護(hù)機制[19]。研究表明,自噬對NP的發(fā)生、發(fā)展等都有重要作用。在NP過程中脊髓自噬水平顯著降低。反之,通過藥理學(xué)手段促進(jìn)自噬可顯著減輕NP程度,也可延緩NP的發(fā)生[20-21]。本研究通過檢測大鼠脊髓自噬相關(guān)蛋白LC3-Ⅱ,Beclin 1及p62,發(fā)現(xiàn)SNI大鼠脊髓自噬水平出現(xiàn)抑制,與文獻(xiàn)報道一致[22]。自噬進(jìn)程受阻可導(dǎo)致細(xì)胞底物降解不完全,引起大分子及細(xì)胞器的堆積,進(jìn)而導(dǎo)致NP的加重。而給予鉤吻素子后,脊髓LC3-Ⅱ/Ⅰ和p62的表達(dá)顯著降低,提示鉤吻素子可以上調(diào)NP脊髓自噬。NP大鼠脊髓自噬可發(fā)生在神經(jīng)元和星形膠質(zhì)細(xì)胞[22]。然而,鉤吻素子發(fā)揮抗NP作用與其促進(jìn)星形膠質(zhì)細(xì)胞自噬及抑制星形膠質(zhì)細(xì)胞活化的關(guān)系,還需進(jìn)一步研究。
綜上所述,鉤吻素子可顯著緩解SNI誘導(dǎo)的NP,同時上調(diào)SNI大鼠脊髓的自噬水平,抑制脊髓星形膠質(zhì)細(xì)胞活化。該研究為鉤吻素子作為抗慢性疼痛藥物的研發(fā)提供了一定的依據(jù)。

