基于SimVascular的腹主動脈復雜模型構建與血流動力學仿真研究
吳全玉 潘玲佼 于冬梅 范振敏 張文強 陶為戈
摘要:研究在不同入口血流速度下,仿真計算逼近人體腹主動脈和髂動脈及其分支形狀的血流動力學參數的變化情況。依據獲取的CT血管數據,采用開源SimVascular軟件構建腹主動脈以及附近主要動脈的血管模型,具體包括腹主動脈干、腹腔動脈、脾動脈及其分支肝動脈,腸系膜上下動脈及其分支,左右髂動脈及其分支和左右腎動脈。通過Fluent進行仿真計算,主要分析人體血管各處的血流速度矢量、靜態壓力和剪切力的血流動力學表現。在入口處施加不同的速度載荷條件,分別定義收縮期的類拋物線函數速度和平均定值速度,發現在這兩種條件下,血管在分叉和小直徑血管處,都出現較大速度和剪切力。但是在腸系膜上動脈和左右髂動脈的遠端出現明顯的不同。同時還發現入口速度的逐漸增加,會加倍血管各分叉處的血流速度。總之,成功構建復雜血管網絡并進行仿真計算,將有助于醫生更深入理解動脈血流力學特征。
關鍵詞:腹腔主要動脈系;血流動力學;血流速度;靜態壓力;剪切力
目前,心腦血管疾病仍然是全球人類死亡和致殘的主要原因,其引發的核心在于血流的局部和區域問題[1]。 要在人體上進行直接血流參數測量,運用有創測量技術在實踐中存在著各種局限性,而通過計算流體力學(computational fluid dynamics CFD)的方法,可以計算出各種血流指標,該方法已經被廣泛應用到各處動脈血管的研究中[2-3]。鄭河榮等[4]采用MRI斷層腦血管數據,運用中國科學院自動化研究所開發的MITK平臺,快速實現腦血管的3D重建,通過對腦內動脈血流的仿真,給出腦動脈血流的特征參數;Saho[5]等人采用顱內血管斷層技術,結合3-D流體力學模型,分析了復雜腦動脈瘤的血流情況;陳珍[6]等研究頸內動脈狹窄時 Willis環的血液動力學特點,發現當狹窄大于50% 時,環內血液需要重新分配,只有通過提升壓力才能有效增加腦部供血;Potters[7]等人構建頸內動脈及相關疾病雙向流固耦合模型的血流模擬;劉瑩[8]等通過頸動脈和冠狀動脈內非穩態血流的數值模擬,探索頸動脈粥樣斑塊形成與發展機理。在腹部主動脈的研究方面學者較多,孫正[9]等人研究主動脈的受力分布情況;Nestola[10]等人研究主動脈瘤的生理和病理原因,仿真中心動脈和肺動脈分流的受力情況;Al-Rawi[11]等人評估了主動脈狹窄對血流和血壓的影響;還有Caballero [12] 等人總結了過去10 年來腹腔動脈血流動力學研究的情況,發現相關的疾病與血管的病理性改變通常有一定的聯系,但是人體腹動脈瘤等發病機制尚不明確。近年來,關于血流動力學變化在動脈瘤等心血管疾病形成機制中的作用日益受到國內外學者重視,并普遍認為動脈血管和血流動力學的參數與動脈疾病有著密切的關系。然而,在動脈血管和血液動力學研究中,大多采用簡化的血管和血液模型,對真實接近人體復雜血管和血液的流體分析研究,在國內也尚不多見。本研究采用免費開源的SimVascular血管建模軟件[13]和CFD方法,通過比較不同入口的血流速度初始條件,研究了復雜腹主動脈及其分支的血流速度流線、靜態壓力和壁面總剪切力的分布情況。
1? ? 實驗內容與方法
1.1? 模型的建立
目前有較多的商業軟件可以利用Computed tomography (CT)和Magnetic resource imaging(MRI)獲取的醫學血管數據,重建主要動脈血管的幾何模型。然后導入到CFD軟件包進行血流參數的仿真分析[14-15]。然而構建逼近人體動脈血管的3-D模型,需要經過復雜的操作過程才能完成[16,17]。為此,在2007年斯坦福大學的Charles Taylor[18]帶領團隊開發了SimVascular血流動力學仿真軟件,經過多年的發展,目前已經成功開發出多種升級版本,適應于Windows、Linux和iOS三種主流的操作系統。該軟件代碼免費開源,方便自定義各種專業功能,操作簡單易用。通過醫療圖像數據SimVascular軟件系統可以靈活高效地構建血管的3-D動脈模型,并且可以提供完整的網格劃分和邊界,定義一整套的血液動力學仿真計算。具體的模型構建過程如圖1所示。
依據人體的雙源CT血管數據,構建腹主動脈以及附近主要動脈的血管模型,模型包括57個面、56條邊、20個頂點。具體包括主動脈干、腹腔動脈、腹腔動脈二分支、脾動脈及其一分支肝動脈、腸系膜上動脈及其二分支、腸系膜下動脈、左髂動脈及其三分支、右髂動脈及其三分支、左腎動脈,左腎上腺動脈,右腎動脈,右腎下動脈等主要腹腔內動脈。
根據以往學者的研究經驗,血液定義為不可壓縮的牛頓流體,血液的密度為1 060 kg/m3,黏度采用ANSYS? FLUET系統定義的卡羅流體模型參數,具體參數定義見參考文獻[19]。入口條件:正常人體腹主動脈血流速度的最大值約為1.2 m/s。然而人類的心臟射血時間是周期性時變的,因此腹主動脈入口處的速度設定采用一種類拋物線定義的方案,未被設定為一個常數,而是采用帶有時變周期性的函數[8]。在Fluent中定義UDF,收縮期的正弦波峰值速度為1.2 m/s,最小速度為為0.1 m/s;假設心率為75 次/min, 每個周期的持續時間是0.8 s。在上述入口條件下,又采用了另一種定值速度方案[20],通過計算上述一個周期內的平均血流速度約為0.3 m/s,將其作為新的入口條件下再次進行計算。出口條件:設定所有出口初始條件的流動已經穩定,各個分支動脈輸出壓力設置為零,并且具有自然輸出,本文沒有使用解剖和生理學標準,通過合適的終端阻力雙彈性腔模型來定義每個出口的條件[21,22]。壁面條件:管壁滿足無滑移條件, 由于血管壁的徑向速度非常小, 故將壁面的徑向速度簡化設定為零。
1.2? 網格參數
顯示血液幾何的網格部分模型。將所建的幾何模型導入到Workbench中,采用系統自帶的ICEM進行網格劃分。血液模型網格由四節點四面體單元構成,算法為自適應調整方法,內部節點全局調整規劃。最后在標準單位下,得到網格的統計數據:模型中節點的數量是238341,元素是1188 703。所得到的網格最小尺寸是0.20,最大尺寸1.00,平均尺寸是0.83,標準偏差是0.098。可見劃分的網格滿足計算的最優標準。
1.3? 仿真方法
使用商用的Fluent軟件進行模擬計算,仿真基本理論是Navier-Stokes控制方程。在PISO方案中,采用Fluent中的瞬態模擬和壓力速度耦合的雙精度進行計算;殘差檢查收斂設置為0.000 1。 整個血流模型的計算從靜態流體開始,采用定點模式計算,時間步長設置為0.1 s,時間步數為8,最大迭代次數為200 次,同時還設置每隔0.1 s保存一次計算的結果。 最后使用CFD-Post來處理整個范圍從0 s到0.8 s的計算結果,提取每個時間段的計算結果,主要包括入口和出口的平均速度以及靜態壓力,壁面流體的剪切力等進行分析研究,分別給出了三個時間點T1(0.1 s),T2(0.2 s)和T8(0.8 s)的速度、靜壓力和壁面剪切力的圖形結果。另外,還給出了兩種方案仿真的對比結果。
2? ? 仿真結果與分析
通過定義拋物線入口和平均值入口速度兩種條件,得到腹主動脈以及髂動脈模型的流體仿真計算結果,總體情況如圖4、5、6和7所示,觀察對比模型仿真計算得到的血液速度流線圖、靜態壓力圖以及血管內壁面的剪切力圖。主要進行腹主動脈及其分支的概念性結果仿真,沒有做深入的血流粒子跟蹤、具體位置血壓的分析和雙向的血管壁血壓耦合效應等。
2.1? 血流速度
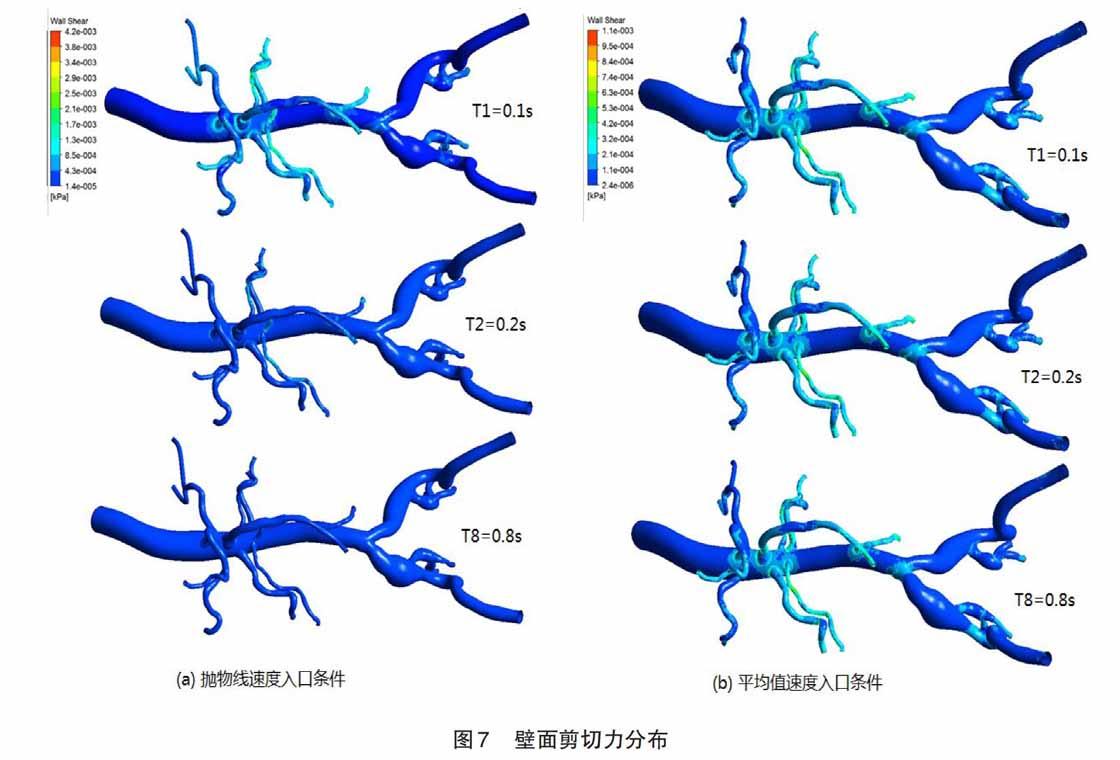
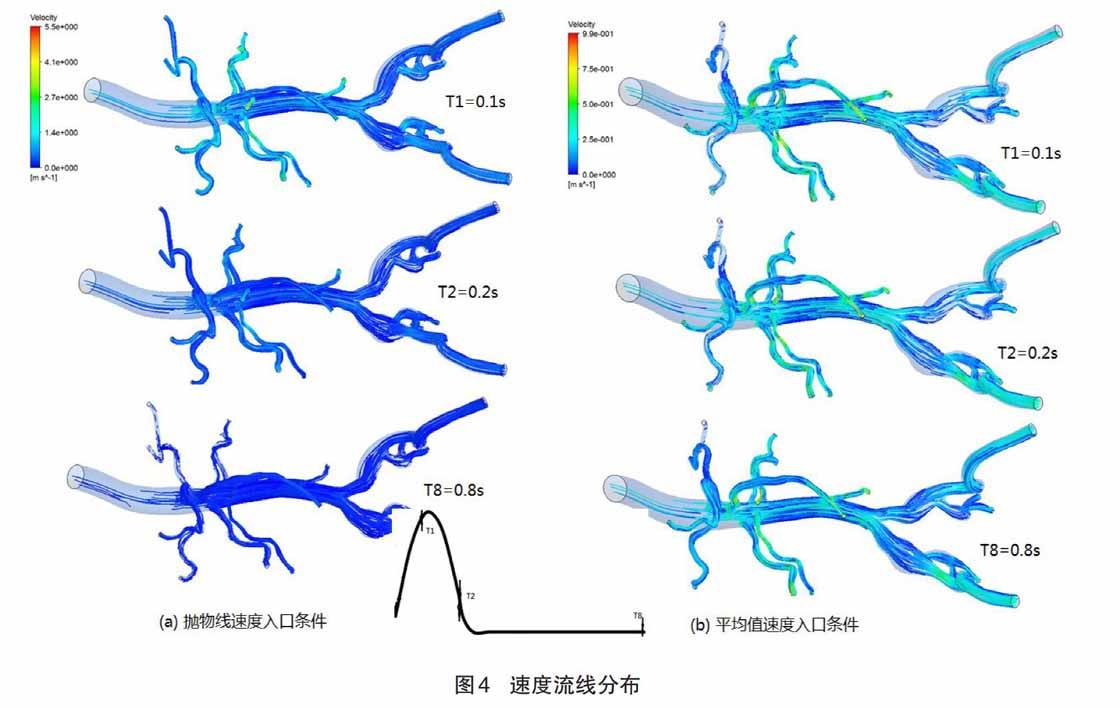
給出兩種不同入口速度條件下,采用不同標尺刻度,血管模型整體速度流線圖變化的情況。圖4(a)表示類拋物線速度入口條件下的計算結果,通過標尺的最大刻度值可以看出,血液在模型中的某處最大速度是5.5 m/s,是定義入口速度最大值1.2 m/s的4.58倍。在T1時刻,速度的最大值主要出現在模型血管的分叉處和血管直徑較小處,具體分布在腹主動脈分叉處,左右腎動脈處,髂動脈分叉處。在T2時刻,因為入口速度的下降,可以看出腹主動脈腔的速度下降接近零值,只有小直徑血管的遠端血流速度大約是1.4 m/s。在T8時刻,因為入口速度一直是0.1 m/s,所以血管各處的速度流線圖趨于穩定。圖4(b)表示平均值速度入口條件下的計算結果,通過其刻度尺可以看出,血液在模型中的最大速度是0.99 m/s,是定義入口速度平均值0.3 m/s的3.3倍。在其T1、T2和T8時間點的速度流線圖中,幾乎觀察不出區別,通過跟圖4(a)結果進行對比,發現血管在分叉和小直徑血管處,都出現較大速度。但是在腸系膜上動脈和左右髂動脈的遠端出現明顯的不同,在圖4(b)中發現腸系膜上動脈遠端有較大的速度。
2.2? 靜態壓力
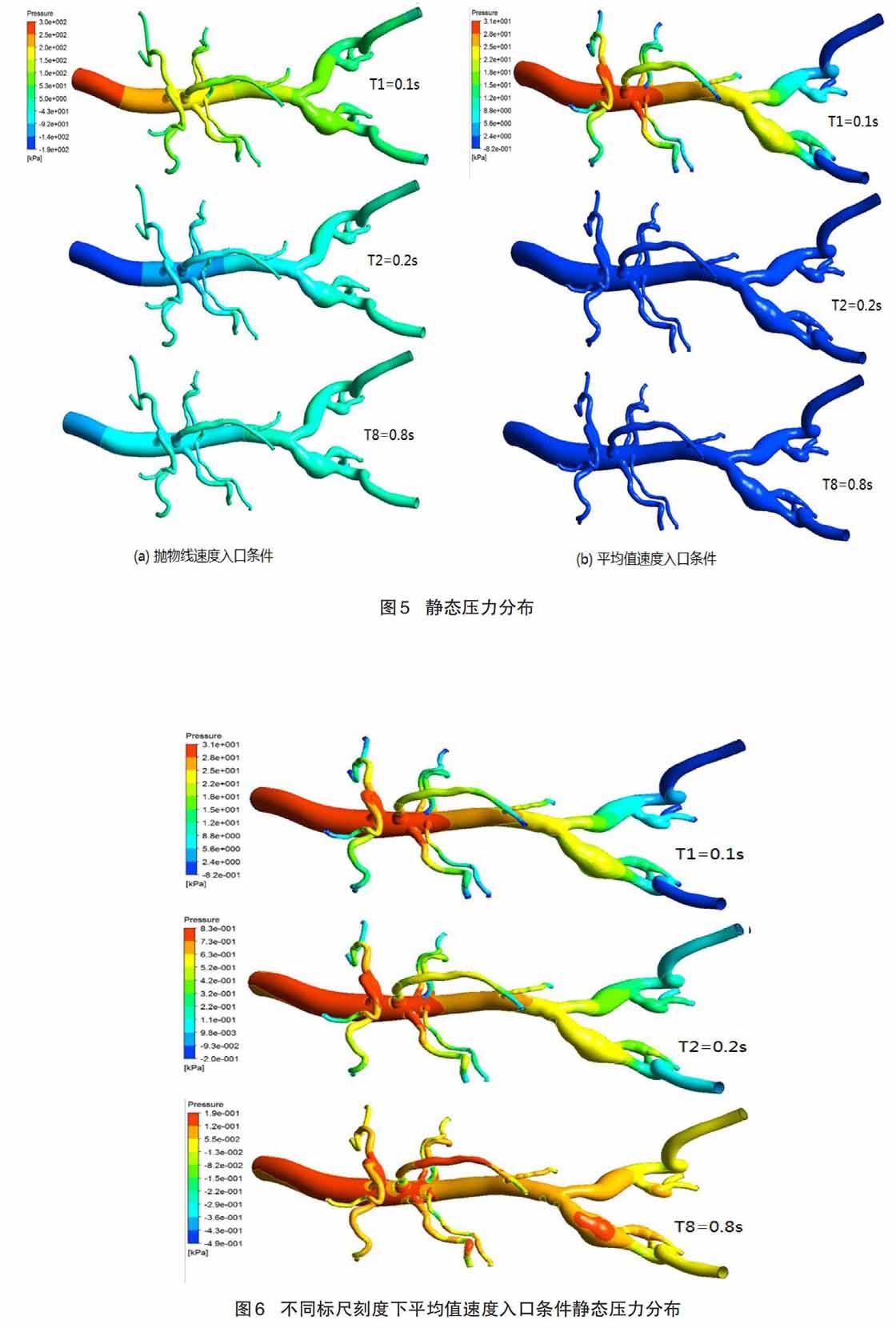
表示兩種不同入口速度條件,采用不同標尺刻度下,血管模型整體靜態壓力分布變化的情況。圖5(a)表示類拋物線速度入口條件下的靜態壓力計算結果,通過標尺的最大刻度值可以看出,血液在模型中的入口處最大壓力值是300 kPa,最小值是-190 kPa,據此看出血液存在著回流現象,跟實際臨床觀察到的現象一致。在T1時刻,壓力的最大值主要出現在模型血管的入口處,同時發現從入口到遠端被均勻的壓力分段,每一段的壓力值逐漸減小,最小值5 kPa出現在遠端血管模型。在T2時刻,因為入口速度的下降,出現血液的回流,導致整個血管模型出現負壓力值的分段,特別在入口處壓力最小值是-190 kPa 。在T8時刻,由于入口速度一直穩定在0.1m/s,所以血管入口處壓力逐漸增大,并且各處的壓力值趨于穩定,但是壓力分段出現明顯。圖5(b)表示平均值速度入口條件下的靜態壓力計算結果,通過其刻度尺可以看出,血液在模型中的入口處最大壓力值是31 kPa,最小值是-0.82 kPa,據此可以看出在血流速度0.3 m/s的條件下,血液依然存在著回流現象。在其T1時刻,血管模型壓力值分段較為明顯, 腹主動脈入口處以及附近各分叉處都出現最大的壓力值,且分布面積較大,分叉血管的遠端出現較小面積的負壓力值,但是在左右髂動脈的遠端,出現大面積的回流現象,導致出現負壓力值-0.82 kPa。在T2和T8時間點的靜態壓力圖中,采用統一的標尺刻度值,幾乎觀察不出區別,血管模型整體壓力值趨于負值。
為了能夠清楚的觀察到在平均值速度入口件下的靜態壓力計算結果,如圖6所示,采用不同的刻度尺可以看出整個壓力值隨著時間變化的情況。在T1時刻,腹主動脈入口處出現最大壓力值是31 kPa,在左右髂動脈的遠端發現最小值-0.82 kPa。在T2時間點,入口處依然是壓力的最大值0.83 kPa,跟T1時間點的最大值對比,下降了37.35倍。但是左右髂動脈以及小直徑血管的遠端沒有出現負壓力值,除了右腎下動脈分叉處。在T8時刻,腹主動脈入口處的壓力最大值下降到0.19 kPa,觀察發現整個血管模型是隨著時間推移壓力逐漸減小,主要是因為大量回流的影響。在腹主動脈腔分叉處、腸系膜上動脈中間段、右髂動脈血管模型直徑變大處,出現較為明顯的壓力值。可見血管在流速較小的層流狀態,可以發現不僅在小直徑血管處會出現大壓力,而且在大直徑血管的分叉位置前,也會出現較大的靜態壓力。
2.3? 剪切力
給出兩種不同入口速度條件,采用不同標尺刻度下,血管壁面整體剪切力分布變化的情況。圖7(a)表示類拋物線速度入口條件下的壁面剪切力計算結果,通過標尺的最大刻度值可以看出,在模型血管壁面中出現的最大剪切力值是4.2 Pa,最小值是0.014 Pa。 在T1時刻,發現從腹主動脈入口處到遠端沒有均勻的剪切力分段出現,剪切力的最大值主要出現在模型血管的分叉處和血管直徑較小處,具體分布在腹主動脈腔分叉處,腸系膜上動脈遠端,左右腎動脈附近處,腸系膜下動脈,髂動脈分叉處。在T2時刻,壁面剪切力迅速下降到最小值, 除了左右腎上下動脈。在T8時刻,因為入口速度定義的是0.1 m/s,所以血管壁面各處的剪切力趨于穩定在最小值,其數值較小。圖7(b)表示平均值速度入口條件下的剪切力計算結果,通過其刻度尺可以看出,在模型血管壁面中出現的最大剪切力值是1.1 Pa,最小值是0.002 4 Pa。通過跟圖4(a)結果進行對比,發現血管模型的最大速度比在4倍的基礎上,其出現最大剪切力的比值也接近4倍,證明其剪切力跟入口速度梯度之間的一定關系。在其T1、T2和T8時間點的壁面剪切力圖中,幾乎觀察不出區別,通過跟圖4(a)結果進行對比,發現血管在分叉和小直徑血管處,都出現一致的剪切力分布結果。
3? ? 討論
動脈血管是分布于人體內部大小不一的管腔狀結構,是人體器官系統執行其生理功能的重要基礎。各類心腦血管疾病是由于不同的血液動力學參數因素引起,這些因素不僅取決于血管的復雜程度和幾何形狀,而且還受到血液的流變特性影響[23]。目前臨床醫學的解決方案僅限于簡單癥狀,花費高昂的測試費用,浪費大量的時間精力。為此,隨著計算機建模技術的發展,采用CFD仿真計算已被認可和有效地用于解決這些問題。通過開源的SimVascular軟件,依據雙源CT血管數據,成功構建復雜的腹主動脈及其分支的血管模型,如圖2所示,基本滿足三維血管節段、迂曲度、長度、截面積、血管分支與血管網絡三個層次的定量特征指標[24],特別在分支的指標上,具體體現在主要分支數、終端分叉數、各類節點數、分叉角度和內分叉距離等參數。能夠起到拋磚引玉的作用,使得構建大型復雜人體血管網絡模型成為可能,同時促進復雜血管模型雙向流固耦合的進程。
根據圖4的血流速度流線分布圖,可以看出在不同速度條件下,血管各位置點血流速度隨著時間的變化趨勢。在類拋物線入口條件下,當入口速度達到最大時,血管的局部位置要承受其近5倍速度的沖擊。同理在定值低速入口條件下,血管局部位置要承受其入口速度3倍多的血流沖擊,這些位置主要分布在血管的分叉處和小血管處。依據這兩種條件的計算結果,發現入口速度的逐漸增加,會加倍血管各分叉處的速度,可見隨著年齡的增長,心臟射血的速度逐漸增大,同樣就會增加血管某處的超倍速度,影響血流和血管的各類性能參數。另外,發現血流是定值時,對血管的影響將會更大,持續時間更長。當然正常人體心臟的供血是瞬態的,但是隨著年齡的增長和某疾病的影響,會導致血流速度出現短暫的定值或者接近定值,對人體的心腦血管系統將會增加一定的影響。
通過對圖5靜態壓力的仿真結果分析,發現在最大入口速度值1.2 m/s是定值0.3 m/s速度4倍的情況下,在入口處計算出的最大靜壓力值300 kPa是定值速度入口條件下靜態壓力值31 kPa的大約10倍。然而最小值之間的差別更加明顯,通過比較最小值發現,隨著入口速度的增大,血流的回流現象較明顯。按照正常的流體力學理論,在定值速度入口條件下,流體不應該出現回流的現象。而仿真結果如圖6所示不同標尺刻度下平均值速度入口條件靜態壓力分布,發現靜態壓力在隨著時間周期的增大,整體壓力段在逐漸減小,入口處靜壓力從31 kPa逐漸減少到0.19 kPa。分析其中原因,定義的流體是血液的密度特征,黏度采用的卡羅流體模型參數。當然本研究結果也許存在著一定的局限性,使得血液流體的計算結果和真實流體情況有所差別,留在今后的研究工作中做進一步研究。
較多的學者研究證實,壁面剪切力以及其梯度被認為在血管再狹窄的過程中扮演著重要的角色,非生理性剪切力會觸發內膜增生和動脈粥樣硬化板塊形成,為血管再狹窄的出現提供病理基礎[25]。發現在血管和支架段內出現壁面剪應力低于0.5 Pa 的區域為內膜增生易發區,應盡量減少這種低壁面剪應力的區域[26]。依據圖7的計算結果,證實剪切力跟速度之間的正比關系,同時發現在血管分叉處和小血管處出現較大的剪切力,在不同速度入口條件下,剪切力的分布位置基本一致。如果依據血管壁面剪切力出現小于0.5 Pa的區域是內膜增生易發區,可以看出入口速度在0.3 m/s的條件,計算出血管模型大面積出現剪切力低于0.5 Pa,引起血管內膜增生可能性較大。
4? ? 結論
本文基于開源SimVascular血管建模軟件和商用ANSYS軟件,對腹主動脈血流動力學進行了仿真研究。采用雙源CT血管造影醫學數字圖像數據,成功構建了復雜人體的多分支腹主動脈以及髂動脈血管模型。假設血管模型血流為層流、不可壓縮牛頓流體,卡羅流體模型參數、入口血液流速隨時間類拋物線變化和平均定值兩種初始條件,應用ANSYS FLUENT軟件進行血流仿真計算和分析,獲取復雜腹主動脈及其分支的血流速度流線、靜態壓力和壁面總剪切力的分布情況。仿真結果發現:血管在分叉和小直徑血管處,都出現較大速度和剪切力,但是在腸系膜上動脈和左右髂動脈的遠端出現明顯的不同;入口速度的逐漸增加,會加倍血管各分叉處的速度;在平均值速度入口條件下,靜態壓力在隨著時間周期增大,整體壓力段在逐漸減小。 當然本研究結果也許存在著一定的局限性,如簡化血管的長度、忽略重力和僅采用層流一種模式,使得血液流體的計算結果和真實流體情況有所差別,留在今后的研究工作中做進一步研究。綜合上述研究成果,成功構建復雜腹主動脈血管網絡拓撲結構并進行仿真計算,將有助于臨床醫生更深入理解各個位置處動脈血流力學特征,并為臨床診療腹主動脈血管疾病提供一定的參考價值。
致? ?謝
仿真實驗在構建模型過程中得到常州市第二人民醫院曹海濤和劉煒醫生的大力支持及多方面的幫助,在此致以誠摯的感謝!
參考文獻:
[1] 張丹,李彩英,高不郎,等.顱內動脈瘤血流動力學發病機制研究進展[J].介入放射學雜志, 2017,26(4):378-382.
[2] ASSEMAT P,ARMITAGE J A,SIU K,et al.Three-dimensional numerical simulation of blood flow in mouse aortic arch around atherosclerotic plaques[J].Science Direct,2014,38:4175-4185.
[3] 陳宇,李睿,趙雪梅,等.基于醫學影像的血流動力學分析[J].力學發展,2016,46:323-342.
[4] 鄭河榮,劉家好,何玲娜.腦血管計算機模型的建立與有限元分析[J].浙江工業大學學報,2014,42(3):253-256.
[5] SAHO T,ONISHI H.Quantitative comparison of hemodynamics in simulated and 3D angiography models of cerebral aneurysms by use of computational fluid dynamics[J].Radiological physics and technology,2015,8(2):258-265.
[6] 陳珍,袁奇,朱光宇,等.頸內動脈狹窄時Willis環的血液動力學數值模擬[J].西安交通大學學報,2009,43(10):119-123.
[7] POTTERS W V,CIBIS M,MARQUERING H A,et al.4D MRI-based wall shear stress quantification in the carotid bifurcation: a validation study in volunteers using computational fluid dynamics[J].Journal of Cardiovascular Magnetic Resonance,2014,16(S1):162-163.
[8] 劉瑩,羅院明,殷艷飛,等.動脈內流-固耦合作用下兩相血流動力學數值模擬[J].介入放射學雜志, 2017,26(3):253-257.
[9] 孫正,劉存.基于血管內超聲的動脈血管壁應變分布的計算流體力學仿真[J].生物醫學工程學雜志,2015,32(6):1244-1248.
[10] NESTOLA M G C,GIZZI A,CHERUBINI C,et al.Three-band decomposition analysis in multiscale FSI models of abdominal aortic aneurysms[J].International Journal of Modern Physics C.2016,27(2):1650017.
[11] AL-RAWI M,AL-JUMAILY A M.Assessing abdominal aorta narrowing using computational fluid dynamics[J]..Medical & biological engineering & computing,2016,54(5):843-853.
[12] CABALLERO A D,LAIN? S. A. Review on Computational Fluid Dynamics Modelling in Human Thoracic Aorta[J].Cardiovascular Engineering and Technology,2013,4(2):103-130.
[13] UPDEGROVE A,WILSON N M,MERKOW J,et al.SimVascular: An Open Source Pipeline for Cardiovascular Simulation[J]. Annals of biomedical engineering,2017,45(3):525-541.
[14] SOUDAH E,ROSSI R,IDELSOHN S,et al. A reduced-order model based on the coupled 1D-3D finite element simulations for an efficient analysis of hemodynamics problems[J].Computational Mechanics,2014,54(4):1013-1022.
[15] SOUSA L C,CASTRO C F,ANTONIO C C,et al. Toward hemodynamic diagnosis of carotid artery stenosis based on ultrasound image data and computational modeling[J]..Medical & biological engineering & computing,2014,52(11):971-983.
[16] 劉波,李志偉.數值模擬描述血管壁厚度對復雜顱內動脈瘤流固耦合分析結果的影響[J].中國組織工程研究,2014,18(11):1765-1773.
[17] 喬愛科,侯映映,陽侯.冠狀動脈狹窄幾何構型對血流儲備分數影響的有限元分析[J].中 國 生物 醫 學工程學報,2015,34(2):199-204.
[18] TAYLOR C A,HUGHES T J R,ZARINS C K.Finite Element Modeling of Three-Dimensional Pulsatile Flow in the Abdominal Aorta: Relevance to Atherosclerosis[J].Annals of biomedical engineering,1998,26:975-987.
[19] WU Q Y,LIU X J,PAN L J,et al.Simulation Analysis of Blood Flow in Arteries of the Human Arm[J]. Biomedical engineering : applications, basis, and communications,2017,29(4): 1750031-1750038.
[20] 呂紹茂,鐘華,陳麗君,等.構建頸內動脈瘤雙向流固耦合模型的血流模擬[J].中國組織工程研究,2014,18(2):218-225.
[21] OLUFSEN M S,NADIM A,SELGRADE J F.On Dedriving Lumped Models For Blood Flow And Pressure In The? Systemic Arteries[J].Mathematical Biosciences? And Engineering,2004,1(1):61-80.
[22] GHARAHI H,ZAMBRANO B A,ZHU D C, et al.Computational fluid dynamic simulation of human carotid artery bifurcation based on anatomy and volumetric blood flow rate measured with magnetic resonance imaging[J].International journal of advances in engineering sciences and applied mathematics,2016,8(1):40-60.
[23] JAHANGIRI M,SAGHAFIAN M,SADEGHI M R.Numerical simulation of non-Newtonian models effect on hemodynamic factors of pulsatile blood flow in elastic stenosed artery[J].Journal of Mechanical Science and Technology,2017,31(2):1003-1013.
[24] 郟科人,吳英成,裘茗煙,等.血管三維結構定量特征指標研究進展[J].中國數字醫學,2017,12(7):1-20.
[25] 魏延賓,程潔.脈動流下血管支架耦合系統血流動力學實驗研究 [J].生命科學儀器,2017,15(4):28-32.
[26] 張業鵬,周敏,湯文浩.生物可降解血管支架的血流動力學數值模擬[J].中國組織工研究,2017,21(34):5532-5537.
Abstract: This paper studies the simulation calculation for the variation of hemodynamics parameters in human abdominal aorta and iliac artery under different blood flow velocities at the entries. And it adopts open source software SimVascular to construct the vessel models of abdominal aorta and some major arteries nearby including celiac axis, celiac artery, splenic artery and its hepatic artery branches, superior and inferior mesenteric arteries, left and right renal arteries and iliac arteries according to the CT vessel data. Besides, this paper mainly analyzes the blood velocity vector, static pressure, and wall shear stress by using the Fluent simulation calculation. Finally, the quasi-parabolic-like function velocity and the average constant velocity were assigned at the entry respectively, and it was found that in both conditions, the arterial models appeared larger velocities and wall shear stresses at the bifurcation and small-diameter vessels. However, there were significant differences between the superior mesenteric artery and the distal end of the left and right iliac arteries. At the same time, it was also found that the gradual increase in the entry speed would double the speed of the bifurcation artery. In conclusion, the successful construction of complex arterial networks and the results of simulation will help doctors better understand the characteristics of arterial blood flow.
Key? words: major celiac arteries; velocity vector; static pressure; wall shear stress; hemodynamics
責任編輯? ? 張志釗

