蛻膜巨噬細胞通過外泌體調控滋養細胞生物學行為參與不明原因復發性流產*
應 翔, 金筱筱, 張紫娟, 王 凱, 丁陳靜, 鄭靈芝
(溫州醫科大學附屬臺州醫院產科, 浙江 臺州 317000)
復發性流產(recurrent spontaneous abortion,RSA)的發病率在全部妊娠中占1%~5%,嚴重危害女性生育健康,其中,將近50%的患者病因不明,稱為不明原因復發性流產(unexplained recurrent spontaneous abortion,URSA)。妊娠的成功有賴于滋養細胞功能正常和母胎免疫耐受平衡。目前研究表明,破壞滋養細胞生物學行為參與復發性流產的發生[1]。巨噬細胞構成母胎免疫耐受微環境[2],而其參與URSA的機制尚未闡明。新近研究表明,外泌體內富含蛋白、核酸和脂質等生物活性分子,參與母胎間交流[3]。本研究擬探討蛻膜巨噬細胞外泌體對滋養細胞的生長和遷移功能的調節作用,為URSA發病機制研究提供新思路。
材 料 和 方 法
1 材料
1.1材料來源 收集2017年2月~2019年1月在浙江省臺州醫院就診的URSA患者(URSA組)及正常早孕人工流產婦女[正常對照,(normal control, NC)組]的蛻膜組織。URSA組選擇自然流產2次及以上的患者,年齡在25~35歲之間,B超提示胚胎停止發育,且排除絨毛染色體異常和夫妻雙方外周血染色體核型異常、甲狀腺功能異常、糖尿病、性激素異常、生殖道畸形、凝血功能異常、生殖道感染、免疫紊亂、子宮動脈血流異常和男方精液異常等因素所致的流產。正常組選擇年齡25~35歲,既往無不良孕產史,B超提示胚胎發育正常的早孕人工流產婦女。
1.2實驗試劑 外泌體分離試劑盒購自 Invitrogen; 抗CD63抗體購自Abcam;PKH67染色劑購自Sigma;MTS染色劑購自Promega;鈣黃綠素 AM 染料購自Invitrogen;CD14 細胞磁珠分離試劑盒購自Miltenyi Biotec。
1.3細胞系 滋養細胞系HTR8/Snveo由上海第一婦嬰保健院中心實驗室饋贈。
2 方法
2.1蛻膜巨噬細胞的分離和原代培養 收集正常早孕婦女及URSA患者流產后的蛻膜組織,置于DMEM/F12培養液中,30 min內帶回實驗室,予PBS漂洗干凈后剪碎、研磨、過濾,制成細胞懸液。Ficoll密度梯度離心法獲得單個核細胞,免疫磁珠法分選CD14+細胞即為蛻膜巨噬細胞,洗滌后加入含10% 胎牛血清的RPMI-1640培養液(含 100 mg/L青霉素和100 mg/L鏈霉素),置于37.5 ℃、含5% CO2的細胞培養箱培養,2組均取5×105個巨噬細胞。本研究經過倫理委員會批準,且取得患者的知情同意。
2.2蛻膜巨噬細胞外泌體的制備 收集正常早孕婦女及URSA患者蛻膜CD14+巨噬細胞培養1 d后的上清,2 000 r/min離心30 min去除細胞及細胞碎片,轉移離心后細胞上清至新的離心管,加入細胞上清的外泌體提取試劑,按照試劑說明書要求分離獲得蛻膜巨噬細胞的外泌體,BCA蛋白定量法檢測外泌體濃度。
2.3蛻膜巨噬細胞外泌體的鑒定 分離蛻膜CD14+巨噬細胞的外泌體,透射電鏡觀察巨噬細胞外泌體的大小和形態學特點。Western blot法檢測巨噬細胞外泌體的外泌體標志蛋白CD63的表達水平。
2.4蛻膜巨噬細胞與HTR8/Snveo滋養細胞共培養 取對數生長期的HTR8/Snveo細胞,按每孔 5×105鋪于含5% 胎牛血清的DMEM/F12的6 孔板中。正常早孕人工流產和URSA蛻膜巨噬細胞外泌體以100 mg/L的濃度與HTR8/Snveo細胞共培養。
2.5HTR8/Snveo細胞攝取外泌體的示蹤實驗 將HTR8/Snveo細胞按每孔5 × 105個接種于6孔板。將染色劑 PKH67 加入巨噬細胞外泌體中,室溫孵育 5 min,加入1 mL 含 1% 牛血清白蛋白的無血清培養基終止標記反應。在混合物中加入20 mL PBS,4 ℃、100 000×g離心2 h,重復2次。用2 mL培養基重懸,加入HTR8/Snveo細胞培養皿中, 37 ℃ 培養24 h,熒光顯微鏡觀察樣本。
2.6MTS法檢測共培養后HTR8/Snveo滋養細胞的活力 建立蛻膜巨噬細胞外泌體和滋養細胞的共培養體系,將共培養后的HTR8/Snveo細胞按每孔2×103個接種于96孔板,每組設3個復孔。共培養1 d、2 d和3 d后,每孔加入20 μL的MTS染色劑,繼續培養1 h,在酶標儀上檢測490 nm處各孔的吸光度(A)值。實驗重復3次。
2.7Transwell法檢測共培養后HTR8/Snveo滋養細胞的遷移能力 選用8 μm孔徑的Transwell板檢測細胞的遷移能力。將HTR8/Snveo細胞按每孔5×104個接種于 Transwell的專用孔板中,上室加200 μL含1%胎牛血清的DMEM/F12培養基,下室加正常早孕人工流產或URSA蛻膜巨噬細胞外泌體。24 h后對下室細胞使用鈣黃綠素 AM 染料染色,熒光顯微鏡觀察并對細胞進行計數,每孔取6個視野計數。
3 統計學處理
采用 SPSS 20.0軟件進行統計學處理,計量資料以均數±標準差(mean±SD)表示,采用獨立樣本t檢驗和單因素方差分析。以P<0.05 為差異有統計學意義。
結 果
1 蛻膜巨噬細胞外泌體的鑒定
透射電子顯微鏡下顯示,外泌體近似圓形,直徑40~80 nm,見圖1A;Western blot法結果表明,蛻膜巨噬細胞外泌體高表達CD63,見圖1B。
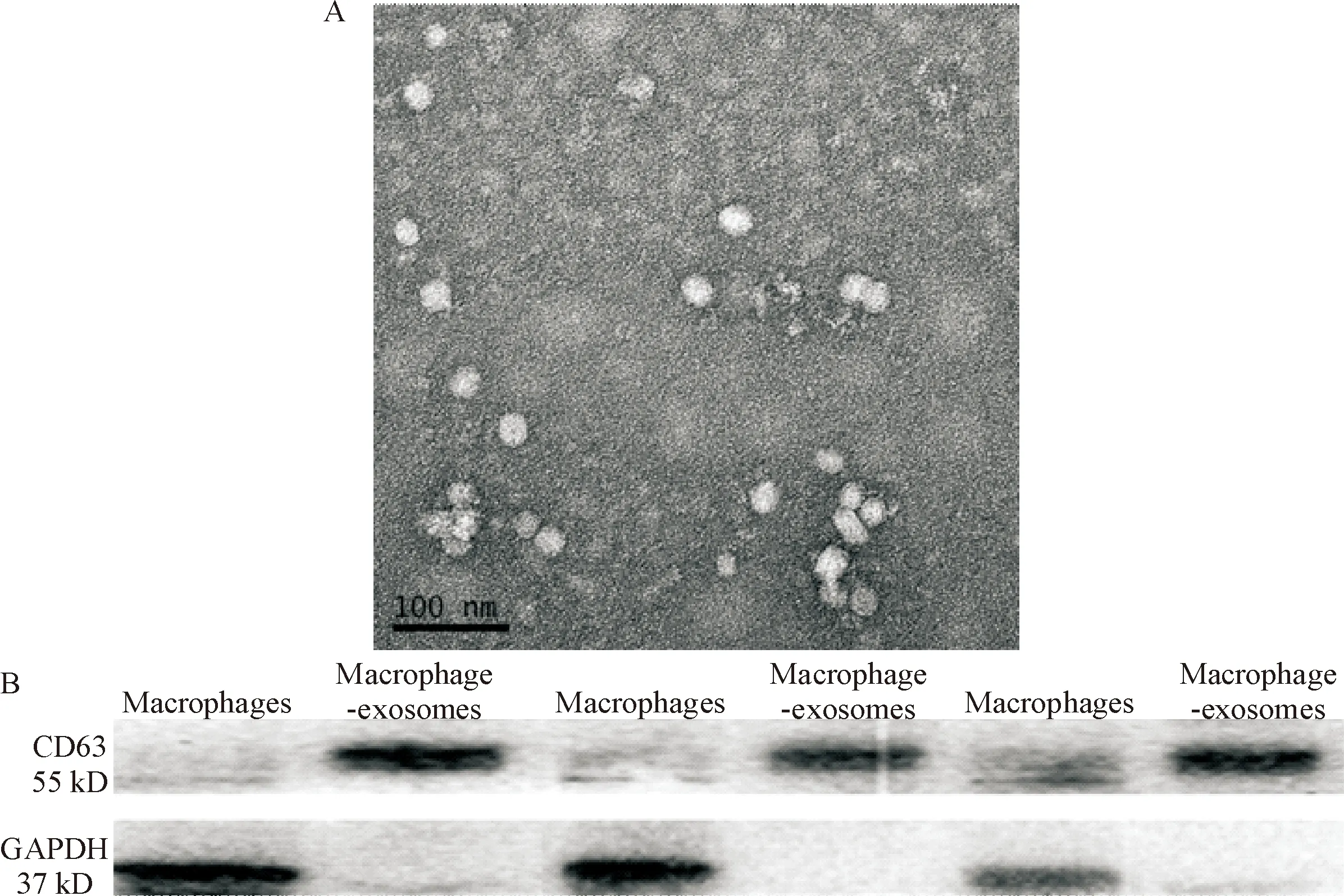
Figure 1. Representative transmission electron microscopy micrograph of exosomes derived from decidual macrophages (A) and immunoblot of CD63 in exosomes derived from decidual macrophages (B).
圖1 蛻膜巨噬細胞電鏡圖及外泌體標志蛋白CD63在蛻膜巨噬細胞及蛻膜巨噬細胞來源外泌體中的表達水平
2 巨噬細胞外泌體可被滋養細胞HTR8/Snveo攝取
PKH67染色巨噬細胞外泌體,將其與滋養細胞HTR8/Snveo共培養,熒光顯微鏡顯示HTR8/Snveo胞質內出現熒光,見圖2,表明外泌體可被滋養細胞攝取。
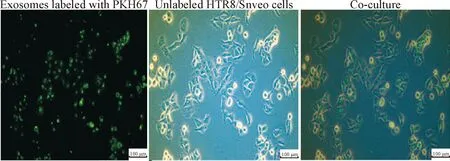
Figure 2. Unlabeled HTR8/Snveo cells were incubated with decidual macrophage-derived exosomes that were labeled with PKH67. Data exhibits typical image of 3 independent experiments.
圖2 外泌體被滋養細胞攝取
3 URSA蛻膜巨噬細胞外泌體抑制滋養細胞HTR8/Snveo的活力
將蛻膜巨噬細胞外泌體和HTR8/Snveo 共培養,MTS法檢測結果顯示,同正常早孕人工流產蛻膜巨噬細胞外泌體組比較,共培養2 d和3 d后URSA蛻膜巨噬細胞外泌體組HTR8/Snveo細胞的活力明顯下降(P<0.05),見圖3。這表明URSA蛻膜巨噬細胞外泌體能夠抑制滋養細胞的活力。
4 URSA蛻膜巨噬細胞外泌體抑制滋養細胞的遷移能力
Transwell實驗表明,URSA蛻膜巨噬細胞外泌體組的HTR8/Snveo細胞遷移數較正常早孕人工流產蛻膜巨噬細胞組下降(P<0.01), 見圖4。這提示URSA蛻膜巨噬細胞外泌體抑制滋養細胞的遷移能力。
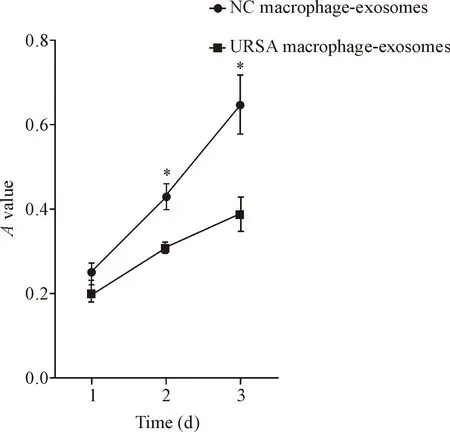
Figure 3.Cell viabitility of HTR8/Snveo cells which incubated with the supernatants of decidual macrophage-derived exosomes from normal pregnant induced abortion women or URSA women was detected by MTS assay. Mean±SD.n=3.*P<0.05vsURSA macrophage-exosomes group.
圖3 蛻膜巨噬細胞外泌體對滋養細胞 HTR8/Snveo的細胞活力的影響
討 論
目前,URSA病因及發病機制尚不清楚。正常妊娠的建立維持需要母胎免疫耐受微環境的建立和滋養層細胞生物學功能有序可控地進行。母胎界面的細胞大致由胎兒來源的滋養細胞和母體來源的蛻膜免疫活性細胞、蛻膜基質細胞及腺上皮細胞構成。研究表明,滋養細胞生物學行為的破壞可引起流產等病理性妊娠的發生[1, 4]。本研究選用的滋養細胞系HTR8/Snveo的生物學行為接近原代滋養細胞,被廣泛應用于復發性流產滋養細胞功能的研究。
母胎免疫耐受失衡可引起母體對胎兒的免疫排斥,臨床上表現為復發性流產、胎兒發育受限等病理性妊娠[5],其中,蛻膜的免疫活性細胞群由NK細胞、T 細胞和巨噬細胞組成,是母胎免疫耐受形成的基礎。子宮內的巨噬細胞具有吞噬、抗原遞呈、分泌細胞因子等作用,占妊娠期間免疫職能細胞的20%~30%,在母胎界面穩態的建立及維持中扮演重要角色[2, 6]。然而,蛻膜巨噬細胞和胚胎滋養細胞之間的相互作用參與妊娠的具體機制尚未明了。
外泌體可存在于母胎界面,作為母胎間信息交流的載體[7],在妊娠維持、子癇前期、妊娠期糖尿病等正常及病理妊娠中發揮相應作用。有研究報道,巨噬細胞通過外泌體影響胎盤細胞因子的產生[8]。此外,外泌體可存在于母體的外周血中,有望成為病理性妊娠診斷的生物新標記[9-10]。近年來,很多研究表明,外泌體被靶細胞內吞后,可將其內容物傳遞給靶細胞并發揮相應的生物學活性[11]。本研究結果證實,蛻膜巨噬細胞的外泌體可被滋養細胞內吞。分離正常早孕人工流產和URSA的蛻膜巨噬細胞的外泌體,分別同滋養細胞HTR8/Snveo細胞共培養,結果發現URSA蛻膜巨噬細胞的外泌體抑制滋養細胞的活力和遷移能力。由此提示蛻膜巨噬細胞可通過外泌體調控滋養細胞生物學行為,造成胚胎停止發育,參與URSA的發生。
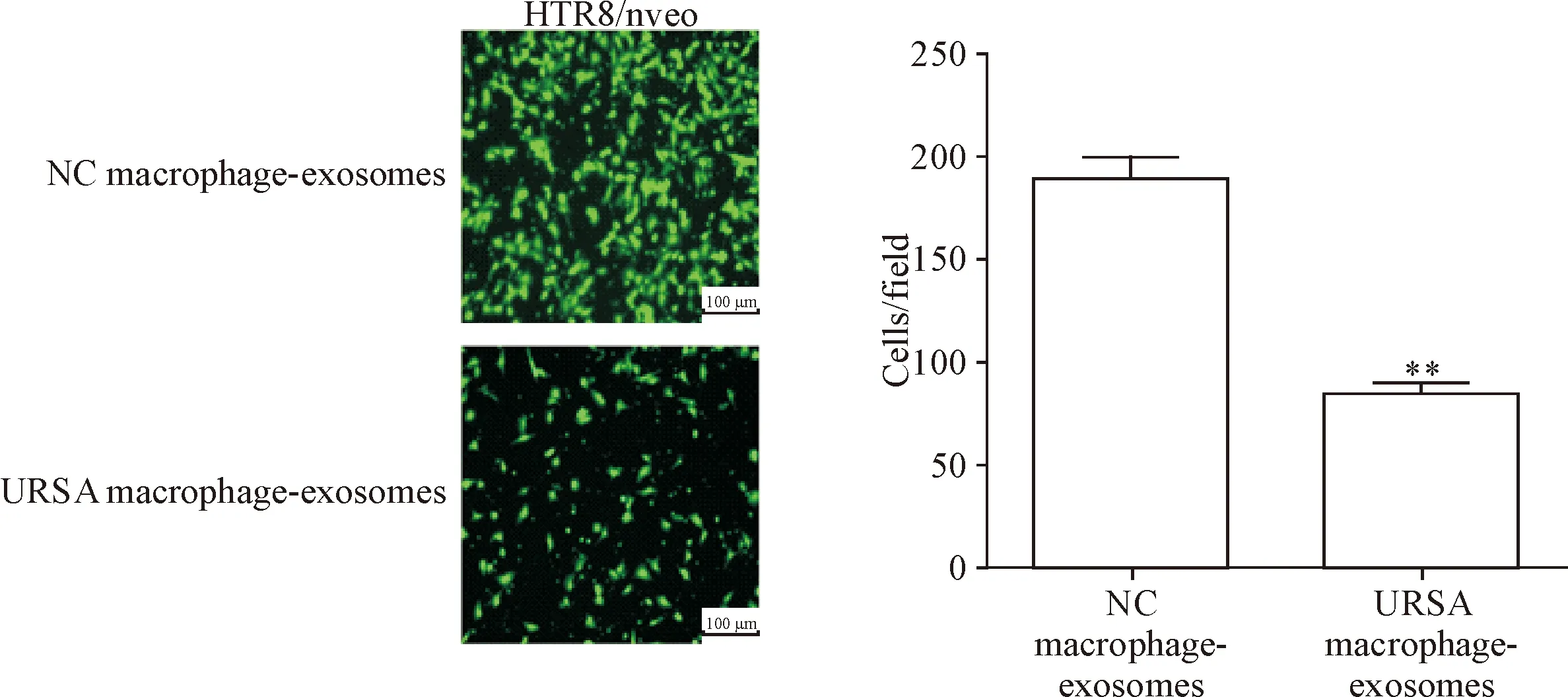
Figure 4.Migration capacity of HTR8/Snveo cells which incubated with the decidual macrophage-derived exosomes from normal pregnant induced abortion women or URSA women was detected by Transwell assay. Mean±SD.n=3.*P<0.05vsNC macrophage-exosomes group.
圖4 蛻膜巨噬細胞外泌體對滋養細胞 HTR8/Snveo遷移能力的影響
本研究為針對URSA的巨噬細胞靶向治療提供了實驗依據,今后的研究重點是進一步探討外泌體調節滋養細胞的分子機制并探索URSA血清分離的外泌體情況及內容物,為URSA早期診治開辟新思路。

