敲減HMGA2基因抑制TGF-β1誘導的人胚肺成纖維細胞生長及膠原合成*
李 鵬, 劉詠梅, 劉振華
(承德市中心醫院兒科, 河北 承德 067000)
肺纖維化(pulmonary fibrosis,PF)屬于間質性肺炎的嚴重階段,發病機制復雜,近些年的發病率及死亡率均呈現上升趨勢[1]。有研究發現,成纖維細胞在PF發生及發展過程中有重要作用,抑制肺成纖維細胞增殖及向肌纖維細胞轉化,促進其凋亡是影響PF發生發展的關鍵[2-3]。高遷移率族蛋白A2(high mobility group A2,HMGA2)是一種非組蛋白染色體蛋白,其表達與多種人類腫瘤發生發展密切相關[4-5]。也有研究顯示,在PF過程中HMGA2可隨PF程度增加表達量增加,可能是通過調節與上皮-間充質細胞轉化相關基因而在其中發揮作用[6];沉默HMGA2表達可抑制人胚肺成纖維細胞膠原合成[7]。以上研究提示PF過程中HMGA2可能發揮了重要的調節作用。轉化生長因子 β1(transforming growth factor-β1,TGF-β1)是TGF-β家族中最重要的亞型,在PF等疾病狀態下表達增加,是致纖維化關鍵性的細胞因子[8]。因此,本研究通過RNA干擾技術敲減HMGA2的表達,旨在探討抑制HMGA2表達對TGF-β1誘導的人胚肺成纖維細胞活力、凋亡、膠原(collagen,COL)合成及氧化應激的影響,以期為PF的治療提供理論依據。
材 料 和 方 法
1 試劑和儀器
胎牛血清(fetal bovine serum,FBS)購自杭州四季青;DMEM培養基購自HyClone;MTT和DCFH-DA均購自Sigma;TGF-β1購自Peprotech INC;細胞凋亡試劑盒購自江蘇凱基;RNA提取試劑盒及逆轉錄試劑盒均購自TaKaRa;抗HMGA2、AKT和p-AKT抗體均購自Abcam。流式細胞儀購自Becton Dikinson;酶標儀購自BIO-RAD。
2 細胞及培養
人胚肺成纖維細胞(human embryonic lung fibroblast,HELF)購自中科院上海細胞庫。細胞用含10% FBS的DMEM培養基在5%體積分數CO2、37 ℃恒溫、飽和濕度條件下培養。細胞達80%左右生長融合時,胰酶消化后傳代。實驗為3~4代的細胞。
3 方法
3.1分組及轉染 實驗分為空白(blank)組、TGF-β1組、陰性對照(negative control,NC)組和HMGA2 siRNA(si-HMGA2)組。空白組細胞不經特殊處理。TGF-β1組用含5 μg/L TGF-β1的DMEM培養基刺激細胞24 h;NC組和si-HMGA2組分別轉染陰性對照siRNA及HMGA2的特異性siRNA 48 h后使用含5 μg/L TGF-β1的DMEM培養基刺激細胞24 h。siRNA轉染步驟參照LipofectamineTM2000說明書進行。
3.2轉染效率的檢測 預冷RIPA裂解液(加蛋白酶抑制劑PMSF)提取按照3.1分組處理后的細胞,BCA法測定蛋白濃度,每孔上樣40 μg總蛋白,經10~12%的SDS-PAGE分離后電轉移至PVDF膜,膜用5%脫脂奶粉封閉2 h,TBST緩沖液洗膜,將膜完全浸入稀釋好的 I 抗溶液中(1 ∶500稀釋的HMGA2及1 ∶1 000稀釋的β-actin),4 ℃搖床中孵育過夜,TBST緩沖液洗膜,加稀釋好的 II 抗(HRP標記的抗體,稀釋比例1 ∶2 000),37 ℃孵育30 min,洗膜,加ECL發光液覆蓋膜,待熒光較為穩定后掃描,掃描后使用Image J分析軟件對圖像進行灰度值分析。得出目的蛋白與內參照蛋白吸光度值比值,即為蛋白的相對表達量。實驗重復3次。
3.3細胞活力的檢測 收集生長至對數期的HELF,以每孔5×103個接種于96孔板,5%體積分數CO2、37 ℃孵育,使細胞單層覆蓋孔底部,棄去舊培養液,按照3.1分組處理細胞,每組設置5個復孔,處理至規定時間后,每孔加10 μL的MTT溶液(5 g/L),繼續孵育4 h,吸去孔內培養液,每孔中加入150 μL的DMSO,37 ℃孵育10 min,振蕩10 min以使結晶能夠充分溶解,酶標儀測定490 nm波長處各孔的吸光度(A)值。實驗重復3次。
3.4細胞凋亡率檢測 收集按照3.1分組處理至規定時間的細胞,預冷PBS洗滌后用適量胰酶-EDTA消化液消化,收集消化的細胞至EP管,4 ℃離心,PBS洗滌,500 μL的1×binding buffer重懸細胞,分別加入Annexin V-FITC及PI各5 μL和10 μL,室溫避光孵育15 min,上機前再加入1×binding buffer 300 μL,1 h內通過流式細胞儀檢測。實驗重復3次。
3.5活性氧簇(reactive oxygen species,ROS)含量測定 采用熒光分子探針DCFH-DA法測定細胞內ROS水平。收集按照3.1分組處理至規定時間的細胞,PBS漂洗后,離心,棄上清,加入終濃度為5 μmol/L的DCFH-DA,37 ℃孵育40 min,將加DCFH-DA的細胞渾濁液涂在蓋玻片上,PBS洗滌多余染料,蓋玻片倒扣在載玻片上,熒光倒置顯微鏡及Image Lab軟件測定熒光強度。實驗重復3次。
3.6RT-qPCR檢測COL-I和COL-III的mRNA表達 TRIzol法提取按照3.1分組處理至規定時間的細胞總RNA,逆轉錄試劑盒將總RNA反轉錄為cDNA,使用Primer 5.0軟件設計PCR引物,按照PCR試劑盒說明設置反應體系及反應條件。使用Alpha凝膠成像系統分析圖像,β-actin作為內參照,根據2-△△Ct公式計算目的基因相對于β-actin的mRNA表達量。COL-Ⅰ(449 bp)的上游引物序列為5’- GCTCGTGGAAATGATGGTGC-3’,下游引物序列為 5’-CCTCGCTTTCCTTCCTCTCC-3’;COL-Ⅲ(386 bp)的上游引物序列為 5’-ACGGAAACACTGGTGGACAG-3’,下游引物序列為5’-GTAGTCTCACAGCCTTGCGT-3’;β-actin(500 bp)的上游引物序列為5’- GTGGGGCGCCCCAGGCACC-3’,下游引物序列為5’-CTCCTTAATGTCACGCACGATTT-3’。每孔設置5個重復孔,實驗重復3次。
3.7AKT和p-AKT蛋白表達的檢測 分組同3.1。AKT和p-AKT蛋白表達的Western blot檢測方法同3.2。
4 統計學方法
所有實驗數據采用SPSS 21.0軟件進行分析。計量資料用均數±標準差(mean±SD)表示,多組差異比較采用單因素方差分析,兩兩比較采用SNK-q檢驗,以P<0.05為差異有統計學意義。
結 果
1 轉染si-HMGA2的HELF中HMGA2蛋白的表達
Western blot法檢測轉染si-HMGA2的HELF中HMGA2蛋白的表達,結果顯示,TGF-β1組的HMGA2蛋白表達明顯高于空白組和si-HMGA2組(P<0.05),TGF-β1組和NC組間HMGA2蛋白表達的差異無統計學顯著性(P>0.05),提示TGF-β1能夠誘導HELF中HMGA2的表達,且轉染si-HMGA2能夠有效敲減TGF-β1誘導的HELF中HMGA2的表達,見圖1。
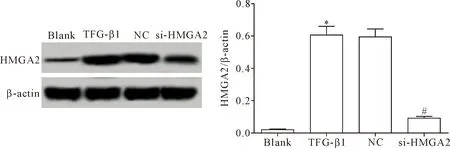
Figure 1.Western blot was used to detect the protein expression of HMGA2 in the HELF transfected with si-HMGA2.Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF- β1 group.
圖1 Western blot檢測轉染si-HMGA2的HELF中HMGA2蛋白的表達
2 敲減HMGA2基因的表達可減弱HELF活力
MTT結果顯示,TGF-β1組的細胞活力明顯高于空白組和si-HMGA2組(P<0.05),TGF-β1組和NC組間比較細胞活力的差異無統計學意義(P>0.05),見圖2。表明敲減HMGA2基因的表達能夠明顯減弱TGF-β1誘導的HELF的活力。
3 敲減HMGA2基因的表達促進HELF凋亡
流式細胞術結果顯示,空白組、TGF-β1組、NC組和si-HMGA2組的細胞凋亡率分別為(13.5±1.35)%、(2.7±0.26)%、(3.0±0.29)%和(10.9±1.07)%。TGF-β1組的細胞凋亡率明顯低于空白組和si-HMGA2組(P<0.05),TGF-β1組和NC組間比較細胞凋亡率的差異無統計學顯著性(P>0.05),見圖3。提示敲減HMGA2基因的表達能夠顯著促進TGF-β1誘導的HELF凋亡。
4 敲減HMGA2基因的表達可降低HELF中膠原的mRNA表達
RT-qPCR結果顯示,TGF-β1組COL-Ⅰ和COL-Ⅲ的mRNA表達均明顯高于空白組和si-HMGA2組(P<0.05),TGF-β1組和NC組間比較COL-Ⅰ和COL-Ⅲ mRNA表達的差異均無統計學顯著性(P>0.05),見圖4。提示敲減HMGA2基因的表達能夠有效降低TGF-β1誘導的HELF中膠原的合成。
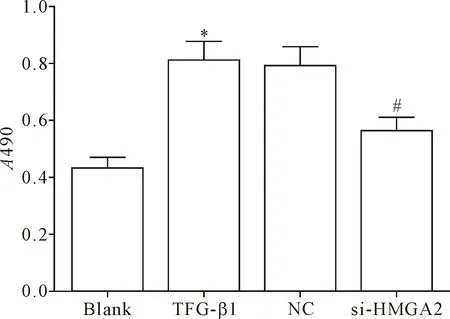
Figure 2.The effect ofHMGA2gene knockdown on the viability of HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF- β1 group.
圖2 敲減HMGA2基因的表達對HELF活力的影響
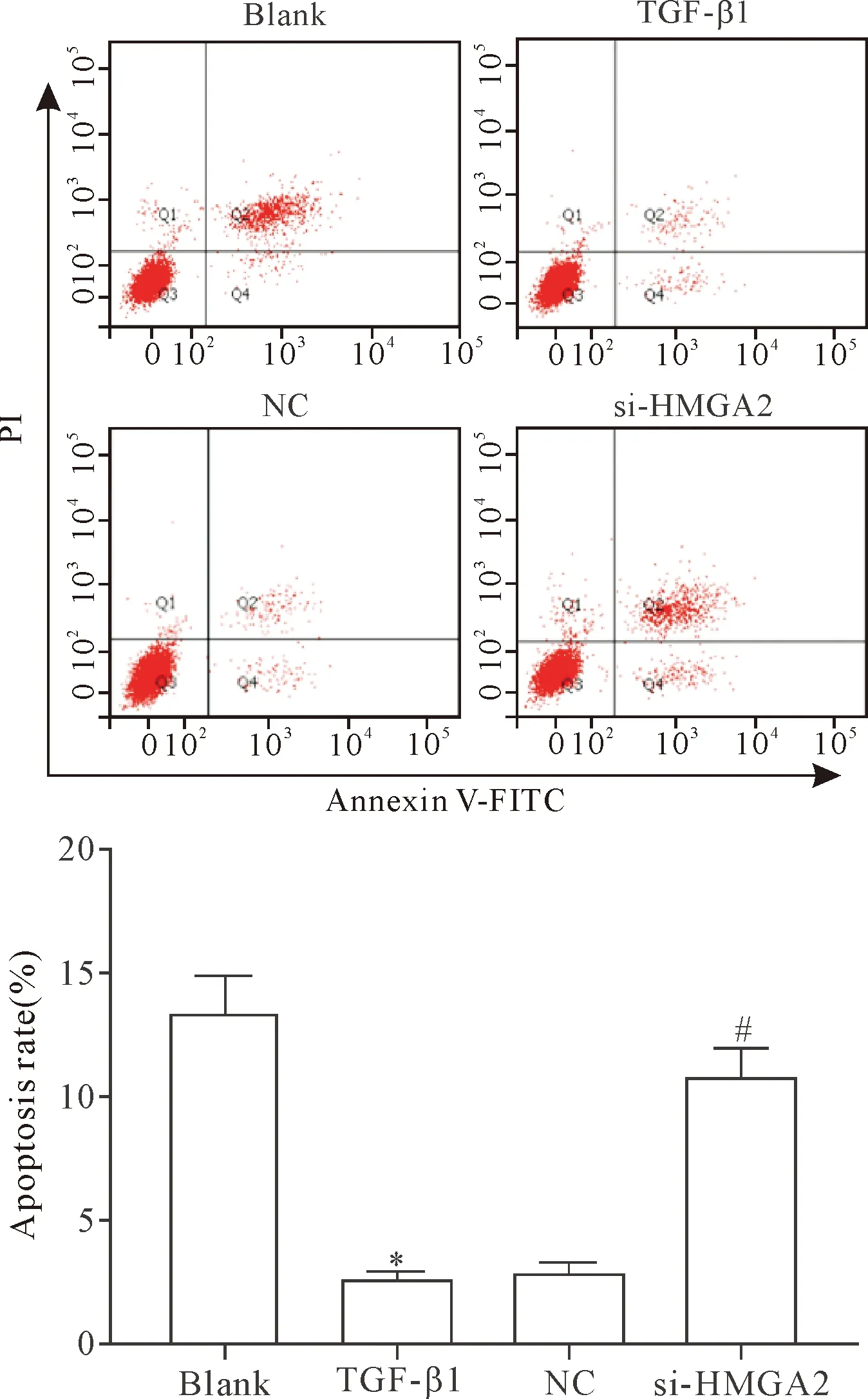
Figure 3.The effect ofHMGA2gene knockdown on the apoptosis of HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF- β1 group.
圖3 敲減HMGA2基因表達對HELF凋亡的影響
5 敲減HMGA2基因表達可降低HELF中ROS的含量
熒光分子探針DCFH-DA法結果顯示,TGF-β1組細胞的ROS含量明顯低于空白組和si-HMGA2組(P<0.05),TGF-β1組和NC組間比較細胞ROS含量的差異無統計學顯著性(P>0.05),見圖5。提示敲減HMGA2基因的表達能夠明顯提高TGF-β1誘導的HELF中ROS的含量。
6 敲減HMGA2基因的表達下調HELF中p-AkT的蛋白水平
Western blot檢測各組細胞AKT和p-AKT的蛋白水平,結果顯示,TGF-β1組細胞p-AKT的蛋白水平明顯高于空白組和si-HMGA2組(P<0.05),TGF-β1組和NC組間比較p-AKT蛋白水平的差異無統計學顯著性(P>0.05),見圖6。提示敲減HMGA2基因的表達能夠抑制TGF-β1誘導的PI3K/AKT信號通路的激活。
討 論
TGF-β有TGF-β1、TGF-β2和TGF-β3 3種形式,其中以TGF-β1最為重要,是關鍵的致纖維化因子之一,在纖維化病變中表達高于正常組織,能促進細胞外基質(extracellular matrix,ECM)的積聚,并可促進成纖維細胞COL-I和COL-III表達,TGF-β1濃度越高對COL-I和COL-III表達促進作用越明顯,從而影響PF進展[9-10]。此外,也有研究顯示,TGF-β1可抑制肺成纖維細胞凋亡[11],以上研究提示抑制TGF-β1誘導的肺成纖維細胞增殖、膠原合成及促進細胞凋亡對PF治療具有重要意義。
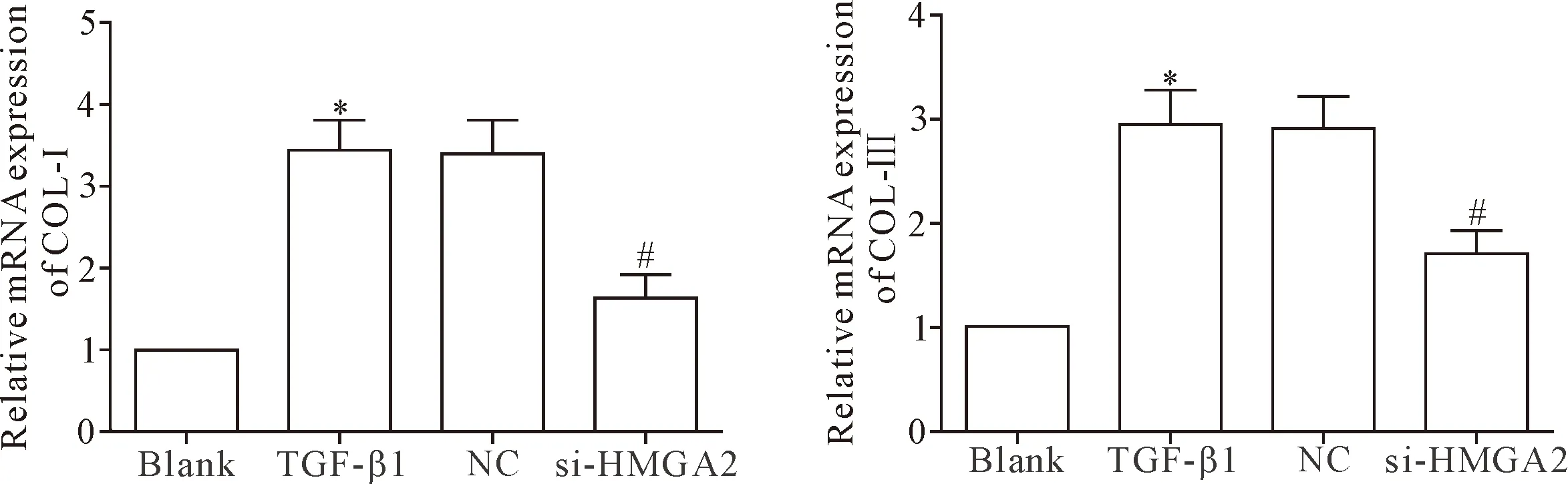
Figure 4.The effect ofHMGA2gene knockdown on the mRNA expression of COL-Ⅰ and COL-Ⅲ in the HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF-β1 group.
圖4 敲減HMGA2基因的表達對HELF中COL-Ⅰ和COL-Ⅲ mRNA表達的影響
HMGA2編碼基因位于12q15染色體,是高遷移率蛋白家族成員之一,可通過蛋白-蛋白或蛋白-DNA作用方式改變染色體結構,使DNA發生劇烈變性,進而直接發揮抑制或促進下游基因表達的作用,也可通過結合于其它的轉錄因子而間接調節下游基因表達[12-13]。現有研究發現,HMGA2異常表達與多種人類腫瘤密切相關[14-15]。HMGA2在PF中的研究較少。有研究顯示,miR-221可靶向HMGA2調控TGF-β1/Smad3誘導的上皮-間充質轉化而抑制博來霉素誘導的PF[16]。RNA干擾是一種可特異性敲減靶基因表達的新技術,目前已成為常用的生物學研究手段,在基因功能研究、疾病治療等方面有廣泛的應用[17-18]。有研究顯示,使用RNAi技術沉默HMGA2表達可抑制人胚肺成纖維細胞膠原合成[7]。本研究結果顯示,用RNAi技術敲減HMGA2的表達可減弱TGF-β1誘導的人胚肺成纖維細胞活力和COL-I和COL-III的mRNA表達,并可促進細胞凋亡,其部分研究結果與前人研究一致。
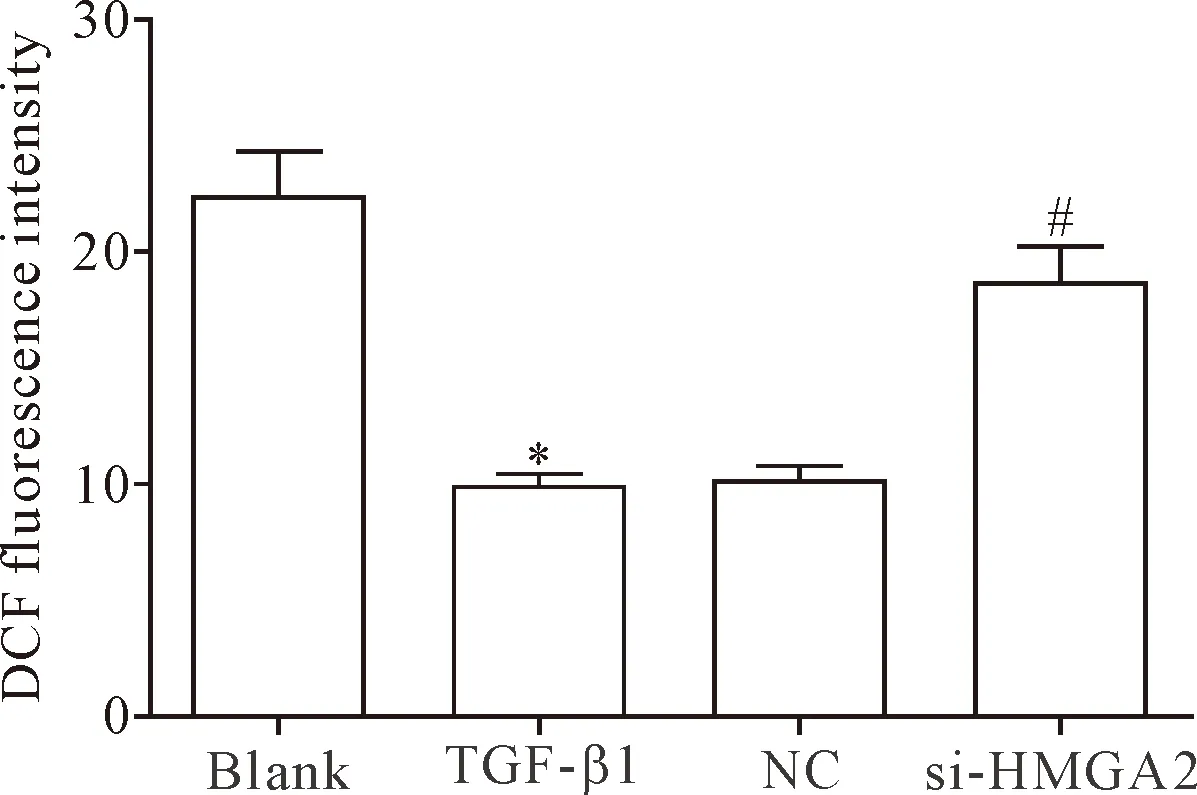
Figure 5.The effect ofHMGA2gene knockdown on ROS content in the HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF-β1 group.
圖5 抑制HMGA2基因表達對HELF中ROS含量的影響
ROS是機體有氧代謝過程中的副產品之一,其過量產生可導致氧化應激,是引起腫瘤、PF和糖尿病等多種疾病的根源[19-20]。有研究顯示,EW-7197可通過阻斷TGF-β/SMAD和ROS信號轉導抑制肝、腎和肺纖維化[21];抑制PDE5A可通過降低ROS產生及RhoA/Rho激酶激活減弱博萊霉素誘導的肺纖維化和肺動脈高壓[22];低劑量鎘可通過ROS上調HMGA2 mRNA和蛋白表達,進而上調周期相關蛋白 cyclin D1 表達,引起細胞周期改變而誘導人胚肺成纖維細胞MRC-5 增殖[23]。本研究結果顯示,敲減HMGA2的表達可增加TGF-β1誘導的人胚肺成纖維細胞的ROS水平。這提示提高ROS水平可能是HMGA2誘導人胚肺成纖維細胞凋亡的一種途徑。
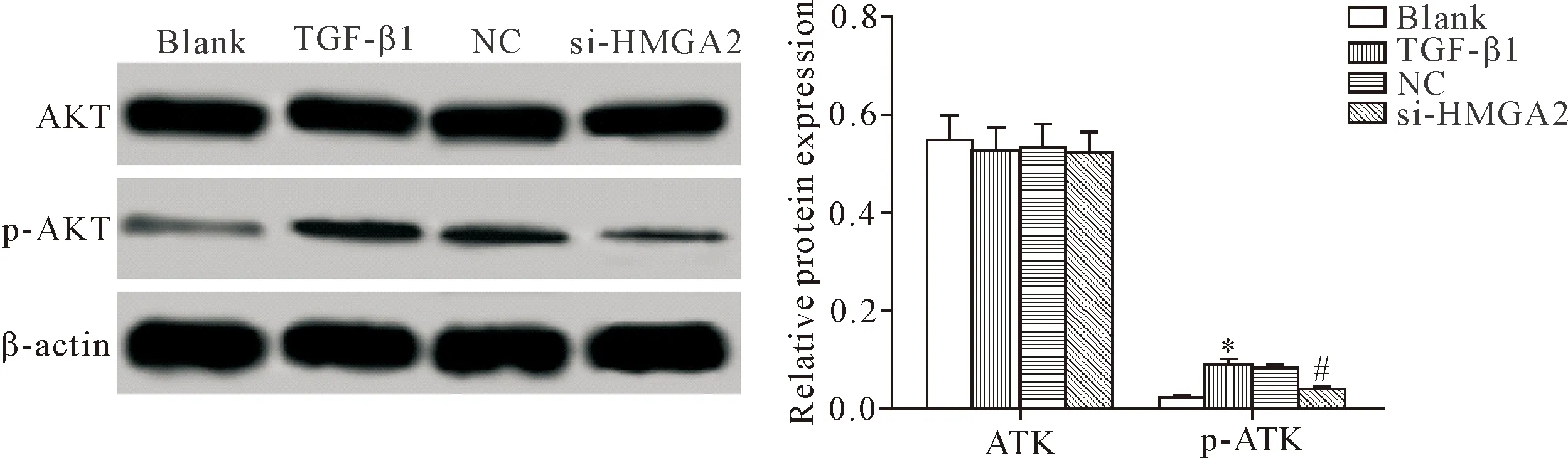
Figure 6.The effect ofHMGA2gene knockdown on the protein levels of p-AKT in the HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF β1 group.
圖6 敲減HMGA2基因的表達對HELF中p-AKT蛋白水平的影響
PI3K/AKT信號是細胞內一條重要的信號途徑,主要由PI3K和AKT分子及下游分子組成,AKT是PI3K信號下游的信號分子,AKT參與促細胞增殖、抑細胞凋亡的調控[24]。有研究表明,TGF-β1可激活PI3K/AKT信號,激活的PI3K/AKT信號可參與細胞增殖、生長等生理過程[25]。抑制PI3K/AKT信號可明顯阻斷TGF-β1誘導的人胚肺成纖維細胞增殖[26]。本研究結果顯示,敲減HMGA2的表達可降低TGF-β1誘導的人胚肺成纖維細胞p-AKT的蛋白水平,提示敲減HMGA2的表達可通過抑制PI3K/AKT信號抑制人胚肺成纖維細胞生長。
綜上所述,通過RNAi沉默HMGA2表達可抑制人胚肺成纖維細胞活力和膠原合成,誘導細胞凋亡及ROS產生,從而對PF起抑制作用,機制可能與抑制PI3K/AKT信號有關。提示在PF過程中HMGA2可能是一個有效的治療靶點。

