腸易激綜合征患者腸道黏膜菌群和催產素受體表達變化分析*
陳俊杰 楊長青 張曉俊 柯少雄 盛淑婷 魏子白#
長治醫學院附屬和平醫院消化內科1(046000) 長治衛生學校附屬醫院病理科2
背景:研究表明腸道菌群、催產素受體(OTR)變化在腸易激綜合征(IBS)的發病中起有重要作用,但其潛在機制尚未完全闡明。目的:探討IBS患者腸道黏膜菌群特征和結腸黏膜OTR表達,以及兩者之間的相關性。方法:收集2017年7月—2017年12月長治醫學院附屬和平醫院收治的符合羅馬Ⅳ標準的IBS-D、IBS-U患者結腸黏膜標本,以13名健康體檢者作為對照。利用高通量測序平臺對腸道黏膜菌群組成、物種多樣性和豐度進行評估。免疫組化法測定結腸黏膜OTR表達。結果:IBS-D組、IBS-U組和對照組腸道黏膜菌群以變形菌門、厚壁菌門、擬桿菌門為主。三組chao1指數、shannon指數相比差異無統計學意義(P>0.05)。與對照組相比,IBS組Granulicatella豐度顯著減少(H=6.212,P<0.05),Tissierella豐度顯著增加(H=6.688,P<0.05)。IBS-D組Syntrophaceae、Porphyromonas、Marmoricola、Cardiobacteriales、Cardiobacterium、Cardiobacteriaceae豐度均顯著高于IBS-U組和對照組(P均<0.05)。IBS-D組、IBS-U組OTR表達均顯著高于對照組(P<0.01)。Tissierella豐度與結腸黏膜OTR表達呈正相關(r=0.542,P<0.01)。Tissierella、Granulicatella豐度、結腸黏膜OTR表達與IBS嚴重程度無明顯相關性(P>0.05)。結論:IBS患者腸道黏膜菌群多樣性無明顯變化,部分菌群豐度發生改變,且不同亞型腸道黏膜菌群豐度變化不同。IBS患者結腸黏膜OTR表達上調,且與Tissierella豐度存在一定相關性。
腸易激綜合征(IBS)臨床上主要癥狀為腹痛、腹脹和排便習慣改變,其發病率高,約占總人口的11.2%[1],嚴重影響患者的生活質量、社會功能、工作效率,并導致巨大的衛生保健服務成本。目前IBS的發病機制仍不完全清楚,其中腸道菌群紊亂在這一過程中起有重要作用,但尚未對IBS相關腸道菌群的特定組成改變達成共識。有研究[2-3]發現IBS患者腸道催產素受體(oxytocin receptors, OTR)表達上調且可誘導內臟高敏感。故IBS患者腸道菌群紊亂與結腸OTR表達上調可能存在一定聯系。本研究通過探討IBS患者各亞型黏膜相關菌群特征和OTR表達,旨在探討腸道菌群紊亂與OTR表達之間的相關性。
材料與方法
一、資料來源
選取2017年7月—2017年12月長治醫學院附屬和平醫院收治的IBS患者,診斷符合羅馬Ⅳ標準[4]。根據羅馬Ⅳ標準將IBS分為四種亞型:①便秘型IBS(IBS-C):塊狀或干硬糞便≥25%,糊狀或水樣糞便<25%;②腹瀉型IBS(IBS-D):糊狀或水樣糞便≥25%,塊狀或干硬糞便<25%;③混合型IBS(IBS-M):塊狀或干硬糞便、糊狀或水樣糞便均≥25%;④不定型IBS(IBS-U):糞便性狀不符合上述診斷標準者。硬便或塊狀便為Bristol分級1~2級,水樣便或糊狀便為Bristol分級6~7級。納入標準:①年齡18~60歲;②血尿便常規檢查無明顯異常;③腹部超聲、結腸鏡檢查無異常。排除標準:①合并其他疾病;②既往有腹部手術史;③近1個月內曾連續使用抗菌藥物超過3 d;④近2周內連續服用益生菌、通便藥、止瀉藥、促動力藥超過3 d;⑤年齡<18歲或>60歲;⑥處于月經期或哺乳期女性。選取同期健康體檢無明顯異常者作為對照組。本研究方案通過和平醫院倫理委員會審核批準,所有研究對象均簽署知情同意書。
二、方法
1. 患者病情嚴重程度評估:由IBS患者根據自身情況填寫IBS病情嚴重程度調查表,并計算評分。
2. 腸黏膜標本收集:入選者禁食,在內鏡檢查前5 h,將聚乙二醇電解質散(江西恒康藥業有限公司)139.12 g溶解于2 L溫開水中,每10 min服用250 mL,2 h內服完。從距肛門近端25~35 cm處取黏膜組織2塊,分別用于檢測腸道黏膜菌群多樣性和豐度以及腸道黏膜OTR表達。
3. 腸道黏膜微生物DNA提取和組成評估:利用細菌基因組DNA提取試劑盒(德國QIAGEN公司),嚴格按照說明書提取腸道黏膜菌群DNA,利用Thermo NanoDrop 2000紫外微量分光光度計和1%瓊脂糖凝膠電泳進行總DNA質檢。PCR擴增基因組DNA,擴增選擇區域為V3~V4區,引物為F341和R806[5],采用Illumina MiSeq平臺進行測序(由上海銳翌生物科技有限公司完成)。
4. 免疫組化法測定結腸黏膜OTR蛋白表達:按照兩步法進行免疫組化染色(試劑購自Abcam公司,工作濃度為1∶250),封片后在顯微鏡下觀察并攝片。結果判定:細胞質中出現棕黃色顆粒沉淀為陽性細胞。每張切片選取視野清晰的5個不重復的高倍視野(×400),運用Image-Pro Plus 6.0圖像分析軟件,計算光密度值并取均值。
三、統計學分析
結 果
一、基本情況
研究期間,共納入25例IBS患者,其中男11例,女14例,平均年齡為(47.16±11.01)歲;IBS-U患者10例,其中男2例,女8例,平均年齡為(48.40±12.01)歲,嚴重程度評分為213.33±30.95;IBS-D患者15例,其中男9例,女6例,平均年齡為(46.33±10.64)歲,嚴重程度評分為210.67±45.27。對照組13名,其中男6名,女7名,平均年齡為(48.62±11.94)歲。IBS組和對照組性別構成比、年齡相比差異均無統計學意義(χ2=0.016,P>0.05;t=0.376,P>0.05)。IBS-D組與IBS-U組性別構成比、年齡、嚴重程度評分相比差異均無統計學意義(χ2=2.442,P>0.05;t=-4.52,P>0.05;t=-0.175,P>0.05)。
二、腸道菌群組成分析
IBS-D組、IBS-U組和對照組腸道黏膜相關菌群在門水平上以變形菌門(37.8%、43.2%、46.6%)、厚壁菌門(29.5%、26.4%、29.1%)、擬桿菌門為主(25.4%、23.7%、16.7%)(圖1)。
三、腸道菌群多樣性分析
Alpha多樣性分析顯示,IBS-D組、IBS-U組和對照組之間chao1指數、shannon指數相比差異無統計學意義(P>0.05)(圖2)。
四、腸黏膜菌群豐度差異分析
與對照組相比,IBS組Granulicatella豐度明顯減少(H=6.212,P<0.05);Tissierella豐度明顯增加(H=6.688,P<0.05)。IBS-D組Syntrophaceae、Porphyromonas、Marmoricola、Cardiobacteriales、Cardiobacterium、Cardiobacteriaceae豐度明顯高于IBS-U組和對照組(P均<0.05)(圖3)。
五、結腸黏膜OTR表達
免疫組化結果顯示,對照組、IBS-D組、IBS-U組結腸黏膜OTR表達分別為0.115±0.031、0.162 ±0.039、0.156 ±0.032,三組相比差異有統計學意義(F=7.045,P<0.01)。進一步分析發現,IBS-D組、IBS-U組OTR表達顯著高于對照組(P<0.05),而前兩組之間無明顯差異(P>0.05)(圖4)。
六、OTR表達與Granulicatella、Tissierella之間的相關性
Pearson相關分析發現,結腸黏膜OTR表達與Granulicatella豐度無關(r=0.156,P=0.350),而與Tissierella豐度呈正相關(r=0.542,P<0.01)。
七、Granulicatella、Tissierella豐度、OTR表達與IBS嚴重程度評分相關性
Pearson相關分析發現,Granulicatella、Tissierella豐度、OTR表達與IBS嚴重程度評分均無關(r=-0.187,P=0.372;r=-0.186,P=0.374;r=0.132,P=0.529)。

圖1 各組門水平上菌群組成
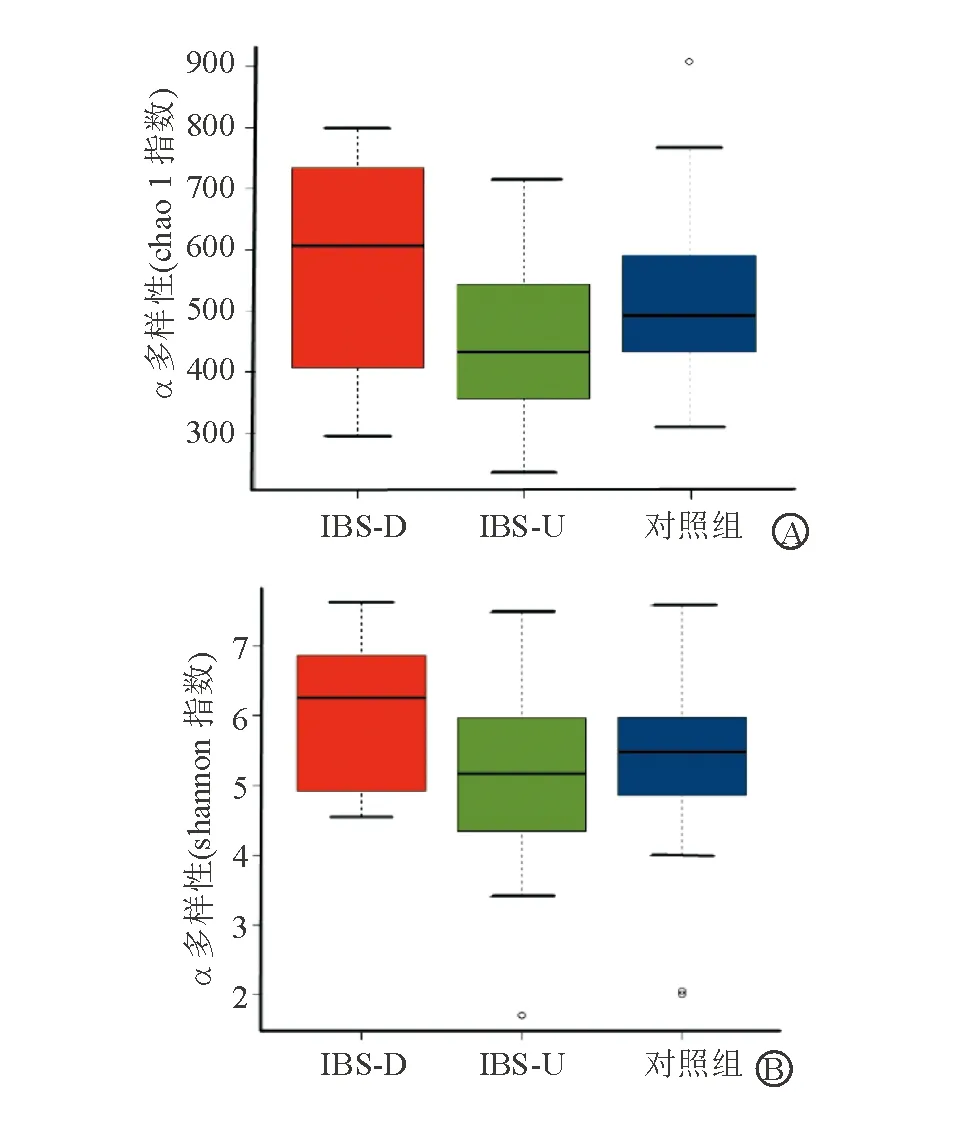
A:chao1指數;B:shannon指數
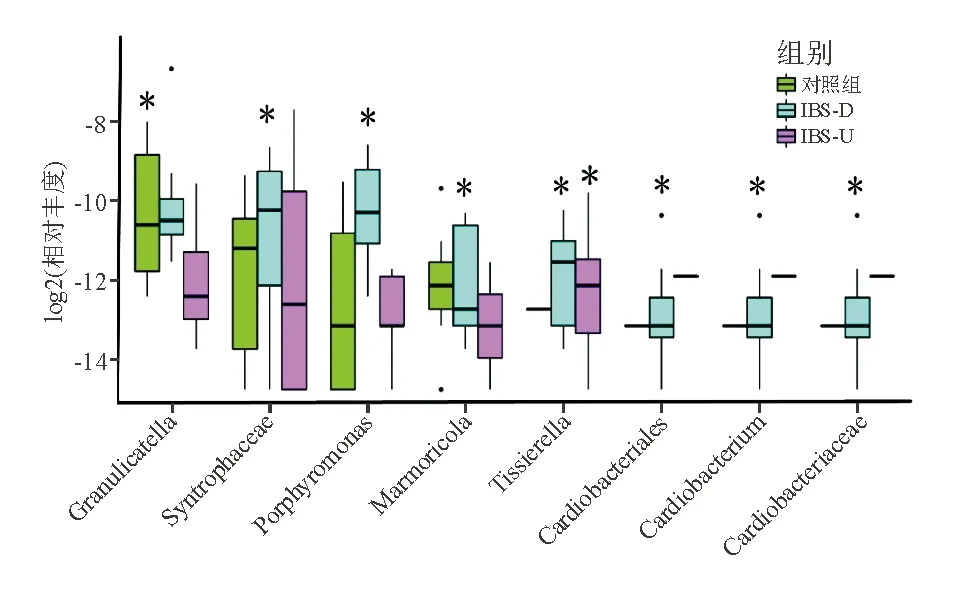
*P<0.05
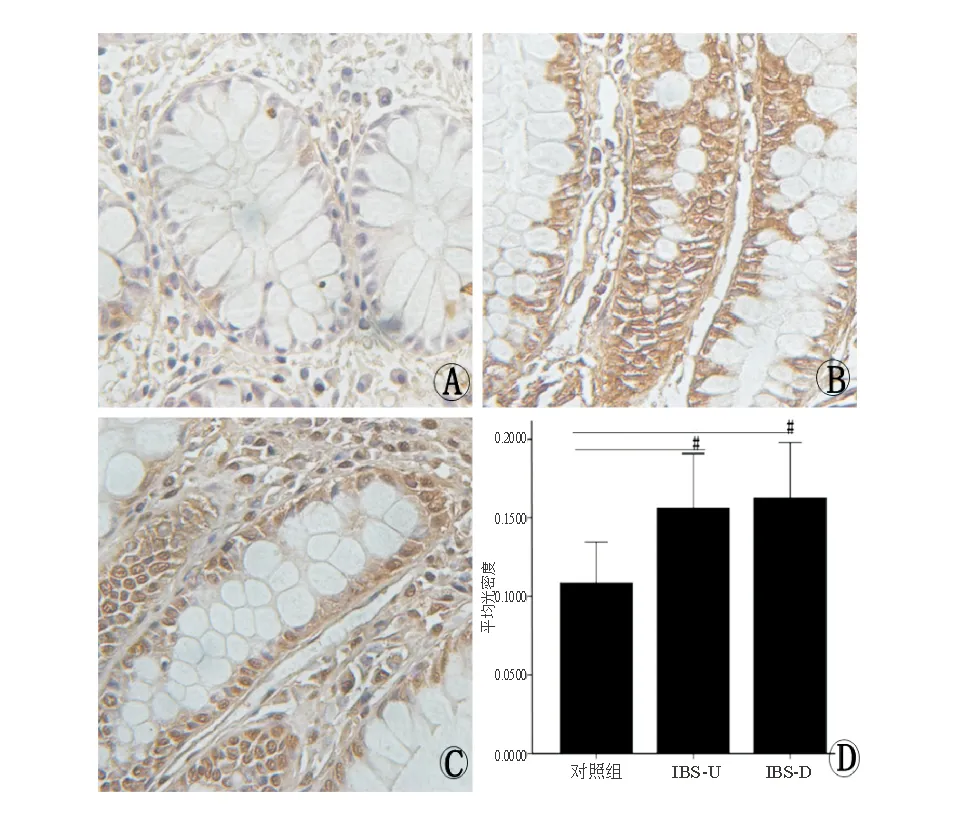
A:對照組;B:IBS-D;C:IBS-U;D:OTR表達(#P<0.01)
討 論
IBS是臨床常見的腸道功能紊亂之一。Rangel等[6]發現IBS患者存在腸道菌群組成的改變。Crouzet等[7]將IBS患者糞便移植至無菌大鼠后,內臟敏感性明顯升高。使用抗菌藥物、益生菌或益生元可改變IBS患者腸道菌群的組成,從而改善癥狀[8-9]。由此可見,腸道菌群在IBS中起有重要作用。本研究中,IBS患者腸道黏膜菌群以變形菌門、厚壁菌門、擬桿菌門為主,且菌群多樣性與對照組無明顯差異。與Tap等[10]的研究結果一致。與對照組相比,IBS組Granulicatella豐度明顯減少,Tissierella豐度明顯升高;IBS-D組Cardiobacteriales、Cardiobacteriaceae、Cardiobacterium、Syntrophaceae、Porphyromonas、Marmoricola豐度明顯高于IBS-U組和對照組。而Liu等[11]發現,與健康對照組相比,IBS患者乳酸桿菌、雙歧桿菌和普氏糞腸球菌豐度存在顯著差異,尤其是IBS-D患者乳酸桿菌和雙歧桿菌豐度明顯降低。各研究間結果不一致可能與研究對象的種族、飲食、文化、經濟條件和地理位置差異,以及腸道菌群和糞便菌群存在差異等因素相關。
目前對腸道菌群的研究多基于糞便標本,僅少部分數據來自黏膜組織,這可能與糞便標本取樣簡單、來源豐富且易被研究對象所接受等優勢有關。但糞便樣品在排便過程中容易受到污染和外部干擾,且有研究發現糞便標本微生態組成隨收集時間變化而改變[12]。因此,黏膜標本更能準確反映腸道微生態改變。此外,有研究表明糞便標本的微生態組成與腸道黏膜組織標本存在顯著差異[6],且糞便菌群和黏膜菌群在腸道可能發揮不同作用,糞便菌群主要通過其代謝產物影響腸道功能[13],黏膜菌群可直接參與宿主免疫系統的相互作用[14]。
本組IBS-D組常見口腔致病菌Porphyromonas、Cardiobacterium豐度明顯高于對照組和IBS-U組,提示可能存在與IBS-D相關的口-腸移位途徑。IBS-D組Syntrophaceae豐度明顯高于對照組和IBS-U組。有研究發現Syntrophaceae可促進甲烷的產生[15],這可能與IBS-D患者腹脹、腹部不適相關。
OTR屬于G蛋白耦聯受體家族。Gong等[16]發現大鼠和人腸道黏膜肥大細胞上均有OTR表達,在內臟高敏感中起重要作用。有研究[3]表明OTR拮抗劑阿托西班可促進母嬰分離大鼠模型內臟高敏感的恢復,提示OTR可能在內臟高敏感中起有重要作用。本研究發現,與對照組相比,IBS組結腸黏膜OTR表達上調,進一步驗證了上述研究結果。
Buffington等[17]的研究發現母體高脂飲食可導致后代腸道微生物組的改變,并誘導行為改變,進一步研究發現母體高脂飲食后代下丘腦中催產素(OT)免疫反應神經元較少,這些改變可通過選擇性重新引入共生菌菌株而得以恢復。Sgritta等[18]發現羅伊乳酸桿菌可作用于迷走神經,恢復自閉癥小鼠模型中腦腹側背側核被蓋區內的社交誘導的突觸可塑性,從而逆轉小鼠社會行為缺陷;但對OTR缺乏的小鼠則無此作用。Varian等[19]發現細菌產物肽類或代謝產物可能調節宿主OT分泌。上述研究表明腸道細菌及其代謝產物可影響宿主OT-OTR通路。本研究中,結腸OTR表達與Tissierella豐度存在明顯正相關,與上述研究結果一致。Tissierella主要分解肌酐產生乙酸鹽,有研究[20]表明腸道菌群代謝產物短鏈脂肪酸可導致大麻素受體和阿片受體在腸道表達下降,加重IBS疼痛。推測Tissierella代謝產物可能引起OTR表達上調,從而導致IBS內臟高敏感,但由于研究條件受限,未能進一步驗證Tissierella與OTR之間的作用機制。
此外,本研究結果顯示結腸黏膜OTR表達、Granulicatella、Tissierella豐度與IBS患者嚴重程度無關,可能與IBS發病機制復雜相關。
總之,IBS亞型和對照組之間黏膜相關菌群差異可能是由于特定菌群的相對豐度改變造成的,而非整體改變所致。Tissierella豐度與結腸黏膜OTR表達存在一定相關性。這為進一步研究腸道黏膜菌群、OTR在IBS發病中的作用提供了理論基礎,但具體機制仍有待進一步研究。

