左、右半結腸癌在微衛星不穩定性、K-ras基因突變以及其他臨床病理特征方面的差異
陳朝旭 馬 歡 戰淑慧
青島大學醫學部附屬青島市市立醫院東院消化內科(266011)
背景:結腸癌是消化系統最常見的惡性腫瘤之一,左、右半結腸癌的發生機制、生物學行為、基因表達等方面存在明顯差異。目的:探討左、右半結腸癌在臨床病理特征、微衛星不穩定性(MSI)、K-ras基因突變等方面的差異。方法:收集2017年6月—2018年6月青島市市立醫院收治的144例術后病理檢查確診為結腸癌患者的資料,采用免疫組化法評估MSI,PCR法檢測K-ras基因突變情況。分析左半結腸癌、右半結腸癌的臨床病理特征、MSI、K-ras基因突變等的差異。結果:右半結腸癌好發于女性,左半結腸癌好發于男性。右半結腸癌的淋巴結轉移、CEA陽性率、MSI發生率明顯高于左半結腸癌(P<0.01),而K-ras基因突變率顯著低于左半結腸癌(P<0.05)。左半結腸癌K-ras基因突變與患者性別、淋巴結轉移和CEA陽性率有關(P<0.05);右半結腸癌MSI與患者性別、年齡和淋巴結轉移有關(P<0.05)。結論:左半結腸癌與右半結腸癌的MSI和K-ras基因突變存在不同程度的差異,可為結腸癌的診斷、個體化治療、預后提供依據。
結直腸癌是消化系統常見的惡性腫瘤之一,目前其發病率在惡性腫瘤中位居第三位,病死率位居第四位[1]。近年隨著我國經濟的迅速發展,普通人群的飲食結構發生了巨大變化,結直腸癌發病率和病死率均明顯上升。據2015年中國國家腫瘤登記中心(NCCR)的調查數據顯示,我國結直腸癌發病率在惡性腫瘤中位居第三位,病死率位居第五位[2]。以結腸脾曲為界,一般將結腸分為右半結腸和左半結腸,其中右半結腸包括回盲部、升結腸、橫結腸,左半結腸包括降結腸、乙狀結腸,部分學者將直腸歸為左半結腸。由于左半結腸、右半結腸的胚胎起源和生物學行為的不同,目前已普遍接受左半結腸癌、右半結腸癌是兩種不同疾病的概念[3]。此外,左半結腸癌、右半結腸癌的微衛星不穩定性(microsatellite instability, MSI)、K-ras基因表達存等在不同,影響了腫瘤對化療藥物、靶向藥物的反應性[4],標志著結腸癌進入了個體化治療的新時代。本研究通過對左半結腸癌、右半結腸癌患者MSI、K-ras基因突變以及臨床病理特征的差異進行分析,旨在探討兩者的差異,從而為結直腸癌的個體化治療提供一定的理論依據。
材料與方法
一、資料來源
選取2017年6月—2018年6月青島市市立醫院收治的144例接受手術治療且術后病理檢查確診為結腸癌的患者,左、右半結腸癌各72例。所有患者均為初治,術前未接受過放、化療,且不合并其他部位腫瘤。本研究方案通過青島市市立醫院倫理委員會審批。
二、研究方法
1. MSI的檢測:采用免疫組化SP法檢測錯配修復蛋白MLH1、MSH2、MSH6、PMS2表達,鼠單克隆抗體購于羅氏公司,免疫組化試劑盒購于北京中杉金橋生物技術有限公司。實驗步驟按照試劑盒說明書進行操作,組織以甲醛固定、石蠟包埋,再經脫石蠟、抗原修復,分別加入抗MLH1(工作濃度1∶150)、抗MSH2(工作濃度1∶100)、抗MSH6(工作濃度1∶150)、抗PMS2(工作濃度1∶150)單抗,36 ℃孵育16 min,蘇木精復染4 min,靛藍試劑再次復染4 min。以正常細胞染色為對照,當細胞核內出現棕色或褐色顆粒時判定為MLH1、MSH2、MSH6、PMS2陽性細胞(圖1)。當四種蛋白均為陽性表達時則判定為微衛星穩定(MSS),四項中任一項為陰性則為MSI。
2. PCR-熒光探針法檢測K-ras基因突變情況:提取組織DNA(QIAamp DNA FFPE Tissue Kit購自QIAGEN),以分光光度計檢測DNA濃度,計算A260 nm/A280 nm比值,隨后行PCR擴增(試劑盒購自北京鑫諾美迪基因檢測技術有限公司)。擴增條件:95 ℃預變性3 min;94 ℃變性15 s,60 ℃退火、延伸35 s,共45個循環。當ΔCt值<8,判定為K-ras基因發生突變。
3. CEA的檢測:清晨取患者空腹血2~3 mL,離心,采用化學免疫分析法測定血清CEA水平,具體步驟按照羅氏公司試劑盒說明書操作。
三、統計學分析
采用SPSS 22.0統計學軟件,計數資料率的比較采用χ2檢驗或Fisher精確檢驗,P<0.05為差異有統計學意義。
結 果
一、一般資料
72例右半結腸癌患者中,男性27例,女性45例,年齡31~88歲,平均67.2歲;72例左半結腸癌中,男性48例,女性24例,年齡44~84歲,平均64.3歲。
144例結腸癌患者中,65例(45.1%)CEA陽性,37例(25.7%)發生MSI,74例(51.4%)發生K-ras基因突變。
二、左、右半結腸癌的差異
左半結腸癌與右半結腸癌在性別、淋巴結轉移、CEA陽性率、MSI、K-ras基因突變等方面相比差異有統計學意義(P<0.05),即右半結腸癌好發于女性,更易發生淋巴結轉移,CEA陽性率、MSI發生率更高,左半結腸癌K-ras基因突變率更高;而左半結腸癌、右半結腸癌患者的年齡、病理類型、浸潤深度、脈管浸潤、神經浸潤等方面相比差異無統計學意義(P>0.05)(表1)。
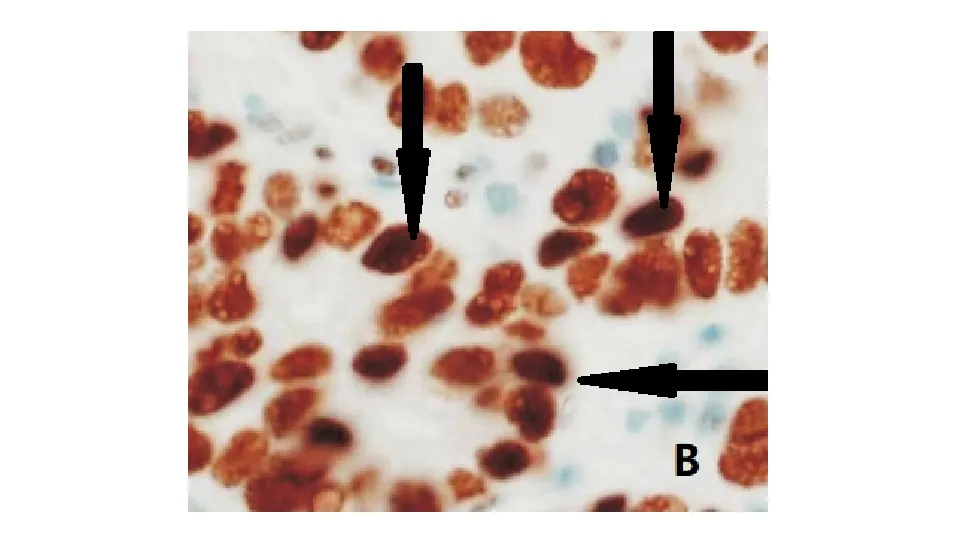
圖1 細胞核中出現褐色顆粒(免疫組化法,×400)
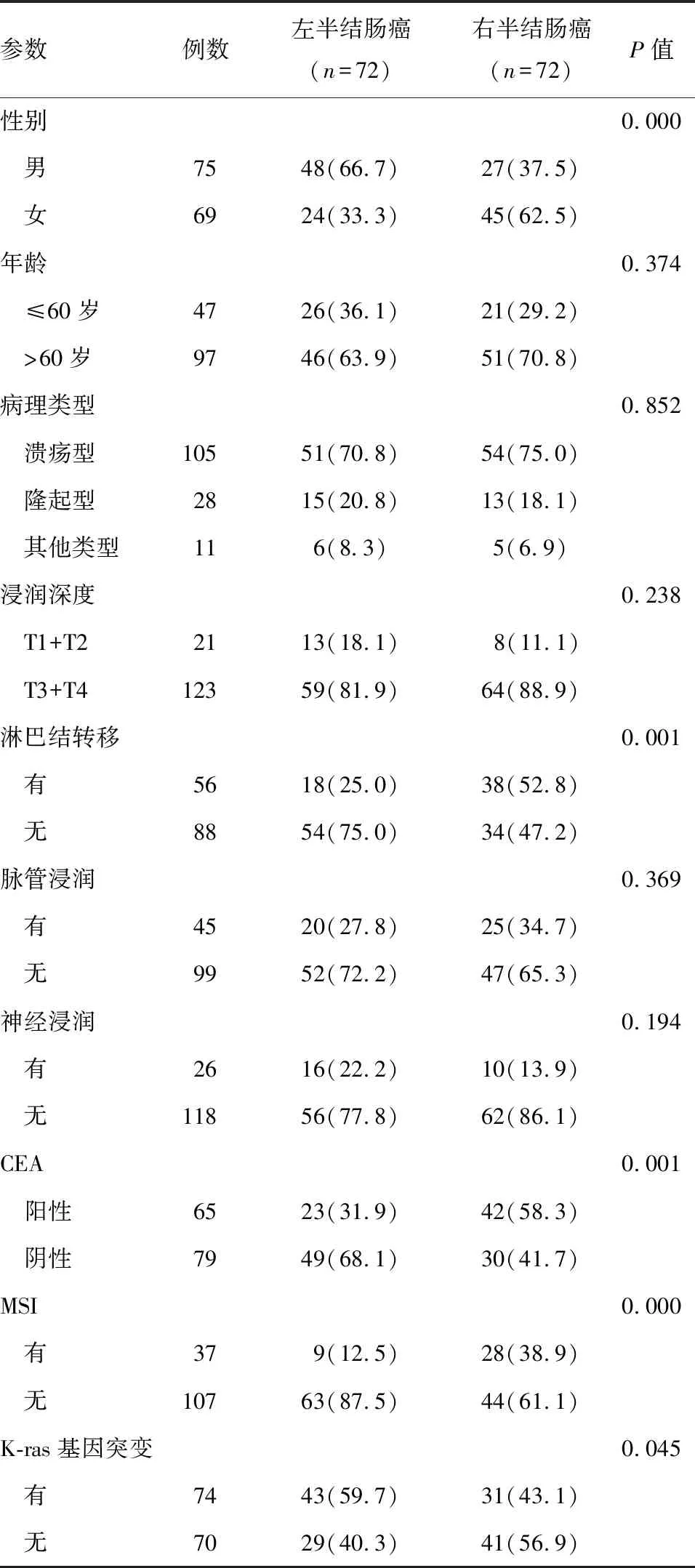
表1 左半結腸癌、右半結腸癌的臨床病理特征、MSI、K-ras基因突變情況比較 n(%)
三、左半結腸癌K-ras基因突變與臨床病理特征的關系
在左半結腸癌中,K-ras基因突變與患者性別、淋巴結轉移和CEA陽性率有關,差異均有統計學意義(P<0.05),而與年齡、病理類型、浸潤深度、脈管浸潤、神經浸潤均無關(P>0.05)(表2)。
四、右半結腸癌MSI與臨床病理特征的關系
在右半結腸癌中,MSI與患者性別、年齡、淋巴結轉移有關,差異均有統計學意義(P<0.05),而與病理類型、浸潤深度、脈管浸潤、神經浸潤和CEA陽性率均無關(P>0.05)(表2)。
討 論
結直腸癌是嚴重威脅人類健康的惡性腫瘤之一,其發生、發展是基因、環境等因素共同作用的結果,其中基因因素如癌基因、抑癌基因等突變在結直腸癌的發生中起有至關重要的作用。目前,結直腸癌的發生機制仍未完全明確,RAS/RAF/MAPK、PI3K/AKT等由表皮生長因子受體(EGFR)介導的下游信號轉導通路持續激活導致腫瘤發生的觀點已得到廣泛認可[5],其中K-ras基因突變被認為是結直腸癌發生的早期標志。K-ras基因是RAS家族的重要成員,亦是EGFR通路中最易突變的基因,在肺癌、結直腸癌、胰腺癌等惡性腫瘤的發生、發展過程中起重要作用。K-ras基因可編碼具有GTP酶活性的RAS蛋白,當K-ras基因發生突變時,RAS蛋白的結構發生變化,GTP酶活性下降,使EGFR通路異常活化,細胞處于持續增殖狀態,最終導致腫瘤的發生[6-8]。K-ras突變型已成為潛在的腫瘤標志物以及精準治療的靶點[9]。目前,EGFR藥物西妥昔單抗和帕尼單抗已用于結直腸癌的治療,但僅K-ras野生型患者才能從EGFR治療中獲益[9-10]。2015年美國國立綜合癌癥網絡(NCCN)指南亦建議,結直腸癌患者接受靶向治療前需行全RAS基因(包括K-ras、N-ras)檢測[11]。因此,K-ras基因檢測有望使結直腸癌患者的精準治療成為可能。
除上述基因途徑外,MSI途徑亦是引發結直腸癌的重要機制,該途徑于1993年首次在遺傳性非息肉病性結直腸癌(hereditary non-polyposis colorectal cancer, HNPCC)中發現[12]。微衛星是基因組中具有高度特異性的短串聯重復序列,當錯配修復基因(MMR)發生突變或啟動子區甲基化時,引起MMR系統功能降低或喪失,使重復序列插入或缺失不能被糾正,導致微衛星的長度發生改變,造成MSI,細胞失去正常調控功能,進一步引起遺傳物質的不穩定性,或使癌基因、抑癌基因突變迅速積累,造成細胞增殖失控,從而引起腫瘤的發生。目前主要采用PCR和免疫組化法檢測MSI,這兩種檢測方法無明顯差異。有研究指出,對5個微衛星位點(BAT25、BAT26、D2S123、D5S346、D17S250)行PCR檢測,2個或以上位點出現不穩定則定義為高度微衛星不穩定(MSI-H),1個位點不穩定則定義為低度微衛星不穩定(MSI-L),無位點不穩定則視為MSS[13]。有研究[14]發現,MSI-H的結直腸癌患者不能從氟尿嘧啶治療中獲益。NCCN指南亦指出,對Ⅱ期結腸癌患者給予氟尿嘧啶單藥化療前,需行MSI檢測。目前美國食品與藥品管理局(FDA)已批準程序性細胞死亡蛋白1(programmed cell death protein 1, PD-1)抑制劑用于治療MSI-H的晚期實體腫瘤患者,為MSI型結直腸癌患者帶來了治療的新曙光。
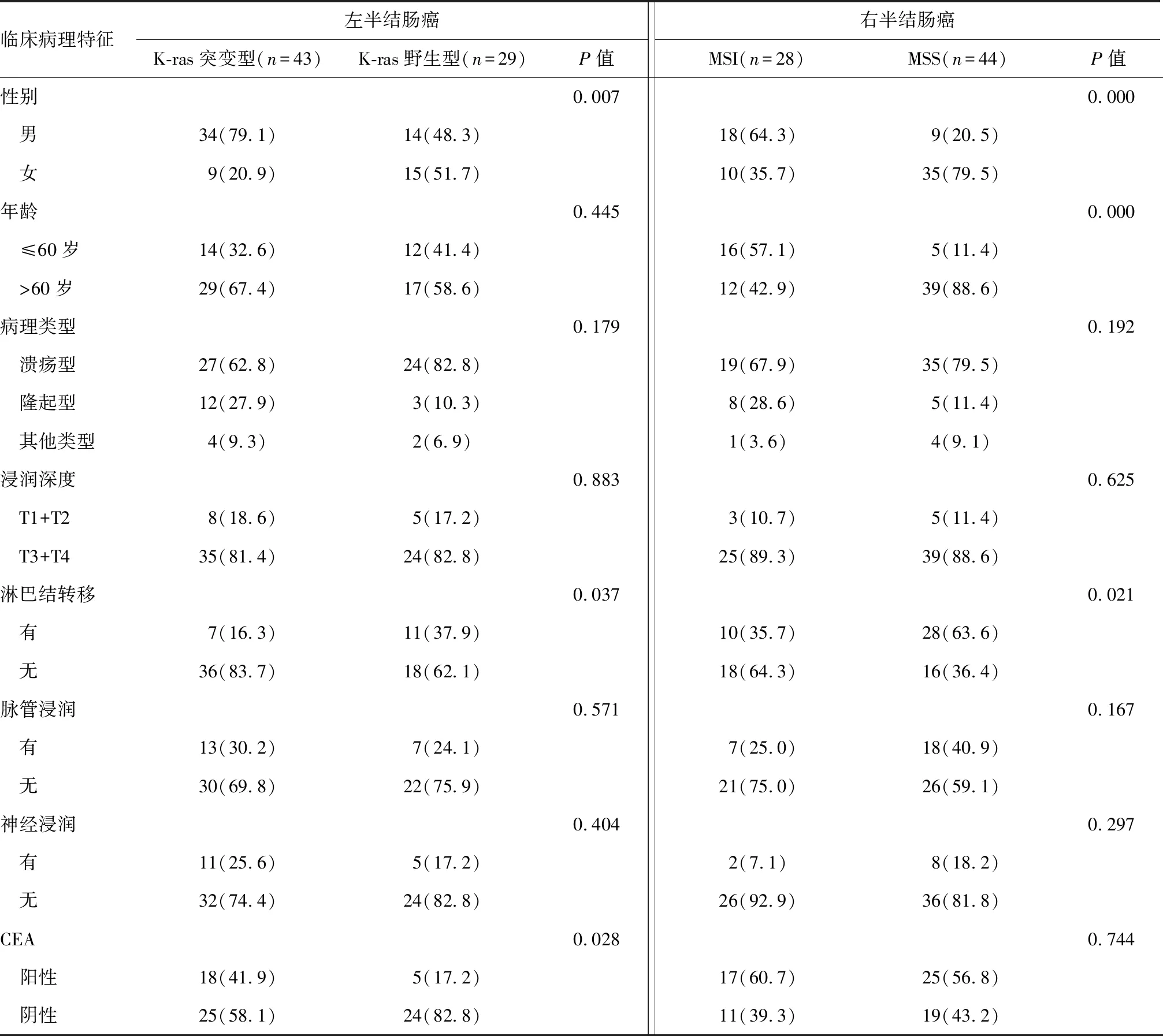
表2 左半結腸癌K-ras突變、右半結腸癌MSI與患者臨床病理特征的關系 n(%)
本研究對左半結腸癌、右半結腸癌患者的臨床病理特征、K-ras基因突變和MSI進行分析發現,右半結腸癌好發于女性,而左半結腸癌好發于男性。有研究認為,右半結腸中膽汁酸代謝酶7α-羥化酶的濃度較高,雌性激素能促進肝臟對膽固醇的代謝[15],使膽固醇、膽汁酸及其代謝產物次級膽汁酸(主要為石膽酸和脫氧膽酸)進入腸道,這些物質尤其是次級膽汁酸具有很強的致癌作用,因此女性更易發生右半結腸癌。而男性的不良生活習慣如酗酒、吸煙、低纖維素飲食等可能是其左半結腸癌患病率高的原因[16-17]。從解剖部位來看,右半結腸血管、淋巴管較左半結腸更豐富,因此更易發生轉移,為右半結腸癌發生淋巴結轉移提供了解剖學基礎。多項研究[18-20]證實,在病理類型方面,右半結腸癌以黏液腺癌、印戒細胞癌多見,且分期晚,分化程度較低。但本研究未發現此現象,可能與印戒細胞癌、黏液腺癌的發病率較低有關,未來還需行多中心大樣本研究進一步證實。本研究發現,右半結腸癌CEA陽性率高于左半結腸癌。有研究證實CEA與TNM分期具有相關性[21],且右半結腸癌具有分期差、血管淋巴轉移率高等特點,導致右半結腸癌的CEA陽性率高于左半結腸癌。
本研究發現,結腸癌患者的K-ras基因突變率達51.4%,略高于以往的相關報道[22-23];且左半結腸癌K-ras基因突變率高于右半結腸癌(59.7%對43.1%,P<0.05)。從分子生物學水平看,染色體不穩定性(CIN)是結腸癌發生的重要機制之一。有研究[24]發現左半結腸癌患者的染色體異常率明顯高于右半結腸癌;隨后,不同研究證實CIN常發生于左半結腸癌[25-26]。CIN可引起癌基因如K-ras突變以及抑癌基因APC、p53失活,從而導致腫瘤的發生。但也有研究[27-28]認為K-ras基因突變好發于近端結腸。目前K-ras基因突變與結腸癌臨床病理特征之間的關系仍無明確定論。本研究結果顯示,左半結腸癌K-ras基因突變與性別、淋巴結轉移、CEA陽性率有關,而與年齡、病理類型、浸潤深度、脈管浸潤、神經浸潤無關。造成這種差異的原因可能與種族、樣本量、地域環境因素、檢測方法不一致等有關。此外,K-ras突變以點突變為主,其中以12、13密碼子突變最為常見[29]。有研究認為K-ras突變與結腸癌患者預后不良有關[30-31],且12密碼子突變患者復發率高于其他位點突變[32]。本研究未能行進一步分析。
本研究MSI的發生率為25.7%,且右半結腸癌的MSI發生率明顯高于左半結腸癌(P<0.05),與以往研究[33-34]結果基本一致。進一步說明左半結腸癌、右半結腸癌發病機制的不同,右半結腸癌可能由MSI觸發。目前對MSI與臨床病理特征的關系仍無確切定論。本研究發現,右半結腸癌的MSI與性別、年齡、淋巴結轉移有關。
綜上所述,除臨床病理特征方面存在不同外, 左半結腸癌、右半結腸癌的MSI、K-ras基因突變等亦存在差異,進一步闡明左半結腸癌、右半結腸癌為兩種不同的疾病,具有不同的生物學行為,為結腸癌的診斷、判斷預后和個體化治療提供了依據。

