利用化學實驗異常現象提升學生核心素養
何婷婷
摘 要:科學探究與創新意識是五個化學核心素養之一。化學實驗不僅是科學探究的重要載體,也是提升學生核心素養的有效手段。但是由于各種原因,實驗過程中有時會出現異常情況,若教師不及時分析,必然會對學生的認知造成錯誤的影響。為此,針對實驗異常現象進行分類,繼而分析產生異常現象的原因,讓學生理解“異常現象”蘊含的“合理現象”,從而提升學生的化學學科核心素養和完善化學學科的知識框架。
關鍵詞:化學實驗;異常現象;核心素養
“我聽說了,就忘記了,我看見了,就領會了,我做過了,就理解了。”美國華盛頓大學的這句話突出了“做中學”的重要性。“做中學”不可或缺的重要手段便是化學實驗,化學實驗不僅能激發學生學習化學的興趣,而且是提升學生科學探究能力的最佳方式。但是在具體教學過程中進行的實驗,教師演示或者學生實驗,由于多種不確定原因,會出現各種“異常現象”。實驗過程中“異常現象”的出現,有時是教師深入分析的契機,但大部分還是會對學生掌握正確的實驗現象造成困擾。因此教師若不及時加以指導和分析,學生會對“異常現象”耿耿于懷,知識層面上留下誤區,能力層面上得不到很好的發展,從而影響教學效果和學生能力的發展。因此,教師在教學過程中要變“異常”為“正常”,深挖“異常現象”中的化學道理,這不僅是培養學生實事求是的態度、提升科學探究和科學態度的核心素質的一種有效的方法和途徑,同時也對教師提出了更高的專業要求和臨場發揮的能力要求。
一、從已有知識遷移產生的“異常現象”
學習遷移是指一種學習對另一學習的影響,即已獲得的知識技能、過程方法、情感態度等在變化的情境中的運用。學習的遷移現象多種多樣,按性質可將其分為正遷移和負遷移。正遷移是指已獲得的知識對另一種學習起積極的促進作用。負遷移也稱干擾遷移,是指已有經驗對另一種學習起阻礙或干擾作用。
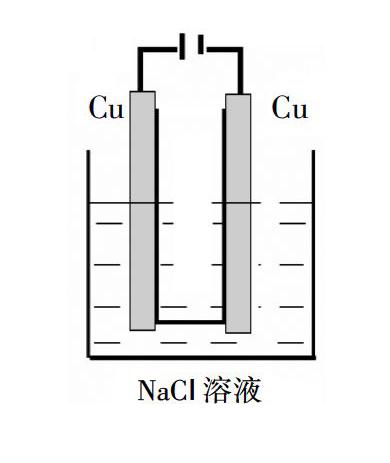
例1:電解精煉銅時,陽極材料為粗銅,陰極材料為純銅,電解質溶液為硫酸銅。讓學生寫出電極反應,學生可以很熟練地寫出陽極:Cu-2e-=Cu2+;陰極:Cu2++2e-=Cu。于是在《實驗化學》中用Cu做電極電解NaCl溶液,給出以下裝置,請同學們猜測實驗現象。
同學甲:陽極上產生黃綠色氣體,陰極有大量氣泡,且滴加酚酞陰極溶液變紅。
同學乙:不對,陽極沒有黃綠色氣體產生,陽極的Cu棒變細,溶液變成藍色。
“那么是不是像同學們剛才分析的那樣呢?請同學們按裝置組裝儀器,仔細觀察。”
現象:與外界直流電源接通后,陰極的Cu絲上產生大量氣泡,陽極Cu絲由粗變細。電解半分鐘內,陽極周圍出現白色渾濁,接著有橙黃色沉淀,一段時間后,橙黃色沉淀沉聚在電解槽底部。實際電解過程中的實驗現象始終沒有出現同學預測的溶液變藍現象。
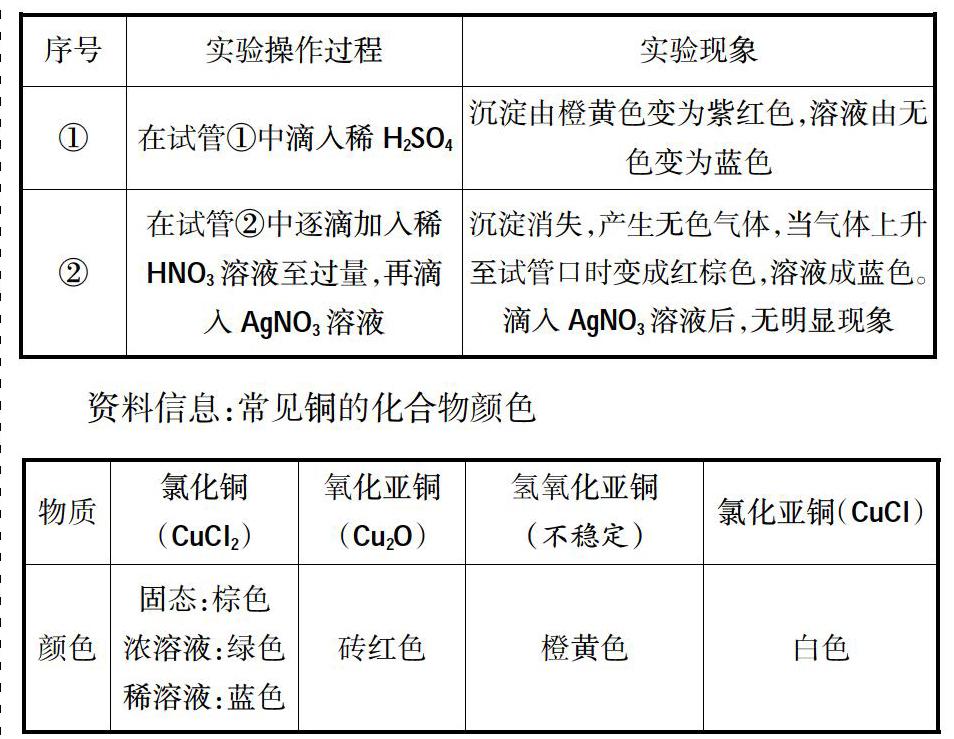
實驗探究:將電解槽底部的橙黃色沉淀取出,用蒸餾水洗滌沉淀2~3次,分裝在兩支小試管①、②中的實驗操作和現象:
反思:同學甲、同學乙的分析都不錯,陽極產物是Cl2,陰極產物是H2和NaOH,而不進行分析理解,這樣往往就掉入我明明“懂”的,為什么得不了高分的怪圈中。同學乙的遷移還是有一定道理的,當活潑Cu做電極時,陽極Cu是活潑金屬失去電子,當同學認定是“就是這樣”時,“異常現象”充分激起了學生的學習興趣,很想知道為什么會這樣?
同時通過“實驗異常現象”,可以讓學生體會到化學變化需要一定的條件并遵循一定的規律,遇到任何化學問題都需要具體內容具體分析,以提升學生變化觀念的核心素養。
例2:在電化學內容時,教師一般會說有兩個活潑性不同的電極是構成原電池裝置的條件之一,且活潑性較強的電極一般做負極,于是在實驗中設置了兩組原電池Mg—Al(HCl溶液)和Mg—Al(NaOH溶液),當電解質是HCl溶液時,同學們觀察到Al電極上產生了大量氣泡,于是同學們驗證了活潑Mg做負極這一結論。當電解質換成NaOH溶液時,同學們驚奇地問道:“為什么是Mg電極上產生氣體呢?Mg不是比Al活潑嗎?”“確實Mg比Al活潑,但是設計成原電池的首要條件是能發生自發進行的氧化還原反應,在NaOH溶液中,Al能發生反應,而Mg不能,因此判定原電池的正負極時,我們還需要考慮電解質溶液!”
反思:通過實驗中的“異常現象”,讓學生深刻體會到活潑金屬做負極只是判斷電極的一般規律,當電解質溶液等外部條件發生變化時,電極的正負極也可能產生相應的變化。
二、因試劑用量的差異引起的“異常現象”
學生實驗是讓教師既愛又恨的課型。因為實驗過程中,學生的實驗習慣非常差,就連最簡單的藥瓶取用,固體藥瓶是用藥匙的大頭還是小頭,液體藥品體積的多少都要強調很多遍,然而學生在實際操作過程中仍然沒有量多量少的概念,很是隨意。量變引起質變,往往就是這些壞習慣,導致了一些“異常現象”。
例如,《實驗化學》中鐵元素的檢驗,以補血藥“速力菲”說明書部分內容為情景進行實驗探究。
【規格】每片琥珀酸亞鐵含量約為0.1g。
【組成與性狀】內含Fe2+的無水堿式鹽,含量約為34.0%~36.0%的薄膜糖衣片。
【適用癥狀】用于缺鐵性貧血癥預防及治療。
【用法用量】預防量成人:0.1g/日、30~60mg/日;治療量0.2g~0.4g/日、小兒:0.1g~0.3g/日或遵醫囑。
【儲藏】密封、干燥避光、陰涼處保存。
【藥物相互作用】與維生素C同時服用,可增加本品吸收效果。
為了探究藥品“速力菲”中確實存在Fe2+且沒有變質,學生設計了如下實驗步驟:(1)取一顆藥片研碎后的粉末少量置于試管中,在該試管中加入少量蒸餾水溶解;(2)在該溶液中加入KSCN溶液,然后滴入H2O2溶液,若看到滴入KSCN不變紅,滴入H2O2后,溶液變成血紅色,則“速力菲”中含有Fe2+。事實勝于雄辯,按照同學設計的方案進行實驗后,一組同學小聲嘀咕:“為什么變紅后顏色又褪去了啊?”
探究:利用Fe2+的還原性,Cl2將Fe2+氧化到Fe3+,氧化得到的Fe3+與溶液中的SCN-結合顯血紅色。后血紅色褪去,可能的情況是:Fe3+被還原了或者SCN-反應了。到底是哪種情況,也可設計實驗驗證。方案一:在褪色的溶液中再滴加H2O2,若仍變血紅色,說明是Fe3+被還原了;方案二:在褪色的溶液中滴加KSCN,若變血紅色,說明是KSCN反應了。
實驗證明是KSCN與H2O2發生了反應出現了“異常現象”。KSCN為什么能與H2O2發生反應呢?原來SCN-離子C和N共用三對電子對,C和S共用一對電子對,S又從外界得到一個電子,因此SCN-具有一定的還原性。因此當H2O2過量時,SCN-會被氧化,從而出現了血紅色溶液褪去的現象。
反思:在血紅色溶液褪去的探究實驗中,讓學生控制H2O2溶液少量和過量做對比實驗,直觀地感受實驗過程中的用量對實驗也起著至關重要的作用,“過多”或“過少”都有可能觀察不到正常的實驗現象。當出現“異常現象”時,教師如果能正確引導,積極參與,共同分析不僅提升自身課堂的駕馭能力,而且能培養學生敢于質疑、勇于創新、嚴謹求實的科學態度。
三、因“副反應”引起的實驗異常
例如,蘇教版必修1 P88的觀察與思考的實驗3的實驗過程如下:取一支試管并加入5 mL二氧化硫溶液,滴加氯化鋇溶液,再滴加0.5 mL 3%的過氧化氫溶液,振蕩,放置片刻后滴加稀鹽酸,觀察實驗現象。
學生觀察到的實驗現象是滴入BaCl2溶液有少量渾濁;再加0.5 mL的3%的H2O2溶液后有大量白色沉淀生成,靜置后加稀HCl,白色沉淀不溶解。善于思考的同學立刻提出質疑,為什么滴入BaCl2溶液會有渾濁,因為弱酸不能制備強酸。
反思:教師肯定了學生的分析并表揚該學生觀察仔細,邏輯清晰。于是拋磚引玉讓學生談談他們的猜測,白色渾濁既然不是BaSO3只能是BaSO4了。學生頓時豁然開朗,宏觀現象的背后是微觀過程電子的轉移,那么能得電子的氧化劑是什么?我想,大部分教師都能很好地引導學生仔細觀察實驗現象,深入進行探究,從而提升學生的化學核心素養。
參考文獻:
[1]楊文斌.走出化學實驗教學的誤區[J].化學教學,2009(3).
[2]覃孔彪.學生自主實驗的課題研究與思考[J].中學化學教學參考,2009(12).
[3]方陳結.對高一化學兩個實驗的改進[J].中學化學教學參考,2009(3).

