端粒及其類似物在腫瘤靶向治療中的研究進展*
李 翠 綜述,羅 瑛 審校
(昆明理工大學醫學院衰老與腫瘤分子遺傳學實驗室,昆明 650000)
2009年學界發現端粒和端粒酶在染色體末端保護的作用機制,打開了腫瘤靶向治療的新方向,揭示了端粒和端粒酶的重要性。人端粒是位于真核生物線性染色體末端,由非編碼DNA重復序列TTAGGG和TRF1、TRF2、POT1、TIN2、PAP1、TPP1(POT1和TIN2結合蛋白)6種端粒結合蛋白組成的一種回環結構,具有保護染色體完整和維持基因組穩定的作用[1]。在經典的復制性衰老學說中,端粒隨著細胞分裂而縮短,直至Hayflick界限,細胞最終進入復制性衰老或死亡。大多數的腫瘤細胞通過重激活端粒酶補償機制維持端粒長度。端粒酶具有反轉錄活性,是真核細胞中的一種核酸聚合酶。人端粒酶結構包括端粒酶RNA組分(TERC),端粒反轉錄酶TERT,以及TP21、熱休克蛋白(hsp90)、p23等相關蛋白[2]。端粒酶在正常體細胞中活性的不可檢測性,使其成為具有研究前景的靶標。十多年來,學者圍繞端粒和端粒酶進行了多方面的探索和研究,其中以端粒作為靶標成效明顯的有G-四鏈體(G4)穩定劑,以端粒酶作為靶標成效明顯的有端粒酶免疫治療和端粒酶結構相關的核苷酸抑制劑。然而,近幾年研究發現,端粒酶陽性細胞和端粒酶陰性細胞在治療過程中出現了轉化的現象[3],這就使以端粒酶為直接或間接靶標的腫瘤靶向治療易脫靶及腫瘤細胞對藥物不敏感,從而增加腫瘤治療的難度。本文綜合目前的研究結果,對效果明顯的端粒和端粒酶的靶向治療進行概括,對T-Oligo與G4在腫瘤靶向治療中的作用與可能的機制進行綜述。
1 端粒、端粒酶與腫瘤靶向治療研究現狀
近20年,靶向端粒和端粒酶的癌癥治療策略研究成為生物學和醫學的研究熱點。端粒的結構比較特殊,在其3′末端有懸出的單鏈序列,使得端粒在一定情況下容易形成G4結構[4],這種結構不僅會阻礙端粒酶結合到單鏈末端甚至會使端粒末端出現脫環從而影響端粒的延長。因此,G4結構穩定劑的研究具有一定的抑制作用。例如,用穩定劑CX-5461處理后,神經膠質瘤細胞中的DNA雙鏈斷裂增加,細胞增殖受到抑制并誘導其發生凋亡[5]。順鉑衍生物四鉑選擇性穩定U2OS ALT腫瘤細胞中的G4結構,抑制端粒回環結構形成,減少姐妹染色體交換,從而誘發DNA損傷,誘導凋亡,但是對正常細胞影響甚微[6]。端粒酶結構成分比較復雜,但是對端粒酶活性起關鍵作用的結構主要是TERT亞基[7],TERT至少有5種剪接體,通過改變TERT的剪接體也能抑制端粒酶的活性。
端粒酶靶向治療的研究主要有以下3個方面:(1)針對TERC亞基的反義寡核苷酸;(2)針對TERT亞基的免疫治療;(3)針對端粒酶活性位點結構的非核苷酸抑制劑。目前,針對端粒酶靶點治療策略中比較有成效的是GRN163L、GV1001、BIBR15312、VX1001[8-10],但也有局限性:GRN163L是靶向TERC的一種反義寡核苷酸,在臨床Ⅱ期試驗中發現對固體瘤治療效果有限[11-12];BIBR1532是靶向端粒酶活性位點的小分子抑制劑,對短端粒腫瘤效果良好,但是對端粒較長的腫瘤治療效果有限;GV1001與VX1001都是利用TERT多肽結構引發CD4+與CD8+免疫應答達到治療腫瘤的目的,但是目前單一肽段效果有限,多種肽段組合還需要更多的研究[13]。近幾年研究表明,很多腫瘤在端粒酶介導的靶向治療過程中容易由端粒酶陽性轉換成端粒延長替代機制(ALT)維持端粒,這就容易導致脫靶,直接影響藥物療效,但是也有一部分的端粒酶陽性腫瘤細胞在治療過程中未出現這種情況,如GRN163L能很好地抑制端粒較短的NSCLC細胞的增殖[14],也能誘導鱗狀食管癌細胞的凋亡并且增加其放療的敏感性[15]。還有研究發現,在端粒酶陽性的腫瘤細胞中ALT特性的發展受到抑制,而其抑制的關鍵不太可能是端粒酶,但是具體的作用機制還不明確[3]。這也提示靶向端粒及其結構的研究可能會比直接靶向端粒酶相關成分更長久有效。
2 T-Oligo與腫瘤的靶向治療
T-Oligo是與端粒3′懸出末端同源的寡核苷酸,由十多個核苷酸構成,通常為11個,早在21世紀初就被應用于衰老機制的研究中。學者們發現細胞最終衰老的根本原因是端粒縮短到一定長度時,端粒單鏈末端無法侵入雙鏈端粒DNA中形成loop結構,使得染色質脫環,引發DNA損傷(DDR),從而走向衰老或凋亡。這與TRF2的缺失所引發的DDR基本一致,說明TRF2在端粒異常所致衰老或凋亡中具有重要作用。在引入T-Oligo后,隨著T-Oligo在細胞核中的積累,T-Oligo誘發同樣的DDR、周期阻滯和凋亡。這可能是由于激活了ATM通路及其下游因子p53、pRb、E2F1、P95/Nbsl、Chk2等[16-17]。
T-Oligo誘發細胞衰老和凋亡的特性被廣泛應用于腫瘤的靶向治療中。研究發現,當外來的寡核苷酸進入腫瘤細胞核內時主要發揮兩方面的作用:(1)與端粒招募的結合蛋白POT1、TRF2、TRF1等形成復合物[18],使端粒不能形成有效的核酸蛋白復合物,影響端粒結構的完整,引發細胞內的DDR等應激反應;(2)因其結構類似于暴露的端粒懸出末端,隨著T-Oligo在細胞核內的積累,細胞內的DDR或凋亡監控蛋白結合并識別T-Oligo直接引發細胞內周期阻滯、凋亡等應激反應。如圖1所示,T-Oligo作用機制圖:T-Oligo進入細胞核后通過WRN蛋白或Mre11/Hrad50/Nbs1復合物誘發腫瘤細胞DDR機制。通過ATM表達上調及其磷酸化,激活p53、p95/Nbs1、p73通路:ATM磷酸化直接促進Chk2和p53的磷酸化,并上調其下游因子p27、p21、p16、Bax誘導細胞的衰老或凋亡;ATM的磷酸化直接促使p95/Nbs1上調,誘發S期阻滯,最終走向衰老或凋亡;ATM磷酸化后促進Rb的磷酸化,并上調下游因子E2F1、p73引發S期阻滯,最終誘發細胞的衰老或凋亡。
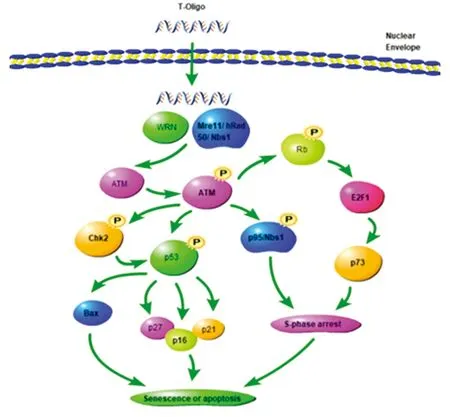
圖1 T-Oligo作用機制圖
在前列腺癌、淋巴瘤、乳腺癌、結直腸癌、非小細胞肺癌、黑色素瘤等腫瘤治療的研究中,T-Oligo展示了良好的抑癌抗癌效應[19]。前列腺癌細胞DU-145在用T-Oligo處理1 d后就可以明顯檢測到細胞增殖的抑制,在處理4~5 d后檢測到細胞的凋亡增強[20]。T-Oligo還能通過p53/p73通路誘導非小細胞肺癌細胞的衰老或死亡,而不影響正常的支氣管上皮細胞[21]。另一項對黑色素瘤細胞MU、PM-WK、MM-MC的研究發現,經T-Oligo(11堿基)處理,細胞通過WRN蛋白和ATM激酶上調p53、半胱氨酸天冬氨酸蛋白酶-3(caspase-3),下調血管內皮生長因子(VEGF)及其受體,并激活E2F1通路,誘導細胞的周期阻滯和凋亡[22]。在小鼠的黑色素瘤異種移植模型中發現,T-Oligo處理后,腫瘤轉移情況減少90%~95%,腫瘤體積減小84%~88%[23]。近期研究還發現,T-Oligo處理黑色素瘤細胞48 h后,細胞存活率減少75%[18]。T-Oligo還能激活黑色素瘤細胞中的ATM通路,上調ATM和ATM的磷酸化,以及下游p53、p73、Bax等相關因子。T-Oligo在腫瘤的靶向治療中不僅單獨使用有效,還能與其他的抗癌藥物聯合使用,增強抗癌療效。例如,T-Oligo單獨處理乳腺癌細胞時,能促進癌細胞的衰老和凋亡,而在用T-Oligo預處理后發現,放射治療的敏感性增加,對正常組織幾乎沒有影響[21]。T-Oligo在抗癌過程中并沒發現依賴于端粒酶,以上充分說明,T-Oligo的運用可能成為非常有效的抗癌方法,未來T-Oligo與其他抗癌藥物的聯合使用將具有較好的臨床應用前景。
3 G4與腫瘤的靶向治療
G4是一種在端粒區自發形成的二級結構。這種結構不僅能阻止端粒酶靠近端粒,還能阻止端粒區域復制叉的活動[24],從而克服端粒酶介導的細胞永生化。此外,G4還能抑制通過ALT機制延長端粒的策略。研究發現,DNA解旋酶能分解G4,而端粒酶不能分解G4結構,這一特性使G4配體及穩定劑的發展得到廣泛的研究和運用。G4配體能與端粒3′懸出端單鏈區緊密結合,促進G4的形成及其穩定。研究發現,G4配體在黑色素瘤細胞中與c-MYC和BCL-2啟動子序列相結合,下調c-MYC和BCL-2的表達,并抑制其增殖,誘導凋亡[25]。另一項研究顯示,G4配體可以用較低的濃度抑制神經膠質瘤細胞的增殖,并誘發DDR[26]。目前,最有前景的G4穩定配體包括Telomestatin、BRACO-19和RHPS 4。Telomestatin和RHPS 在腫瘤細胞中的作用機制尚不明確,但有研究發現RHPS4特異性結合G4后誘導U251 MG神經膠質瘤細胞G2/M期的阻滯,增加了放射治療的敏感性[27]。BRACO-19使腫瘤細胞出現后期橋和端粒融合,這可能是由于BRACO-19引發端粒T-loop結構的脫環或端粒結合蛋白的釋放引發DNA損傷[28],而端粒功能失調最終會引起p53和p21介導的細胞周期阻滯、衰老或凋亡。還有研究發現,鉀離子濃度在BRACO-19發揮作用的過程中,也具有重大作用[29]。目前BRACO-19的研究已經進入臨床研究階段,但是BRACO-19對腫瘤細胞的治療作用依賴于端粒的長度[30],端粒過長時,BRACO-19的作用效果明顯受阻。G4的研究對腫瘤靶向治療具有重大的意義,但是如何篩選出合適的治療群體,或者與其他治療方式聯合運用還需要進一步的研究。
4 小 結
端粒和端粒酶在腫瘤發生、發展過程中具有重要作用。絕大多數腫瘤細胞的端粒長度都比正常的體細胞短,而超過85%的腫瘤細胞中端粒酶被重新激活,這都使端粒和端粒酶成為腫瘤靶向治療的關鍵而被廣泛研究。但在端粒酶陽性的腫瘤細胞治療過程中發現腫瘤細胞特性由ALT陰性變為ALT陽性,這就容易導致治療效果降低甚至失敗;但是也有部分的端粒酶陽性腫瘤細胞在治療過程中沒有出現這種情況。因此,對腫瘤細胞的轉變性進行篩選將有利于靶向藥物的準確使用,或者在端粒酶陽性腫瘤治療的后期聯合引入ALT特性的靶向藥物,這都需要更進一步的研究來解決。此外,T-Oligo與G4在腫瘤靶向治療中具有良好的作用,但也都存在一定的缺陷,如T-Oligo因容易被核酸酶降解,在體內的傳遞受到阻礙。新發現的一種陽離子多肽形成的納米復合物具有良好的生物利用度,或許能幫助T-Oligo在體內的傳遞,但這還需要更多的研究證實。G4的使用從結構方面能很好地誘導端粒酶陽性和ALT特性的腫瘤細胞的衰老或凋亡,但是G4配體或穩定劑與G4結構的特異性結合與結合度都存在一些問題,還需要設計和發現更合適的小分子來穩定G4結構,從而為推動腫瘤靶向治療的長期穩定發展奠定基礎。

