中藥澤瀉藥效物質基礎研究進展與現存質量問題思考*
金青浩,侯晉軍,張建青,2,周 晶,吳婉瑩**,果德安**
(1.中國科學院上海藥物研究所中藥標準化技術國家工程實驗室 上海 201203;2.沈陽藥科大學藥學院 本溪 117004)
中藥澤瀉具有利水滲濕,泄熱,化濁降脂等功效,常用于治療小便不利,水腫脹滿,泄瀉尿少,痰飲眩暈,熱淋澀痛等癥,為中醫臨床常用中藥;僅在2015版《中國藥典》中,就有58個中成藥含有澤瀉[1,2]。澤瀉在《中國藥典》中收載的來源為澤瀉科植物澤瀉Alisma orientale(Sam.)Juzep.的干燥塊莖,其質量控制成分為三萜類成分23-乙酰澤瀉醇B。但我們在研究中發現市場流通的澤瀉依然存在指紋差別大、基原混亂而難以鑒別的實際問題。為了更好的認知中藥澤瀉的質量差異性,本文將在對澤瀉藥效物質基礎、藥理活性全面認識的基礎上,深入思考澤瀉藥材質量差異性產生的各種影響因素,并探討應對這些影響因素的對策。
1 澤瀉化學物質基礎研究概況
澤瀉中研究報道與藥效相關最多的成分主要為原萜烷型四環三萜類成分。上世紀60年代,日本學者T.Murata[3]對澤瀉的化學成分進行研究,首次從澤瀉中分離得到原萜烷型四環三萜醇澤瀉醇A乙酸酯乙酸酯和澤瀉醇B 乙酸酯。80 年代,Oshima,Y.[4]學者首次從澤瀉中分離得到愈創木烷型倍半萜alismol 和lismoxide。至今為止,從澤瀉中共分離得到超過180多個化合物,其中主要包括115 個三萜和52 個倍半萜,以及4 個二萜。而黃酮、生物堿、多糖、揮發油等成分則少見報道。
1.1 三萜
澤瀉中主要生物活性成分為原萜烷型四環三萜類。原萜烷型四環三萜是四環三萜達瑪烷的立體異構體,A-B、B-C和C-D環駢合方式為,椅-船-椅-船構象式展開,并規定了8α-CH3,9β-CH3,13α-H和14β-CH3的立體異構[5]。原萜烷型四環三萜僅大量分布于澤瀉屬澤瀉科澤瀉和東方澤瀉中,為澤瀉的特征性化學成分,也是澤瀉發揮利尿、降血糖、降血脂、抗脂肪肝及保肝藥效的主要藥效物質基礎。原萜烷型三萜類成分在其他種屬中也見少量分布,如Lobelia chinensis Lour.(Lobeliaceae),Garcinia speciosa Wall.(Guttiferae)和Leucas cephalotes(Roth)Spreng.(Labiatae)[5]。
目前共分離得到的115個三萜,其中113個為原萜烷型,僅Qiang[6]報道過1 個烏蘇烷型五環三萜arnidiol和1 個環阿屯型四環三萜3β-hydroxycycloart-23-ene 25-methyl ether(表1,圖1)。根據其結構類型可將澤瀉原萜烷型三萜分為四環三萜、五環三萜和降三萜,其中四環三萜根據結構特點可分為澤瀉醇A(E)類、澤瀉醇B類、澤瀉醇C類;五環三萜根據成環類型可以分為澤瀉醇F衍生物、螺甾烷型衍生物等(圖2)。
澤瀉醇類化合物中23-乙酰澤瀉醇B 的含量在各產地、各基原澤瀉中均含量較高,但23-乙酰澤瀉醇B具有熱不穩定性和酸不穩定性,在加熱或酸性條件下,易開醚環,生成24-乙酰澤瀉醇A。而24-乙酰澤瀉醇A同樣不穩定,在溶液中易發生乙酰基遷移現象,生成23-乙酰澤瀉醇A,最終二者比例約為1∶1 時達到動態平衡。澤瀉中三萜類化合物大多為澤瀉醇A或澤瀉醇B 的衍生物,這些衍生物同樣具有原型化合物的結構不穩定性質。這種不穩定性也給澤瀉質量控制帶來困擾。
1.2 倍半萜
倍半萜是澤瀉中僅次于三萜的第二大類化學成分,主要包含3 個異戊二烯單位。澤瀉倍半萜的分離最早始于1983年,Oshima,Y.[4]等首次從澤瀉中分離得到2個倍半萜,即alismol和alismoxide,這2個化合物也是澤瀉中最具有代表性的愈創木烷型倍半萜。據統計,截止2018年1月,從澤瀉和東方澤瀉中共分離得到52個倍半萜(表2),除了愈創木烷型倍半萜,還有少量的吉馬烷型、桉葉烷型倍半萜和Oplopanane 型。雖然從澤瀉中分離得到大量倍半萜,但是相對于三萜,倍半萜的豐度低,結構規律性差,難于檢測發現。因此,關于澤瀉倍半萜的研究鮮少報道。另外值得注意的是,在上世紀90 年代曾有報道過少量磺化倍半萜[53,54],而近年來卻未見報道。此類成分被報道的時間為中藥材行業濫用硫磺熏制工藝的時間,故推測澤瀉中磺化倍半萜類成分為硫磺熏制過程中產生的人工產物,而非澤瀉原生二次代謝產物。
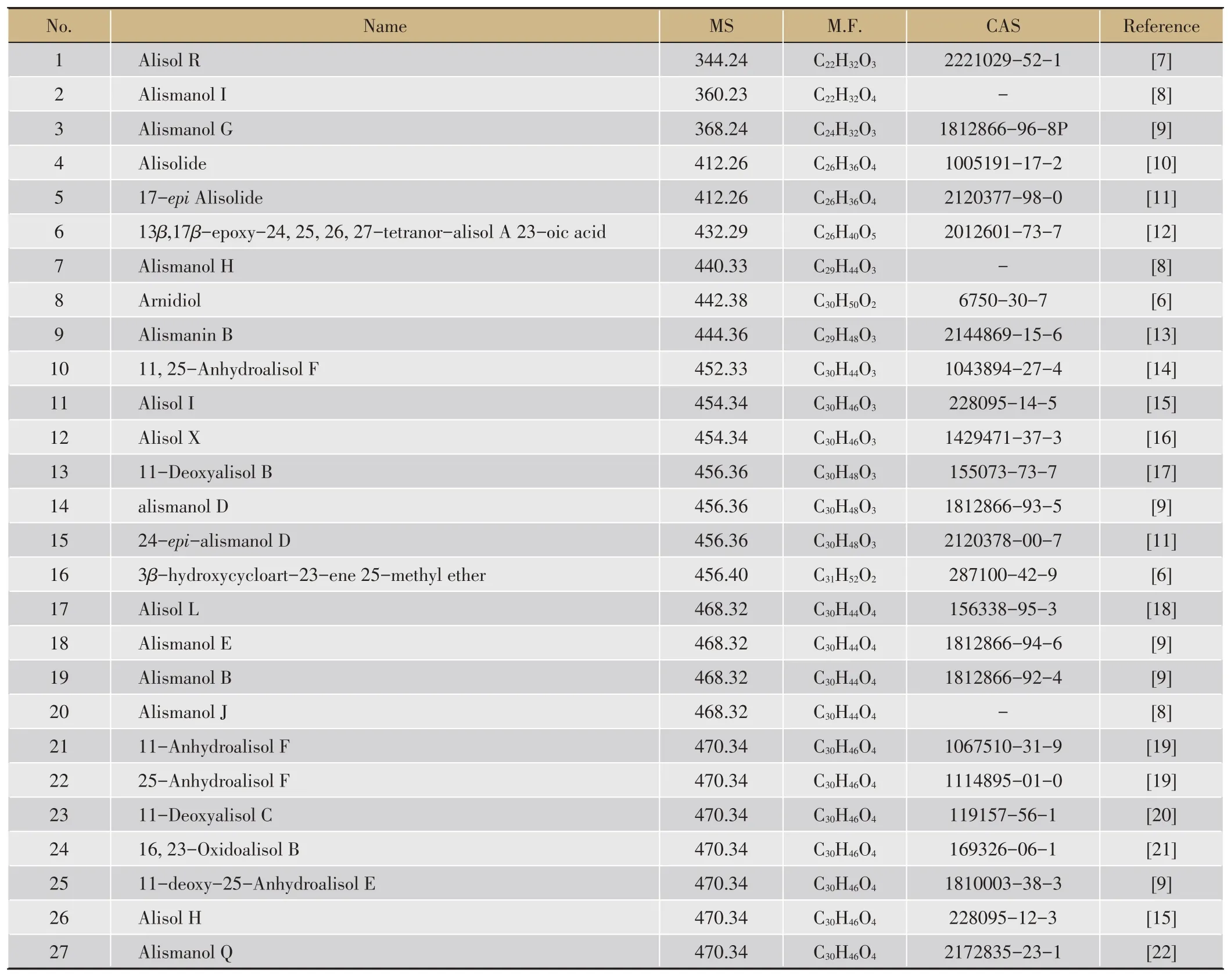
表1 澤瀉中分離得到的原萜烷型三萜類成分
續表1
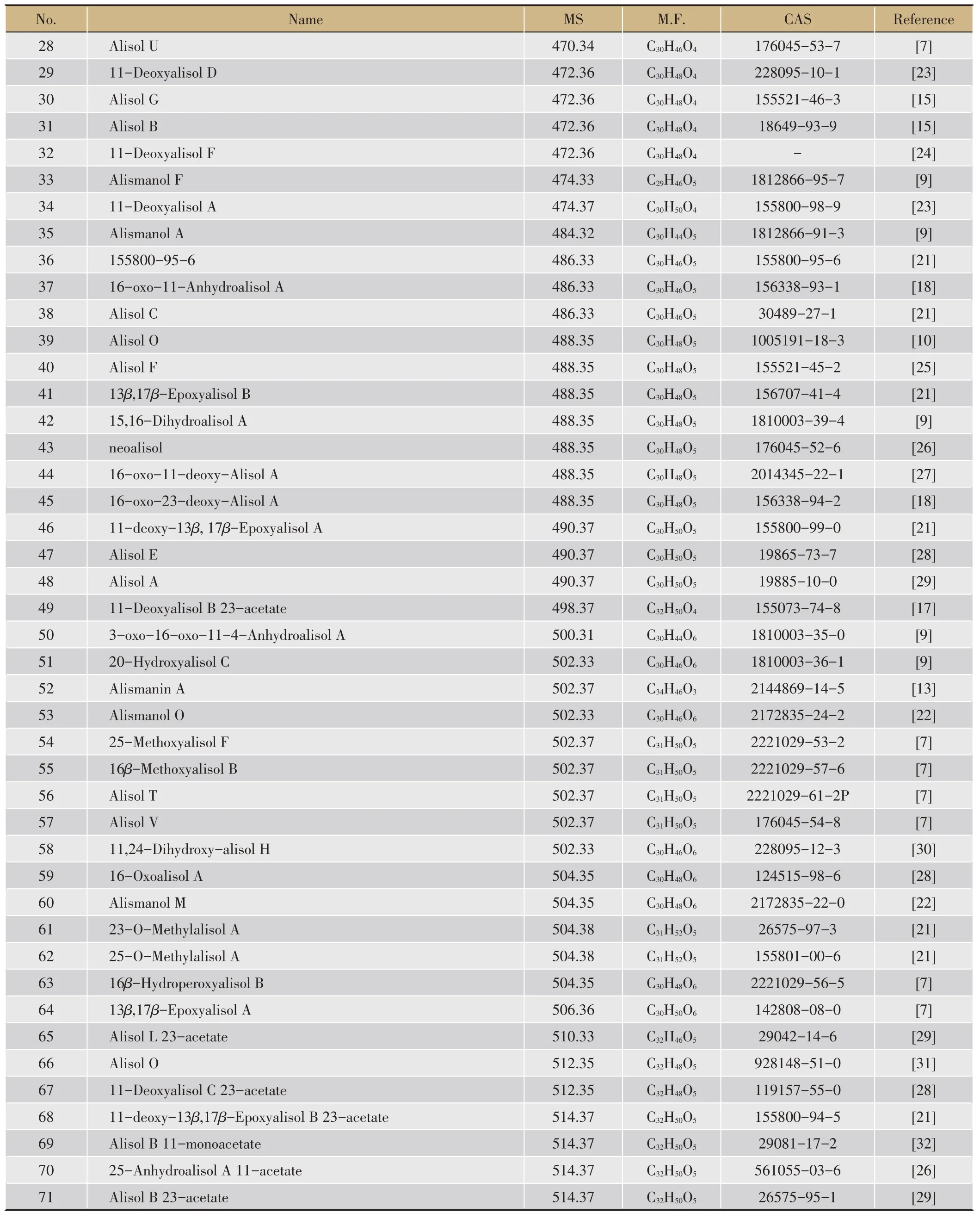
No.Name MS M.F.CAS Reference 28 Alisol U 470.34 C30H46O4 176045-53-7[7]29 11-Deoxyalisol D 472.36 C30H48O4 228095-10-1[23]30 Alisol G 472.36 C30H48O4 155521-46-3[15]31 Alisol B 472.36 C30H48O4 18649-93-9[15]32 11-Deoxyalisol F 472.36 C30H48O4-[24]33 Alismanol F 474.33 C29H46O5 1812866-95-7[9]34 11-Deoxyalisol A 474.37 C30H50O4 155800-98-9[23]35 Alismanol A 484.32 C30H44O5 1812866-91-3[9]36 155800-95-6 486.33 C30H46O5 155800-95-6[21]37 16-oxo-11-Anhydroalisol A 486.33 C30H46O5 156338-93-1[18]38 Alisol C 486.33 C30H46O5 30489-27-1[21]39 Alisol O 488.35 C30H48O5 1005191-18-3[10]40 Alisol F 488.35 C30H48O5 155521-45-2[25]41 13β,17β-Epoxyalisol B 488.35 C30H48O5 156707-41-4[21]42 15,16-Dihydroalisol A 488.35 C30H48O5 1810003-39-4[9]43 neoalisol 488.35 C30H48O5 176045-52-6[26]44 16-oxo-11-deoxy-Alisol A 488.35 C30H48O5 2014345-22-1[27]45 16-oxo-23-deoxy-Alisol A 488.35 C30H48O5 156338-94-2[18]46 11-deoxy-13β,17β-Epoxyalisol A 490.37 C30H50O5 155800-99-0[21]47 Alisol E 490.37 C30H50O5 19865-73-7[28]48 Alisol A 490.37 C30H50O5 19885-10-0[29]49 11-Deoxyalisol B 23-acetate 498.37 C32H50O4 155073-74-8[17]50 3-oxo-16-oxo-11-4-Anhydroalisol A 500.31 C30H44O6 1810003-35-0[9]51 20-Hydroxyalisol C 502.33 C30H46O6 1810003-36-1[9]52 Alismanin A 502.37 C34H46O3 2144869-14-5[13]53 Alismanol O 502.33 C30H46O6 2172835-24-2[22]54 25-Methoxyalisol F 502.37 C31H50O5 2221029-53-2[7]55 16β-Methoxyalisol B 502.37 C31H50O5 2221029-57-6[7]56 Alisol T 502.37 C31H50O5 2221029-61-2P[7]57 Alisol V 502.37 C31H50O5 176045-54-8[7]58 11,24-Dihydroxy-alisol H 502.33 C30H46O6 228095-12-3[30]59 16-Oxoalisol A 504.35 C30H48O6 124515-98-6[28]60 Alismanol M 504.35 C30H48O6 2172835-22-0[22]61 23-O-Methylalisol A 504.38 C31H52O5 26575-97-3[21]62 25-O-Methylalisol A 504.38 C31H52O5 155801-00-6[21]63 16β-Hydroperoxyalisol B 504.35 C30H48O6 2221029-56-5[7]64 13β,17β-Epoxyalisol A 506.36 C30H50O6 142808-08-0[7]65 Alisol L 23-acetate 510.33 C32H46O5 29042-14-6[29]66 Alisol O 512.35 C32H48O5 928148-51-0[31]67 11-Deoxyalisol C 23-acetate 512.35 C32H48O5 119157-55-0[28]68 11-deoxy-13β,17β-Epoxyalisol B 23-acetate 514.37 C32H50O5 155800-94-5[21]69 Alisol B 11-monoacetate 514.37 C32H50O5 29081-17-2[32]70 25-Anhydroalisol A 11-acetate 514.37 C32H50O5 561055-03-6[26]71 Alisol B 23-acetate 514.37 C32H50O5 26575-95-1[29]
續表1

No.Name MS M.F.CAS Reference 72 25-Dehydroalisol A 24-acetate 514.37 C32H50O5 561055-04-7[29]73 25-O-Ethylalisol A 518.40 C32H54O5 1810003-37-2[9]74 Alismanol P 518.32 C30H46O7 2172835-25-3[22]75 Alisol P 520.34 C30H48O7 1005191-19-4[10]76 16β-Methoxyalisol E 520.38 C31H52O6 2221029-58-7[7]77 5β,29-Dihydroxy alisol A 522.36 C30H50O7 2170098-63-0[33]78 16β-Hydroperoxyalisol E 522.36 C30H50O7 2221029-60-1[7]79 Alisol J 23-acetate 526.33 C32H46O6 228095-16-7[23]80 Alisol K-23-acetate 526.33 C32H46O6 228095-18-9[23]81 Alismaketone-C 23-acetate 528.35 C32H48O6 253337-70-1[15]82 Alisol Q 23-acetate 528.35 C32H48O6 1415932-52-3[34]83 Alismanol C 528.35 C32H48O6 1810003-34-9[9]84 16-oxo-11-Anhydroalisol A 24-acetate 528.35 C32H48O6 2012601-72-6[6]85 Alisol C 23-acetate 528.35 C32H48O6 26575-93-9[28]86 16β-Hydroxyalisol B 23-acetate 530.36 C32H50O6 115346-25-3[21]87 Alizexol A 530.36 C32H50O6 170384-74-4[35]88 Alisol N 23-acetate 530.36 C32H50O6 228095-22-5[23]89 Alisol F 24-acetate 530.36 C32H50O6 443683-76-9[36]90 Alismaketone-A 23-acetate 530.36 C32H50O6 190323-46-7[37]91 Aismaketone-B 23-acetate 530.36 C32H50O6 253337-69-8[15]92 Alisol D 530.36 C32H50O6 119188-55-5[20]93 16β-acetoxy Alisol B 530.36 C32H50O6 2226238-13-5[38]94 16α-acetoxy Alisol B 530.36 C32H50O6 2226238-14-6[38]95 Alisol S 23-acetate 530.36 C32H50O6 2221029-55-4[7]96 Alisol E 23-acetate 532.38 C32H52O6 155301-58-9[28]97 Alisol A 24-acetate 532.38 C32H52O6 18674-16-3[3]98 Alisol A 23-acetate 532.38 C32H52O6 19865-75-9[29]99 Alisol E 24-acetate 532.38 C32H52O6 725240-79-9[39]100 16β,25-Dimethoxyalisol E 534.39 C32H54O6 2221029-59-8[7]101 Alismalactone 23-acetate 544.34 C32H48O7 190323-45-6[37]102 Alisol M 23-acetate 544.34 C32H48O7 228095-20-3[23]103 16β-methoxyalisol B 23-acetate 544.38 C33H52O6 115333-90-9[40]104 16-oxoalisol A 23-acetate 546.36 C32H50O7 124516-00-3[28]105 16-oxoalisol A 24-acetate 546.36 C32H50O7 124516-01-4[28]106 25-O-butyl alisol A 546.83 C34H58O5-[8]107 16β-hydroperoxyalisol B 23-acetate 546.36 C32H50O7 2221029-54-3[7]108 13,17-epoxyalisol A 24-acetate 548.37 C32H52O7 725240-80-2[39]109 13,17-epoxyalisol A 23-acetate 548.37 C32H52O7-[39]110 16β-ethoxy Alisol B 23-acetate 558.39 C34H54O6-[8]111 3-methylalismalactone 23-acetate 558.36 C33H50O7 190274-90-9[15]112 Alisol D acetate 572.37 C34H52O7 119157-54-9[20]113 120409-41-8 586.39 C35H54O7 120409-41-8[28]114 120409-07-6 614.38 C36H54O8 120409-07-6[28]115 Alismanin C 528.35 C32H48O6 2144869-16-7[13]

圖1 澤瀉中三萜類化合物結構式
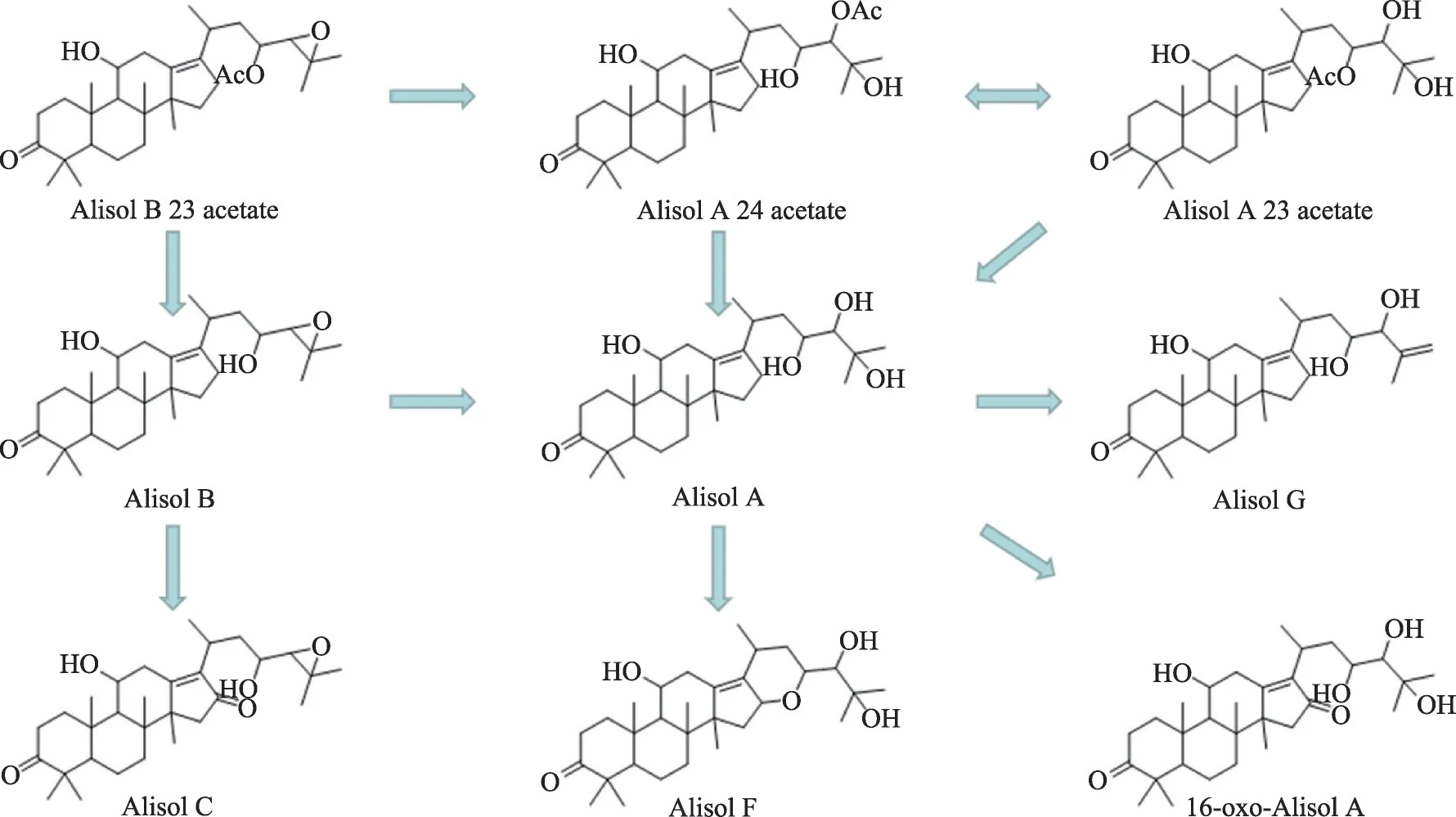
圖2 以23-乙酰澤瀉醇B為源頭的澤瀉原萜烷型三萜衍生路線圖
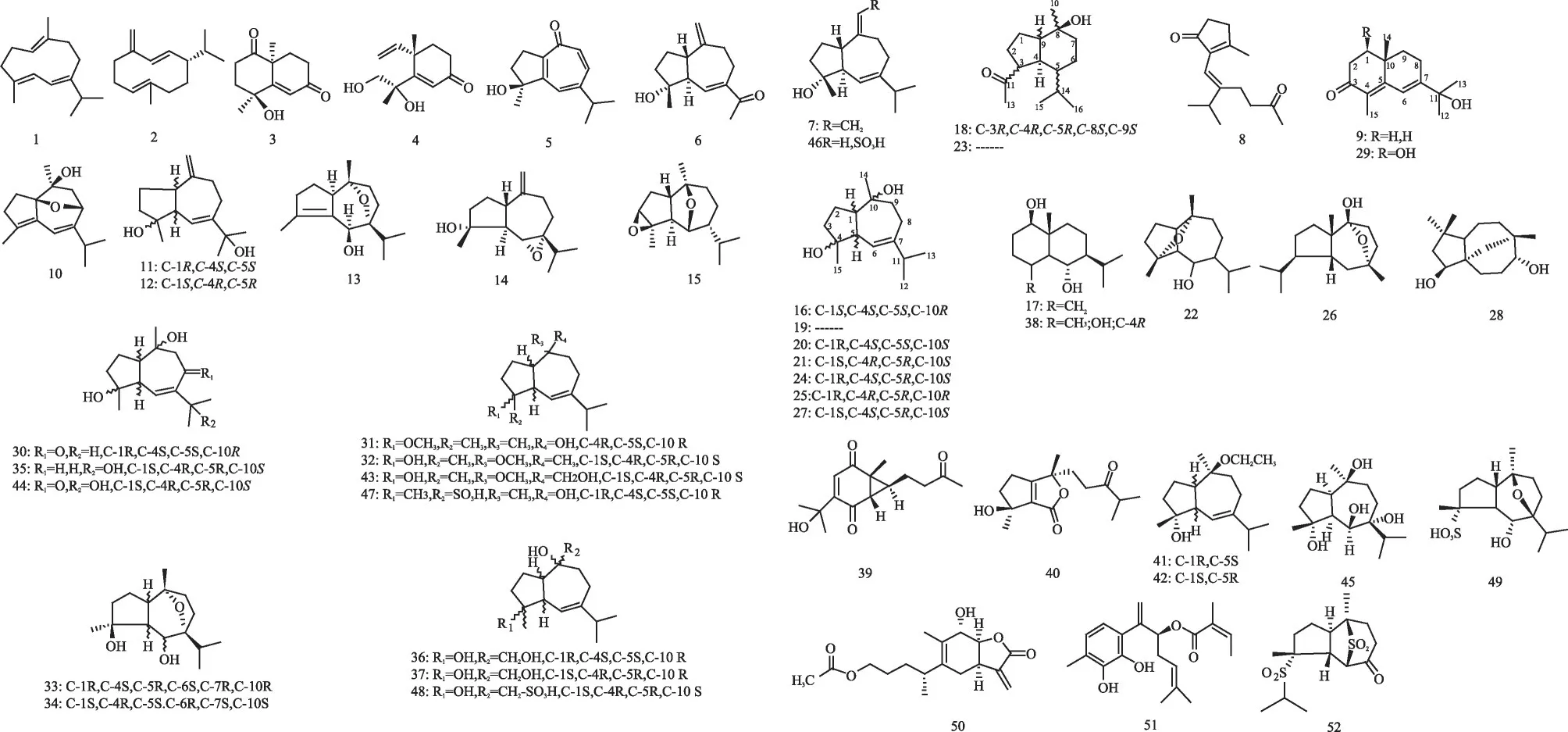
圖3 澤瀉中倍半萜萜類化合物結構式
2 澤瀉藥理活性研究概況
2.1 利尿作用
澤瀉具有利水、滲濕,泄熱的功效,據《醫學啟源》、《綱目》等記載,澤瀉主要用于治療小便不利,水腫脹滿。大量的現代藥理學研究確定了澤瀉的利尿活性,Feng等[55]的研究表明澤瀉發揮利尿活性的部位是乙醇提取層,而伍小燕[56]的研究表明單次和連續給予澤瀉水提物均可以發揮利尿活性。值得關注的是,Feng等[55]的研究表明澤瀉醇提物在大劑量時(20,40 和80 mg·kg-1)反而表現出抗利尿的作用,這提醒我們需要關注澤瀉臨床用藥的劑量。關于澤瀉利尿機制的研究較少,前期研究表明澤瀉利尿的物質基礎是澤瀉中的主要化學成分alisol A 23 acetate 和alisol B 23 acetate,通過促進電解質(Na+和K+)的排出而發揮利尿作用[57]。早期研究表明,澤瀉的利尿活性和螺內酯一致,主要作用于腎小管,競爭性的結合醛固酮受體,近來伍小燕研究表明給予澤瀉提取物后大鼠腎臟髓質AQP2 mRNA的水平降低,推測其利尿活性可能與降低腎臟髓質AQP2作用有關[56]。

表2 澤瀉中分離得到的倍半萜類成
2.2 抗非酒精性脂肪肝作用
1960年,Kobavashi等人發現了澤瀉的抗脂肪肝作用,隨著非酒精性脂肪肝在人群中的發病率顯著提高,澤瀉的肝保護活性逐漸成為當今國內外學者的研究熱點,對其肝保護作用機制的探討在眾多病癥的研究中也最為深入。早期文獻大量報道了澤瀉對于非酒精性脂肪肝的治療效果研究,近年來則主要集中于對澤瀉發揮抗脂肪肝的機制研究。龔杰[58]等報道了澤瀉提取物對SD大鼠非酒精性脂肪肝的保護作用,并檢測到與肝硬化密切相關的I 相代謝酶CYP2E1 和CYP2A5 基因下調,同時HepG2 細胞實驗表明,脂肪變性與內質網應激通路中JNK1、p-JNK1、CRP78、CHOP、XBP-1下調,STAT3上調有關。Jang 等[59]研究表明,澤瀉塊莖甲醇提取物(MEAO)也可以通過抑制肝細胞內質網應激(CRP78、CHOP、slice XBP-1)從而阻止肝細胞脂肪變性,除此之外,澤瀉甲醇提取物還可以通過抑制肝脂肪生成基因(FAS、ACC1和DGA7)和VLDLR 等基因的表達,增加ApoB 的分泌,從而阻止肝細胞病理性肝脂肪變性。總之,澤瀉發揮抗脂肪肝活性很可能是通過降低內質網應激,而內質網應激與包括糖尿病在內的多種疾病有關,因此可以推測澤瀉對糖尿病可能也會有一定的治療效果。同時內質網應激通過調節脂質生成基因和載脂蛋白的表達,從而改善胰島素抵抗,進而調節脂質代謝,說明澤瀉可能對高血脂癥有治療效果。內質網應激還可以激活Nrf2,JNK,和NFκ-B 通路,這些通路在炎癥進程中發揮重要的作用,說明澤瀉可能有一定的抗炎活性。
2.3 抗肝損傷和抗膽汁淤積
除了在抑制非酒精性脂肪肝中發揮重要作用外,澤瀉提取物及其單體在肝損傷和肝臟膽汁淤積也顯示了顯著的保護作用。Huo等[60]人研究表明澤瀉提取物通過激活FXR,下調膽汁酸攝取相關基因slc10al 和膽汁酸合成酶CYP7a1,上調膽汁酸代謝相關基因UGT1a1 和SULT2a1,最終縮小膽汁酸池,降低血清中AST,ALT,TBIL 和肝臟中TBA 的水平,并改善肝臟的病理學變化,從而逆轉α-萘基異硫氰酸酯(ANIT)誘導的大鼠膽汁淤積。而Meng 等[61]研究同樣表明alisol B 23 acetate 通過激活FXR 通路,逆轉α-雌炔醇誘導的大鼠肝臟損傷及膽汁淤積,但具體機制略有不同,相對于提取物,alisol B 23 acetate 同樣下調CYP7a1 并上調Sult2a1,但對Ugt1a1 沒有影響。除此之外,alisol B 23 acetate 還可上調膽鹽輸出泵BSEP 和多藥耐藥基因MRP2,增加膽汁酸從肝臟中的排出。并且alisol B 23 acetate 還可抑制NTCP 蛋白和肝臟對膽汁酸的吸收,下調CYP7a1的上游基因SHP 和FGF15,上調I相代謝酶CYP3a11,從而減少肝臟中膽汁的量。綜上所述,對于抗肝損傷和抗膽汁淤積癥,澤瀉主要通過作用于FXR通路發揮作用。
2.4 降血脂作用
前期研究表明澤瀉提取物可以降低人體和大鼠的TC、TG、LDL-G 的含量,并通過降低HMGCR,影響SREBF2和CYP7a1的表達,從而降低HFD昆明小鼠肝臟血清中膽固醇含量,降低甘油三脂含量,升高高密度脂蛋白[49]。近年來對澤瀉發揮降脂作用的機制研究較少,僅局限于細胞層面的機制探討。樓海霞[82]研究表明alisol A 24 acetate 通過激活PKA-HSL ERKPPARγ-Perilipin A 和AMPK-Perilipin 通路調控3T3-L1成熟脂肪細胞的脂質分解,降低脂肪細胞的脂質積累。alisol A 24 acetate 通過激活AMPK-ACC 和PPARα-CPT1A 通路抑制油酸鈉誘導的HL7702 肝細胞脂肪變性。Park等[62]報道了澤瀉乙醇提取物可以通過下調C/EBPβ,PPARγ和C/EBPα,進而下調脂肪分解直接相關的基因aP2、FAS、HSL、LPL,最終抑制OP9細胞的脂肪分化。由此可見,在細胞層面,AMPK 和PPARγ 均是澤瀉發揮降血脂作用的關鍵通路蛋白。侯惠民等報道澤瀉提取物中澤瀉醇A與24-乙酰澤瀉醇A 的重量比例為1:0.4 時具有最強治療動脈粥樣硬化效果[63]。許飛等報道澤瀉提取物中24-乙酰澤瀉醇A與23-乙酰澤瀉醇B的重量比為1:3時,對脂代謝關鍵酶HMG-CoA 還原酶具抑制作用,具有最好的降血脂活性[64]。
2.5 抗炎作用
澤瀉抗炎活性的研究,早期主要通過細胞模型抑制NO生成進行簡單評價,近幾年來,對澤瀉對于炎癥動物模型的治療效果研究報道越來越多,且較為深入。Shin[65]研究了澤瀉提取物對卵清蛋白誘導的BALB/c小鼠哮喘模型氣道炎癥的治療效果,結果表明,澤瀉提取物通過抑制NF-κB 蛋白的水平,進而下調NF-κB p65和iNOS mRNA 的表達,從而減少呼吸道高反應性,緩解呼吸道上皮增厚,最終達到抗哮喘的作用。同樣的Han[66]等研究了澤瀉乙醇提取物對C57 小鼠肺炎的治療效果,結果表明,其抗炎機制也與NF-κB通路有關。在LPS誘導的急性肺炎和LPS誘導的RAW 264.7細胞株模型中,高低劑量的澤瀉提取物均可以促進Nrf2的活性,這通過Nrf2 相關的靶基因NQO-1,HO-1 和GCLC 得到驗證,同時澤瀉提取物可以抑制NF-κB 及其相關促炎因子IL-1b 和促炎酶COX-2 和iNOS 的表達。上述結果表明,澤瀉提取物有顯著的抗炎活性,其作用機制可能和NF-κB相關炎癥通路相關。
2.6 抗腫瘤作用
澤瀉在抗癌方面的研究主要通過細胞模型試驗。前期研究試驗表明澤瀉提取物和alisol B 23 acetate 均可以逆轉腫瘤的多藥耐藥,alisol B 可以通過CaMKKAMPK-mTOR 途徑,內質網應激及UPR 途徑誘導癌細胞死亡。Alisol B 23 acetate 通過上調BAX 和核易位,激活caspase-8,caspase-9 和caspase-3,使人類激素抵抗前列腺癌PC-3 癌細胞發生凋亡,通過線粒體和PI3K/Akt信號通路誘導人胃癌細胞系SGC7901凋亡[49];Zhang[67]等對alisol B的抗乳腺癌活性進行了研究,結果表明,alisol B對乳腺癌細胞MDA-MB-231具有顯著的抑制作用,其機制與alisol B 誘導細胞凋亡,阻滯細胞周期于G0/G1期,使線粒體膜電位消失,激活caspase-3/-9 和p38 MAPK 信號通路,抑制MTOR/NF-κB 信號通路,誘導ROS 產生等因素有關。Zhang 等[68]對alisol B 23 acetate 的抗卵巢癌活性進行了研究,結果表明,alisol B 23 acetate 通過下調CDK4,CDK6 和cyclin D1將細胞周期阻滯于G1期,上調PARP和Bax/Bcl-2比例誘導細胞凋亡,通過內質網應激IRE1信號通路發揮抗癌活性,下調金屬蛋白酶MMP-2 和MMP-9 的水平來影響細胞遷移,最終發揮其對癌癥細胞的抗細胞增殖,抗遷移和抗侵襲作用。
3 影響澤瀉藥材質量因素
通過對澤瀉化學物質基礎和藥理活性相關文獻梳理,可以發現澤瀉藥效物質基礎具有以下兩個特點:①其藥效相關成分具有熱不穩定性,以主成分23-乙酰澤瀉醇B為代表的生物活性成分受熱后易降解為其他三萜類成分,其降解轉化率和新生成化合物數量與溫度、受熱時間等有密切關系。②藥理活性不僅與指標成分含量有關,還與各成分之間含量比例有關。
為進一步明確市場上澤瀉質量差異大的原因,我們從澤瀉藥材基原、產地、種植技術、原產地加工等藥材生產環節進行探討:
3.1 藥材原植物基原對藥材質量的影響
經李麗霞等在對澤瀉進行本草考證發現,古籍記載了6種澤瀉植物,可考的有5種,1種非澤瀉屬植物,其余4種屬于澤瀉科澤瀉屬植物。根據古籍對澤瀉形態描述對這四種澤瀉進行鑒定,其中2 種鑒定為東方澤瀉Alisma orientale(Sam.)Juzep.,另外2 種分別是小澤瀉Alisma nanum D.F.Cui 和窄葉澤瀉Alisma canaliculatum A.Braun et Bouche.[69]。
目前,市場上流通的商品澤瀉基原的主要有兩個,一種為2015 版《中國藥典》收錄種A.orientale(Sam.)Juz,該種主要分布于福建、江西兩省,市場上稱為“建澤瀉”。另一種為A.plantago-aquatica L.,該種主要分布于四川、云南、貴州等省,市場上稱為“川澤瀉”[70]。
然而,馬曉沖,宋經元等研究發現澤瀉A.plantagoaquatica Linn.與東方澤瀉A.orientale(Sam.)Juzep.二者在外部形態特征區別不明顯,通過經典鑒定方法難以準確鑒定基原。對市售28 種標注東方澤瀉的飲片采用DNA 條形碼SNP 進行鑒別,結果顯示僅有2種飲片為東方澤瀉,其余26種為澤瀉。有研究認為東方澤瀉為“建澤瀉”,而澤瀉為“川澤瀉”[70]。同時有報道[71]稱川澤瀉為市場流通主要品種年產量約占全國產量的70%,“建澤瀉”產量逐年萎縮已經不足全國產量的5%,與澤瀉產量變化呈鮮明對比的是有關澤瀉的研究論文主要以“建澤瀉”A.orientale 為主,極少見“川澤瀉”A.plantago-aquatica.根據這一反常現象可以推測,不僅僅是市場上澤瀉的基原是混亂的,研究澤瀉的科研人員對澤瀉的基原認識也有可能是模糊的。另有研究,將采自福建、江西被鑒定為“建澤瀉”A.orientale 種子和采自四川彭山鑒定為“川澤瀉”A.plantagoaquatica種子,引種到福建建甌,經過三年連續實驗,實驗結果顯示,“建澤瀉”與“川澤瀉”藥材品質仍有顯著性差異,基本保持其在原產地特點[72]。研究結果提示,澤瀉基原對藥材品質有極大的影響。
3.2 藥材產地對澤瀉藥材質量的影響
據中藥材天地網的一份調查顯示,原有“建”、“川”、“江”的格局已經悄然變為“川”、“廣”、“鄂”、“建+江”。傳統澤瀉主產區中除四川仍是澤瀉主產地,福建、江西兩地澤瀉種植面積逐年萎縮。從澤瀉藥材各地產量上來看,市場主流澤瀉品種為“川澤瀉”,僅四川一地產量就占全國總量的70%(約6000 t)。位居第二位的是廣西產“廣澤瀉”,產量約為全國總量的20%。傳統道地產區福建、江西的產量逐年下降,“建澤瀉”的產量已經不足全國總產量的5%。湖北洪湖作為新興澤瀉產區,自2016 年起引種澤瀉,保持3000 畝的種植規模,每年為市場提供約600 t澤瀉[71]。
有研究表明,澤瀉有效成分含量受環境影響較大,在四川不同氣候區域產地的澤瀉在外觀形態、產量、主要有效成分上存在顯著性差異[73]。林月貞等對購于福建、四川、安徽、湖北、江西、陜西、甘肅等7省9家企業的12批次澤瀉(A.orientale)飲片進行特征指紋圖譜和23-乙酰澤瀉醇B的含量分析,發現產地不同澤瀉的外觀、內在質量都有明顯區別[74]。羅尚華等采用1HNMR代謝組學方法,對不同產地的澤瀉進行藥材整體代謝產物差異和質量評價。結果顯示以23-乙酰澤瀉醇B 為評價指標,四川產地最優,顯著高于福建產地。并分析鑒定不同產地澤瀉的4 個主要差異代謝產物,經PLS-DA 分析可將福建、四川、貴州、廣西等四個產地澤瀉藥材明顯區分開來[75]。趙萬里等采用RPHPLC-DAD技術同時測定“建”、“川”共25批澤瀉中11個三萜成分,并用DPS 14.50數據處理軟件分析被測樣品,以11 種指標成分量為變量,結果顯示該方法能夠很好的區分“閩產澤瀉”和“川產澤瀉”[76]。邰艷妮等利用UPLC-MS-MS 法在MRM 模式下對福建、江西和四川三個產地24 批澤瀉中16 種三萜類成分進行含量測定。結果顯示,福建和江西澤瀉中含量最高的是23-乙酰澤瀉醇B,其次是澤瀉醇B。而四川澤瀉中含量最高的是澤瀉醇B,其次是23-乙酰澤瀉醇B。另外,有明確腎毒性報道的澤瀉醇C[77],在四川澤瀉中遠高于江西和福建澤瀉。通過PCA 主成分聚類分析結果可以看出,四川澤瀉明顯區別于福建和江西,福建和江西則較為接近,無法區分[78]。
通過上述文獻可以看出,四川、福建、江西等地澤瀉在成分種類上并無明顯差異,但是在含量比例上具有顯著性差異。另外,廣西、湖北等新興產地藥材相關研究還較少,除廣西澤瀉有少量報道外,湖北澤瀉至今未見質量分析報道。以上情況應當引起研究人員注意。
3.3 產地加工對藥材質量的影響
澤瀉產地加工主要是采挖、洗凈、烘培、脫毛、烘干等工藝流程,各產地大體相似。但在最重要的兩次烘干工藝處理上卻大相徑庭,主要表現為每次烘培的溫度及時間。現有研究表明,澤瀉主要指標性成分23-乙酰澤瀉醇B 為熱不穩定成分,受熱后易發生醚環開環,生成24-乙酰澤瀉醇A,隨著受熱時間延長24-乙酰澤瀉醇A會向23-乙酰澤瀉醇A轉變,亦或是脫掉乙酰基生成澤瀉醇A[79]。由此可見,不同的產地加工工藝勢必導致不同產地藥材主成分比例差異。因此,應當重視原產地加工工藝對藥材中主成分變化的影響,結合現代藥理學、毒理學研究最新成果優化產地加工工藝,以達到藥效顯著、質量穩定可控的目的。
3.4 其他影響因素
國家藥監局在《中藥材生產質量管理規范》(征求意見稿)中指出,種質是中藥材安全、有效和質量控制的物質基礎,應當進行嚴格限定。對人工誘變種和生物技術選育品種等,應通過試驗數據,充分評估風險。然而,現代農業增產技術對中藥材質量影響也不容忽視。如施肥、去薹、去花等一些傳統農業技術手段[80],甚至是生物技術干預植物正常生長狀態,從而提高藥材產量或是提高指標成分含量。有研究表明,栽培藥材與野生藥材在活性成分含量、構成比例上具有顯著性差異,現代農業技術正悄然加大種植藥材與野生藥材的差異。這種差異變化,應當引起管理機構、生產機構、研究機構的重視,以確保藥材質量安全。
4 討論
本文從澤瀉的化學成分、藥理活性,以及澤瀉藥材質量影響因素等方面,論述了目前澤瀉研究質量研究的基本概況。綜述發現,澤瀉活性成分相對單一,且容易受到藥材基原、產地、種植技術、產地加工工藝等因素影響,引起藥材活性成分在含量和組成上的巨大差異。這些影響因素目前還是中藥監管體系的盲區。縱觀我國中藥監管體系始于對中藥飲片加工企業的GMP認證,在此后的藥材飲片倉儲、加工(炮制)、制劑等環節都有嚴格的法律、法規進行監管,這些措施可極大的減少藥材在生產過程中因各種因素導致的質量安全風險。
近期國家藥監局發布《中藥材生產質量管理規范》(征求意見稿)中提出“六個統一”,這一法規的頒布將為從源頭控制中藥材質量提供政策依據。并將與飲片企業GMP認證等一系列監管措施一道,形成全產業鏈的封閉監管體系。
有了監管規范,還應當有監管的具體手段。近年來隨著中藥分析技術的不斷提升,檢測精度也隨之日益精進。本實驗室多年一直秉承著“深入研究,淺出標準”的研究策略,構建多維色譜質譜聯用技術框架體系,將新技術、新方法應用于中藥質量標準研究與建立中,提高了定性、定量分析的整體性、專屬性。通過深入研究中藥材物質基礎、生物活性,通過構建對照圖譜-薄層圖譜、特征圖譜與指紋圖譜,將中藥標準以直觀生動的形式,簡單清晰的展現出來[81]。將上述技術應用于不同基原、不同產地、不同加工工藝等條件下生產的中藥材(澤瀉)質量控制,形成種子(種苗)標準圖譜、原藥材標準圖譜、商品藥材標準圖譜等系列質量控制指紋圖譜,就可能有效的控制市場流通的澤瀉質量。