外周血CD4+CD25+Treg細胞和IL-10水平對復發性流產預測價值
袁惠芝 鄭玉華 馮敏清 謝佳彬

[摘要]目的 探討外周血CD4+CD25+Treg細胞和白細胞介素-10(IL-10)水平對復發性流產(RSA)的預測價值。方法 選取妊娠早期孕婦108例,根據既往病史分為RSA組(50例)和非RSA組(對照組,58例)。檢測并比較兩組病人外周血CD4+CD25+Treg細胞和IL-10水平,繪制ROC曲線并評估上述指標單獨和聯合預測RSA的診斷效能。隨訪20周,比較不同CD4+CD25+Treg細胞和IL-10水平RSA孕婦本次懷孕前28周內再次出現自然流產的情況。結果 RSA組孕婦的CD4+CD25+Treg細胞和IL-10水平均顯著低于對照組(t=-8.034、-10.929,P<0.01)。ROC曲線顯示,CD4+CD25+Treg細胞和IL-10對RSA具有較高的預測效能,其AUC分別為0.856和0.852,差異無統計學意義(P>0.05)。CD4+CD25+Treg細胞和IL-10聯合檢測預測RSA的效能顯著高于各項指標單獨預測(Z=2.557、2.818,P<0.05);Youden指數顯示,CD4+CD25+Treg細胞、IL-10以及二者聯合預測RSA的最佳截點分別為≤6.412%、≤15.118 μg/L和≥0.344。CD4+CD25+Treg細胞和IL-10聯合檢測的靈敏度為94.00%,顯著高于各項指標單獨預測的靈敏度(χ2=5.316、4.332,P<0.05)。隨訪20周,低水平與高水平CD4+CD25+Treg細胞+IL-10的RSA孕婦本次懷孕自然流產的發生率分別為28%和12%,低水平CD4+CD25+Treg細胞+IL-10的RSA孕婦再發自然流產的風險明顯高于高水平CD4+CD25+Treg細胞+IL-10的RSA孕婦,差異有統計學意義(HR=2.611,95%CI=1.085~6.283,P<0.05)。結論 外周血CD4+CD25+Treg細胞和IL-10水平對RSA具有較高預測價值,CD4+CD25+Treg細胞和IL-10聯合檢測可作為預測既往RSA孕婦再發流產的參考指標,低水平CD4+CD25+Treg細胞+IL-10的RSA孕婦流產復發的可能性更大。
[關鍵詞]T淋巴細胞,調節性;白細胞介素10;流產,習慣性;預測價值
[中圖分類號]R714.21
[文獻標志碼]A
[文章編號] 2096-5532(2019)05-0581-05
doi:10.11712/jms201905019
[開放科學(資源服務)標識碼(OSID)]
復發性流產(RSA) 的發病率占育齡期婦女的1%~5%[1-2],其發病機制主要與女方自身免疫應答有關,如果其對帶有男方抗原的胚胎產生免疫攻擊,就會造成母體的流產[3-4]。免疫學研究表明,機體的免疫應答主要是通過CD4+T細胞介導的細胞免疫進行,而Treg可以抑制CD4+T細胞活性,維持機體的免疫平衡[5];同時,白細胞介素-10(IL-10)可以增加Treg活性[6],兩者在機體的免疫調節方面有很重要的作用。但兩者是否對RSA有預測價值尚不明確。本文對108例妊娠早期孕婦進行前瞻性研究,探討外周血CD4+CD25+ Treg細胞和IL-10水平對RSA的預測價值,現將結果報告如下。
1 資料與方法
1.1 一般資料
2017年1月—2018年1月,選取在我院就診的妊娠早期孕婦。納入標準:①妊娠期在10周以內;②年齡28~35歲;③均行外周血染色體檢查。排除標準:①合并有生殖系統感染;②合并生殖系統解剖結構異常;③合并婦科系統腫瘤;④合并心血管、腦、造血系統、腎等重要臟器疾病。共納入108例孕婦,根據既往病史是否存在RSA分為RSA組(50例)和非RSA組(對照組,58例),兩組孕婦一般資料比較差異無統計學意義(P>0.05)。見表1。本研究充分告知病人并經我院倫理委員會審批。
1.2 檢測指標與方法
采集兩組孕婦空腹靜脈血,EDTA-K2抗凝,顛倒混勻,送檢驗科進行檢測。
1.2.1 外周血Treg細胞檢測 分離外周血單個核細胞制成細胞懸液,加入CD4和CD25抗體,避光反應15 min,加入破膜劑破膜,反應30 min后,加入PBS洗滌。離心機離心5 min,去上清,加入10 μL的APC大鼠同型對照抗體。反應30 min后,加入PBS洗滌,使用流式細胞儀測定淋巴細胞亞型。
1.2.2 外周血IL-10水平的檢測 將外周血高速離心后,取上層血清,應用ELISA法測定IL-10水平,所用ELISA試劑盒購自北京義翹神州生物科技有限公司。
1.3 統計學處理
采用SPSS 23.0統計軟件進行數據處理,計量資料結果采用[AKx-D]±s表示,數據間比較采用t檢驗;計數資料采用百分率表示,組間比較采用χ2檢驗。采用受試者工作特征(ROC)曲線評價預測效能,計算曲線下面積(AUC),并應用Youden指數尋找最佳截點。當P<0.05時為差異有統計學意義。
2 結果
2.1 兩組外周血CD4+CD25+Treg細胞和IL-10水平比較
RSA組CD4+CD25+Treg細胞和IL-10水平均顯著低于對照組,差異有顯著意義(t=-8.034、-10.929,P<0.01)。見表2。
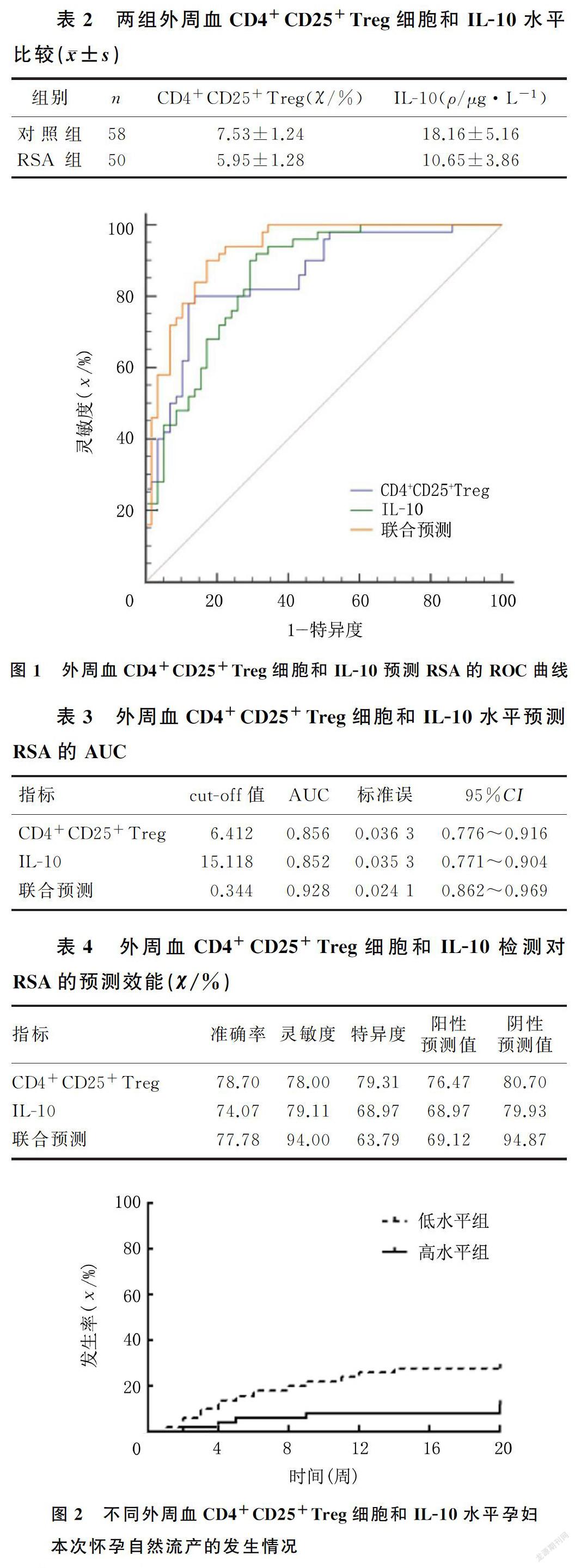
2.2 外周血CD4+CD25+Treg細胞和IL-10表達水平預測RSA的診斷效能
ROC曲線顯示,CD4+CD25+Treg細胞和IL-10預測RSA具有較高的診斷效能,其AUC值分別為0.856和0.852,差異無統計學意義(P>0.05)。CD4+CD25+Treg細胞和IL-10聯合檢測預測RSA的效能顯著高于各項指標的單獨預測(Z=2.557、2.818,P<0.05);Youden指數顯示,CD4+CD25+Treg細胞、IL-10水平和聯合預測RSA的最佳截點分別為≤6.412%,≤15.118 μg/L和≥0.344。見圖1、表3。
2.3 外周血CD4+CD25+Treg細胞和IL-10檢測對RSA的預測效能
外周血CD4+CD25+Treg細胞和IL-10聯合檢測的靈敏度為94.00%,顯著高于各項指標單獨預測的靈敏度(χ2=5.316、4.332,P<0.05)。見表4。
2.4 不同外周血CD4+CD25+Treg細胞和IL-10水平RSA孕婦本次懷孕自然流產的發生情況
低水平CD4+CD25+Treg細胞+IL-10的RSA孕婦、高水平CD4+CD25+Treg細胞+IL-10的RSA孕婦本次懷孕自然流產的發生率分別為28%和12%,低水平CD4+CD25+Treg細胞+IL-10的RSA孕婦再發自然流產的風險明顯高于高水平CD4+CD25+Treg細胞+IL-10的RSA孕婦,差異有統計學意義(HR=2.611,95%CI=1.085~6.283,P<0.05)。見圖2。
3 討論
正常妊娠依賴于母體和胎兒之間的免疫平衡,當母體對胎兒的免疫攻擊增加,就會導致不同類型的流產[7]。RSA在臨床上是一種復雜的病癥,給病人及其家庭造成了巨大的精神壓力[8]。大量研究表明,不明原因的RSA主要與孕婦免疫應答混亂、自身免疫過于亢進、免疫耐受下降相關[9],該類孕婦懷孕成功與否取決于母體對胚胎中攜帶父方的基因是否有足夠的免疫耐受[10]。目前,越來越多的RSA研究集中在CD4+T細胞上,研究發現,RSA病人外周血中的CD4+CD25+Treg細胞水平較低,CD4+CD25+Treg細胞與母體的免疫排斥有著密切的聯系[11];而IL-10對Treg的活性有著很強的激活作用。因此,RSA可能與CD4+CD25+Treg細胞以及IL-10有關[12-13]。如果能在孕早期找到預測RSA的臨床免疫指標,可以為臨床早期診斷RSA并盡早采取預防措施提供參考,從而降低流產率,提高懷孕成功率。
CD4+CD25+Treg細胞是CD4+T細胞中的一個亞型,該類細胞通過產生細胞毒性作用,導致免疫損傷,同時,CD4+CD25+Treg細胞可以抑制IL-2基因在CD4+和CD8+細胞中的轉錄和翻譯,從而抑制CD4+和CD8+兩類細胞的增殖和活性。因此,其主要作用為維持機體的免疫耐受,對全身免疫功能的正常運行起著重要的作用[14-16]。IL-10對CD4+CD25+Treg細胞活性的增強以及轉化起著重要的作用[17],大量的研究結果表明,婦女孕期中IL-10的水平會升高,CD4+CD25+Treg細胞表面的IL-10本次懷孕自然流產的發生情況受體增多,使CD4+CD25+Treg細胞更易被IL-10所活化;同時,CD4+CD25+Treg細胞會進一步分泌IL-10[18-20]。IL-10可以使Th17細胞轉化為CD4+CD25+Treg細胞,增加其在外周血中的細胞密度[21]。可見,IL-10和CD4+CD25+Treg細胞兩者互相促進,協同作用,共同維持機體的免疫穩定。
IL-10和CD4+CD25+Treg細胞水平越高,其對CD4+T細胞免疫功能的抑制就越強,母體對胚胎的免疫攻擊越弱,從而使母體和胎兒達到一定程度的免疫穩態[22-24]。在本研究中,RSA組CD4+CD25+Treg細胞和IL-10水平顯著低于對照組,提示低水平CD4+CD25+Treg細胞+IL-10與RSA有一定關系,這與相關研究結果一致[25]。RSA病人常存在染色體異常,導致IL-10及CD4+CD25+Treg細胞水平降低,機體免疫功能紊亂,對CD4+T細胞免疫功能的抑制強度下降,使機體的自身免疫功能增加[26]。而胚胎作為一種攜帶有父方基因的外來組織,首當其沖受到母體的免疫攻擊,造成流產[27]。同時,免疫記憶功能使機體對胚胎的免疫攻擊效應持續存在,導致孕婦出現反復流產[28]。
此外,本文ROC曲線分析顯示,CD4+CD25+Treg細胞和IL-10對RSA有較高的預測效能,且聯合檢測對RSA的預測效能及靈敏度均顯著高于兩項指標單獨預測,提示CD4+CD25+Treg細胞和IL-10對RSA有著較好的預測價值,聯合檢測能提高RSA的預測能力,這與國外相關學者研究結果一致[29]。CD4+CD25+Treg細胞和IL-10在維持機體的免疫耐受過程中發揮協同作用[30],因此兩種指標聯合檢測對預測RSA有重要意義。本研究的意義在于為RSA預測提供了更多指標,幫助病人盡早采取保護措施。
綜上所述,外周血CD4+CD25+Treg細胞和IL-10水平檢測對RSA具有較高預測價值,而CD4+CD25+Treg細胞和IL-10聯合檢測可作為預測既往RSA孕婦再發流產的參考指標,低水平CD4+CD25+Treg細胞+IL-10的RSA孕婦流產復發的可能性更大。
[參考文獻]
[1]MAHDAVIPOUR M, ZAREI S, FATEMI R, et al. Polymorphisms in the estrogen receptor beta gene and the risk of unexplained recurrent spontaneous abortion[J]. Avicenna Journal of Medical Biotechnology, 2017,9(3):150-154.
[2]李維宏,牟曉玲. 黃體酮保胎治療對不明原因復發性流產患者外周血輔助性T淋巴細胞17/調節性T淋巴細胞免疫失衡的影響研究[J]. 中國全科醫學, 2015,18(36):4444-4449.
[3]LIU Zhilan, XU Haijing, KANG Xiaomin, et al. Allogenic lymphocyte immunotherapy for unexplained recurrent spontaneous abortion: a Meta-analysis[J]. American Journal of Reproductive Immunology (New York, N.Y.:1989), 2016,76(6):443-453.
[4]ZONG Shanshan, LI Chunqing, LUO Chengfeng, et al. Dysregulated expression of IDO may cause unexplained recurrent spontaneous abortion through suppression of trophoblast cell proliferation and migration[J]. Scientific Reports, 2016,6(4):81-85.
[5]KAUR R, GUPTA K. Endocrine dysfunction and recurrent spontaneous abortion: an overview[J]. International Journal of Applied & Basic Medical Research, 2016,6(2):79-83.
[6]林其德,汪希鵬. 婦產科學新進展——原因不明復發性流產的病因病理生理機制與治療研究進展[J]. 中國實用婦科與產科雜志, 2017,23(1):5-8.
[7]肖世金,趙愛民. 復發性流產病因學研究進展[J]. 中國實用婦科與產科雜志, 2014,30(1):41-45.
[8]QIN W, TANG Y, TANG L, et al. Potential role of circula-ting microRNAs as a biomarker for unexplained recurrent spontaneous abortion[J]. American Journal of Reproductive Immunology, 2013,70(1, SI):22-23.
[9]ARJMAND F, GHASEMI N, MIRGHANIZADEH S A. The balance of the immune system between HLA-G and NK cells in unexplained recurrent spontaneous abortion and polymorphisms analysis[J]. Immunologic Research, 2016,64(3):785-790.
[10]TUNC E, TANRIVERDI N, DEMIRHAN O, et al. Chromosomal analyses of 1 510 couples who have experienced recurrent spontaneous abortions[J]. Reproductive BioMedicine Online, 2016,32(4):414-419.
[11]PEREZA N, OSTOJIC S, KAPOVIC M, et al. Systematic review and meta-analysis of genetic association studies in idiopathic recurrent spontaneous abortion[J]. Fertility and Sterility, 2017,107(1):150.
[12]HOSSEINI S, SHOKRI F, POUR S A, et al. A shift in the balance of T17 and Treg cells in menstrual blood of women with unexplained recurrent spontaneous abortion[J]. Journal of Reproductive Immunology, 2016,116(23):13-22.
[13]PEREZA N, OSTOJIC S, ZDRAVCEVIC M, et al. Insertion/deletion polymorphism in intron 16 of ACE gene in idiopathic recurrent spontaneous abortion: case-control study, systema-tic review and meta-analysis[J]. Reproductive BioMedicine Online, 2016,32(2):237-246.
[14]DONG Xiujuan, YANG Long, WANG Hui. miR-520 promotes DNA-damage-induced trophoblast cell apoptosis by targeting PARP1 in recurrent spontaneous abortion (RSA)[J]. Gynecological Endocrinology, 2017,33(4):274-278.
[15]DAKHLY D M, BAYOUMI Y A, SHARKAWY M A, et al. Intralipid supplementation in women with recurrent sponta-neous abortion and elevated levels of natural killer cells[J]. In-ternational Journal of Gynecology & Obstetrics, 2016,135(3):324-327.
[16]FOTOOHI M, GHASEMI N, MIRGHANIZADEH S A, et al. Association between HLA-E gene polymorphism and unexplained recurrent spontaneous abortion(RSA)in Iranian women[J].
Int J Reprod Biomed (Yazd), 2016,14(7):477-482.
[17]SABOORI S, NOORMOHAMMADI Z, ZARE-KARIZI S. Genetic variation in vascular endothelial growth factor gene and its association with recurrent spontaneous abortion[J]. Bratislava Medical Journal-Bratislavske Lekarske Listy, 2016,117(2):80-86.
[18]YE L Y, GOODALL J C, ZHANG L B, et al. TCR usage, gene expression and function of two distinct FOXP3(+) Treg subsets within CD4(+)CD25(hi) T cells identified by expression of CD39 and CD45 RO[J]. Immunology and Cell Biology, 2016,94(3):293-305.
[19]TALEBI A R, FESAHAT F, MANGOLI E A, et al. Relationship between sperm protamine deficiency and apoptosis in couples with unexplained repeated spontaneous abortions[J]. International Journal of Reproductive Biomedicine, 2016,14(3):199-204.
[20]HOMBACH A A, ABKEN H. Most do,but Some do not:CD4+CD25+T cells, but not CD4+CD25+Treg cells,are cytolytic when redirected by a chimeric antigen receptor (CAR)[J]. Cancers, 2017,9(9):112-115.
[21]SCHNEIDER M, MEISTER M, MULEY T. Glycodelin as diagnostic and prognostic marker and for monitoring treatment of lung diseases[J]. Pan African Medical Journal, 2016,23(2):13-16.
[22]GRYGOROWICZ M A, BORYCKA I S, NOWAK E A, et al. Lenalidomide potentiates CD4(+)CD25(+) Treg-related suppression of lymphoma B-cell proliferation[J]. Clinical and Experimental Medicine, 2017,17(2):193-207.
[23]KRONBICHLER A, BREZINA B, QUINTANA L F, et al. Efficacy of plasma exchange and immunoadsorption in systemic lupus erythematosus and antiphospholipid syndrome: a systematic review[J]. Autoimmunity Reviews, 2016,15(1):38-49.
[24]MOTEDAYYEN H, REZAEI A, ZARNANI A. Human amniotic epithelial cells inhibit activation and pro-inflammatory cytokines production of naive CD4+T cells from women with unexplained recurrent spontaneous abortion[J]. Reproductive Biology, 2018,18(2):182-188.
[25]ARRANZ-SOLIS D, BENAVIDES J, REGIDOR-CERRILLO J, et al. Systemic and local immune responses in sheep after Neospora caninum experimental infection at early, mid and late gestation[J]. Veterinary Research, 2016,47(1):2-4.
[26]LOMBARDELLI L, LOGIODICE F, AGUERRE G M, et al. Interleukin-17-producing decidual CD4+T cells are not deleterious for human pregnancy when they also produce interleukin-4[J]. Clinical&Molecular Allergy, 2016,14(1):1-5.
[27]HOFFMAN R M, BRUMMEL S S, BRITTO P, et al. Adverse pregnancy outcomes among women who conceive on antiretroviral therapy: clinical infectious diseases an official publication of the infectious diseases[J]. Society of America, 2018,45(2):24-26.
[28]HADDAD L B, WALL K M, MEHTA C, et al. Trends of and factors associated with live-birth and abortion rates among HIV-positive and HIV-negative women[J]. American Journal of Obstetrics and Gynecology, 2017,216(1):89-92.
[29]ARMEL P, ARSNE H, AINA K, et al. Pregnancy rate and birth outcomes among women receiving antiretroviral therapy in Burkina Faso: a retrospective cohort study[J]. Pan African Medical Journal, 2016,24(3):67-71.
[30]CHRISTIANSEN O B, KOLTE A M, LARSEN E C, et al. Immunological causes of recurrent pregnancy loss[J]. Springer International Publishing, 2016,5(2):11-14.
(本文編輯 黃建鄉)

