氧化葡萄糖酸桿菌中硫辛酸合成模塊對維生素C一步混菌發酵的影響
劉宇,王恩旭,潘才惠,董秀濤,丁明珠
氧化葡萄糖酸桿菌中硫辛酸合成模塊對維生素C一步混菌發酵的影響
劉宇1,2,王恩旭1,2,潘才惠1,2,董秀濤1,2,丁明珠1,2
1 天津大學 化工學院 教育部合成生物學前沿科學中心系統生物工程教育部重點實驗室,天津 300072 2 天津大學 天津化學化工協同創新中心,天津 300072
在由氧化葡萄糖酸桿菌和普通生酮古龍酸桿菌構建的維生素C兩菌一步發酵體系中,為了強化氧化葡萄糖酸桿菌對普通生酮古龍酸桿菌生長和產酸的促進作用,文中在氧化葡萄糖酸桿菌中構建硫辛酸合成功能模塊。由含硫辛酸功能模塊的氧化葡萄糖酸桿菌和普通生酮古龍酸桿菌組成的兩菌一步體系,能減輕普通生酮古龍酸桿菌單菌培養時的生長抑制,強化兩菌的互作關系,使維生素C前體(2-酮基-L-古龍酸,2-KGA)的產量提高到73.34 g/L(對照組為59.09 g/L),醇酸轉化率提高到86.0%。研究結果為進一步優化維生素C兩菌一步發酵體系提供了新思路。
一步發酵,氧化葡萄糖酸桿菌,普通生酮古龍酸桿菌,硫辛酸
維生素C作為一種高效的抗氧化劑有著異乎尋常的作用,甚至對腫瘤細胞有抑制作用[1-2]。現今為止,工業生產中主要采用“微生物二步發酵法”生產維生素C[3]。然而,在第二步發酵中,普通生酮古龍酸桿菌 (,小菌) 作為產酸菌單獨生長長勢很弱,需要依靠芽孢桿菌屬spp.等伴生菌株維持其良好的生長狀態和生產效率。關于伴生菌是如何促進小菌生長與產酸的研究,國內外學者都很關注。例如,基于系統生物學和生物信息學分析揭示了兩菌間相互作用機理[4-7],從小菌生長受到氧化脅迫以及伴生菌解除小菌氧化脅迫等方面進行解析等[8-11]。這些研究都為進一步提高維生素C產量和解析微生物混菌間相互作用方式提供了巨大支持。基于響應面法和遺傳算法優化的人工神經網絡兩種優化模型,Yang等[12]優化了生產2-KGA的混菌發酵培養基成分,將2-KGA產量提高到71.21 g/L。Wang等[13]基于簡化的代謝途徑構建了.的宏觀動力學模型,并將反應速率耦合到生物反應器模型中,揭示了混合培養物中.和巨大芽孢桿菌兩種微生物的生長動力學。Zhang等[14]通過引入種群理論在宏觀上模擬了.和.這兩種菌株的相互作用,發現這兩種菌株之間的相互作用類型偏向捕食關系。.是捕食者,.是被捕食者。Zhu等[15]的研究表明.菌株中孢子的形成和孢子的穩定性對2-KGA的生物合成有著關鍵作用。此外,Liu等[16]通過多階段控制策略,向.發酵培養基中添加.的細胞內裂解物和細胞外培養液,發現適量的.細胞內裂解物和細胞外培養液確實促進了.的生長和2-KGA的產生,進一步揭示了芽孢桿菌在生物合成2-KGA的過程中發揮著重要的伴生作用。
然而,常用的伴生菌株多為某芽孢桿菌屬,其部分菌株會與主要的小菌或者一步菌存在競爭效應,如植物內生芽孢桿菌含有代謝L-山梨醇的基因,會與氧化葡萄糖酸桿菌競爭代謝底物[17],導致最終醇酸轉化率的降低。所以,如果能找到一種伴生菌,既可以促進小菌的生長和產酸,又可以消滅菌株間的競爭效應,將極具應用價值。本課題組在前期的研究中,嘗試構建由.和.組成的兩菌體系來實現維生素C一步發酵,因.含代謝山梨糖的相關基因,為了消除.與.的競爭效應,將.中與山梨糖代謝相關的脫氫酶進行單基因和雙基因的敲除。研究結果表明,敲除基因的.確實對.的生長和產酸有一定的促進作用[18]。基于傳統二步發酵法,Gao等[19]通過基因工程的手段,將.中與 2-酮基-L-古龍酸 (2-KGA) 合成相關的關鍵酶基因,例如山梨糖和山梨酮脫氫酶基因,以不同的組合方式構建到.菌中,在工程菌.中實現了以山梨醇為底物合成2-KGA的單菌一步發酵,2-KGA產量達4.9 g/L。D-葡萄糖是常用原料里最價廉易得的,而不管是傳統二步發酵法還是改進后的一步發酵法的最大的缺陷是未能以D-葡萄糖為生產原料。Anderson等[20]發明了一種以D-葡萄糖為原料實現2-KGA的生物合成方法。該方法通過歐文氏菌sp.將D-葡萄糖轉化為2,5-二酮基-D-葡萄糖酸 (2,5-KDG),然后再經棒桿菌sp.轉化為2-KGA,在10 L的發酵罐上總轉化率可達84.6%。雖然該方法有著很好的應用前景,但中間產物2,5-KDG的不穩定性使得該技術難以推廣運用,所以通過山梨醇、山梨糖和山梨酮脫氫酶生產2-KGA依然是最優化的方法。
研究表明,某些氨基酸、葉酸、還原型谷胱甘肽等單一物質的添加有助于產酸菌的生長和產酸[21-24]。另外,吡咯喹啉醌 (Pyrroloquinoline quinone,PQQ) 作為一種輔酶在山梨醇脫氫過程中起到了重要的作用。杜等[25]研究發現,在生產2-KGA所涉及的菌種中,不僅.菌中山梨醇脫氫酶的表達需要以PQQ為輔酶[26],.菌中的山梨糖和山梨酮脫氫酶的表達也需要以PQQ為輔酶。關于上述結論的前一部分,Miyazaki等[27]在大腸桿菌中也得到了同樣的結果,表明導入來源于.的山梨醇脫氫酶確實是輔酶PQQ依賴性酶。所以輔酶PQQ在2-KGA的生產過程中有著重要的輔助作用。隨著生物技術的發展,越來越多的基因代謝模型被構建分析出來[28]以及全基因組測序信息的公開[29],為研究者們進一步設計和構建更高效的工程化菌株提供了理論基礎。
硫辛酸 (Alpha lipoic acid) 作為丙酮酸脫氫酶系的六大輔因子之一[30],先被還原為二氫硫辛酸,隨后在二氫硫辛酸脫氫酶作用下脫氫為氧化型。丙酮酸脫氫酶系由丙酮酸脫氫酶 (Pyruvate decarboxynase,E1)、二氫硫辛酸乙酰基轉移酶 (Dihydrolipoamide acetyltransferase,E2)、二氫硫辛酸脫氫酶 (Dihydrolipoamide dehydrogenase,E3) 三種酶組成。二氫硫辛酸作為一種強還原劑,能夠再生被氧化了的抗氧化劑,如抗壞血酸鹽、谷胱甘肽、輔酶Q和維生素E等,從而參與細胞內多種氧化還原反應[31-32]。硫辛酸的生物合成有兩條路徑,一是通過脂肪酸合成路徑的分支進行,二是辛酸從頭合成。兩條路徑合成的輔酶硫辛酸最終都結合在二氫硫辛酸乙酰基轉移酶 (E2) 和甘氨酸剪切系統H蛋白 (Glycine cleavage system protein H) 上,進而發揮輔酶作用[33]。其中,脂肪酸合成路徑又可通過兩條線路合成輔酶硫辛酸,本研究按照辛酰-酰基載體蛋白先經硫辛酰基合成酶 (LipA) 催化后,再經硫辛酰基轉移酶 (LipB) 催化合成輔酶硫辛酸這一路徑進行實驗設計。因此,本研究通過在.中構建硫辛酸功能模塊,強化.和.組成的以D-山梨醇為底物的維生素C兩菌一步發酵體系,以期提高兩菌一步發酵體系的醇酸轉化率以及減少伴生菌的競爭效應。
1 材料與方法
1.1 菌株
本實驗使用的菌株:一步菌:氧化葡萄糖酸桿菌H24;小菌:普通生酮古龍酸桿菌;均由華北制藥集團饋贈。
1.2 培養基與培養條件
1.2.1 培養基
.種子培養基成分:D-山梨醇2%,酵母浸粉0.3%,牛肉膏0.3%,玉米漿0.6%,尿素0.1%,蛋白胨1%,KH2PO40.1%,MgSO40.02%,CaCO30.1%。pH 7.0,121 ℃滅菌20 min。.搖瓶單菌發酵培養使用以及混菌搖瓶發酵培養使用。
.種子培養基成分:L-山梨糖2%,酵母浸粉0.3%,牛肉膏0.3%,玉米漿0.6%,尿素0.1%,蛋白胨1%,KH2PO40.1%,MgSO40.02%,CaCO30.1%。pH 7.0,121 ℃滅菌20 min。其中L-山梨糖單獨滅菌。.搖瓶單菌發酵培養使用。
發酵罐培養基成分:D-山梨醇8%,玉米漿1%,KH2PO40.1%,MgSO40.02%,CaCO30.1%,尿素1.2%,pH 7.0。121 ℃滅菌20 min。
1.2.2 培養條件
種子培養:一級種子培養,取300 μL甘油菌加入50 mL搖瓶培養基中,將其放入30 ℃、250 r/min搖床。.振蕩培養24 h,.振蕩培養48 h。二級種子培養,取一級種子5 mL (10%的接種量) 至50 mL搖瓶培養基中,將其放入30 ℃、250 r/min搖床。.振蕩培養24 h,.振蕩培養48 h。
搖瓶發酵培養:按10%接種量將一定二級種子液接入50 mL搖瓶發酵液中,將其置于30 ℃、250 r/min的搖床振蕩培養。.單菌搖瓶發酵32 h左右,.單菌搖瓶發酵30 h左右。.和.混菌搖瓶發酵48 h左右。
發酵罐培養:按10%的接種量 (300 mL) 將一定二級種子液接入到5 L的發酵罐中,總裝液量為3 L,其中包括2.7 L (含240 g D-山梨醇) 的發酵罐培養基,大約發酵48 h左右。設定發酵罐溫度為30 ℃,pH值調至7.0,空氣流量設定為1.5 vvm,轉速設置500 r/min,補料時間設置為接菌3 h后開始連續恒速流加,補料速度為每25 s補1 s,補料為120 g D-山梨醇,補料量為500 mL。
1.3 G. oxydans和K. vulgare的單菌搖瓶生長檢測
光密度法:取1 mL發酵液,在高速離心機中,12 000 r/min離心3 min,將上清移除干凈,同時向保留的細胞沉淀中加入1 mL 0.1 mol/L的HCl,吹吸振蕩均勻,12 000 r/min離心3 min,倒上清,得到除去碳酸鈣的細胞沉淀。取1 mL ddH2O重懸細胞沉淀,根據菌株實際生長情況進行稀釋,最后使用紫外可見分光光度計測定菌液在波長600 nm處的吸光度,記作600。
1.4 2-KGA的測定
取1 mL發酵液,在高速離心機中,12 000 r/min離心3 min,將上清轉移至新的1.5 mL EP管中,根據實際情況用流動相 (0.5 mmol/L H2SO4) 稀釋上清液,用高效液相色譜法測定2-KGA的含量。液相設備:泵的型號為Waters 2695,示差檢測器為Waters 2414,色譜柱為Bio-Rad HPX-87H;運行條件:檢測器溫度50 ℃,柱溫65 ℃,流速0.6 mL/min。
1.5 G. oxydans感受態細胞的制備和電轉化
將.甘油菌經活化后,接種于固體平板,培養16?20 h;收集全部細胞于50 mL離心管中,迅速冰浴30 min;4 ℃、4 500 r/min離心10 min,棄去上清;然后,先用10 mL預冷的10%甘油洗細胞2次,再用0.5 mL預冷的10%甘油重懸細胞,分裝現用或凍存于–80 ℃冰箱。在冰浴條件下,每50 μL.感受態細胞中加入5–10 μL目的質粒,待目的質粒與細胞充分接觸后轉移至冰浴的電轉杯中;設定電轉條件:電壓1.8 kV,電擊時間4?6 ms為正常,電擊后在無菌條件下迅速加入1 mL無抗種子培養基進行細胞復蘇;置于搖床中 (30 ℃、180 r/min) 培養3–4 h,在低速離心機中,4 500 r/min離心1 min,倒掉多余上清,將剩100 μL左右的菌液重懸并涂布于含慶大霉素 () 抗性的固體種子培養基上,置于30 ℃培養箱中培養1–2 d獲得轉化子。
1.6 混菌體系中G. oxydans和K. vulgare菌體數量的測定
利用熒光定量PCR計數法測定混菌體系中.和.的群體數量。利用TIANGEN的細菌基因組DNA提取試劑盒 (離心柱型),進行基因組提取,并以此為DNA模板。
根據.和.基因組中16S rDNA序列設計引物,分別為.F:5?-AAT GCCAGTCGTCAGGTTGCTT-3?,R:5?-CTAGGC CGGTCCTGTAATGTCA-3?;.:F:5?-GG AAACTGGAGCTAATACCG-3?,R:5?-GCTGATC ATCCTCTCAAACC-3?。
利用TIANGEN的RealMaster Mix (SYBR Green) 試劑盒進行熒光定量PCR。PCR反應總體系為20 μL,其中包括DNA模板2 μL,10 μmol/L上下引物各0.4 μL,RealMaster Mix/SYBR Solution混合緩沖液 9 μL,加超純水補齊至20 μL。反應程序設定為:94 ℃,2 min;94 ℃,20 s;(m+2 ℃),30 s;68 ℃,30 s,40個循環。溶解曲線:95 ℃,5 s;60 ℃,1 min;40 ℃,30 s。
1.7 G. oxydans菌株中相關基因轉錄水平的測定
采用SYBR Green熒光定量PCR方法檢測.菌株中相關基因的相對表達水平。樣品為搖瓶發酵28 h時離心收集的菌體,并用液氮速凍。采用TIANGEN的RNAprep pure培養細胞/細菌總RNA提取試劑盒提取樣本RNA,具體操作按產品說明書進行。采用Roche公司的Transcriptor First Strand cDNA Synthesis Kit進行cDNA反轉錄,操作詳見產品說明書。采用TransGen公司的Top Green qPCR SuperMix進行qPCR反應,操作詳見產品說明書的兩步法。內參基因選用16S rRNA,每個樣品重復3次。采用2–??Ct法計算目的基因的相對表達量[34]。
2 結果與分析
2.1 外加硫辛酸對普通生酮古龍酸桿菌發酵的影響
目前,在2-KGA的生產過程中,.因其生長缺陷而導致單獨培養困難,很多研究都在嘗試通過添加外源物質提高其生長能力。本研究首先嘗試將硫辛酸作為外源因子添加,驗證其對普通生酮古龍酸桿菌單菌以及在兩菌一步發酵體系中生長和產酸的影響。
2.1.1 外加硫辛酸對普通生酮古龍酸桿菌單菌發酵的影響
為了驗證外加硫辛酸對.單菌生長和產酸的影響,在種子培養基中添加經過濾除菌得到的終濃度為0.64 mg/L硫辛酸[35]進行.單菌搖瓶發酵的培養測定發酵過程中細胞密度 (600值) 的變化(圖1A)以及胞外2-KGA的積累 (圖1B)。根據發酵結果,我們發現外加硫辛酸對.的生長具有明顯的促進作用,但是對2-KGA產量的提高卻十分有限。
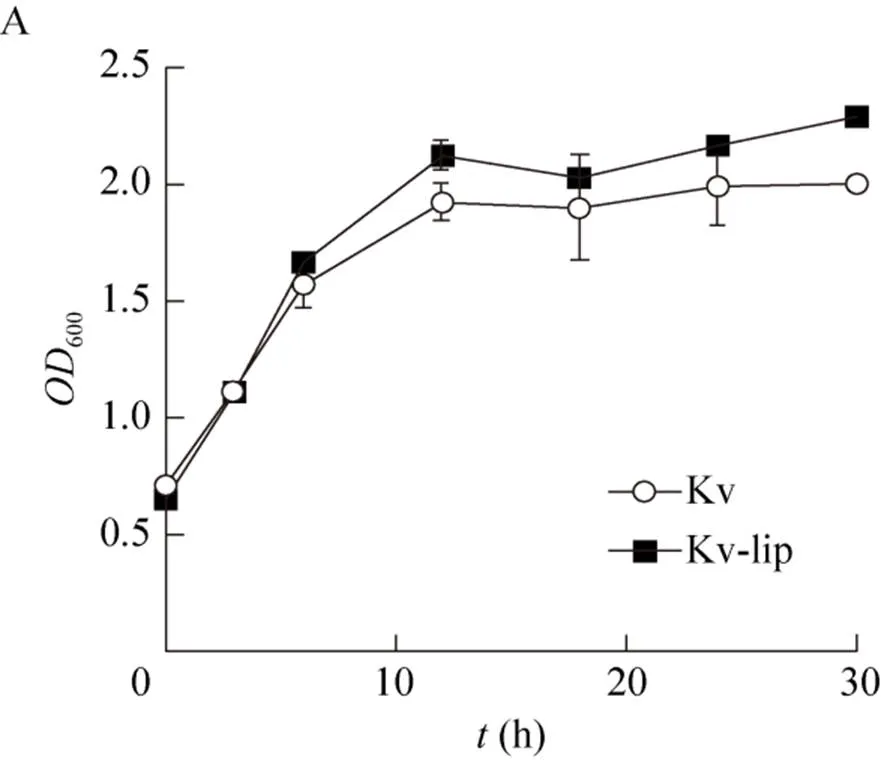
在搖瓶中發酵培養30 h后,實驗組Kv-lip的值達到2.29,相比與對照組Kv的值 (2.00) 提高了12.7%;而實驗組胞外2-KGA的濃度為6.84 g/L,較對照組僅提高了4.17%。上述結果表明,外加硫辛酸因促進了.的細胞生長,從而促進了.生產2-KGA的能力;然而,因沒有伴生菌配合的情況下以及搖瓶發酵本身限制限速過多,從而導致2-KGA含量提升有限。
2.1.2 外加硫辛酸對兩菌一步發酵生產2-KGA的影響
隨后,我們探究了外加硫辛酸對由.和.組成的兩菌一步發酵生產2-KGA的影響。參照實驗室原有的工藝條件,接菌比例.∶.為1∶4 (體積比) 的條件下,在一步發酵種子培養基中添加終濃度為0.5、1.0、2.0和4.0 mg/L的硫辛酸,以未加硫辛酸為空白對照,測定該混菌發酵體系中2-KGA的產量 (圖2)。由圖2可知,在相同條件下,其中外加1.0 mg/L硫辛酸對混菌體系的產酸達到了12.6 g/L,相比于原始體系的11.2 g/L,提高了11.1%。說明外加適當濃度的硫辛酸確實對一步發酵混菌體系的產酸具有明顯的促進作用。我們推測,由于一步發酵過程中多了.菌的配合,.菌的存在對.菌的生長和產酸產生了積極影響,從而導致外加適當濃度的硫辛酸對一步發酵混菌體系生長和產酸的促進作用比對.單菌而言有明顯提升。

圖2 外加硫辛酸對一步發酵混菌體系的影響
2.2 氧化葡萄糖酸桿菌中硫辛酸功能模塊的構建和驗證
硫辛酸功能模塊的構建過程如圖3A所示。以.基因組為模板,擴增常用強啟動子以及硫辛酸合成途徑中兩個關鍵酶的基因(EC=2.8.1.8)和(EC=2.3.1.181)并利用重疊延伸PCR (OE PCR) 的方法將三者拼接;然后,用帶d Ⅲ的上引物和帶RⅠ的下引物進行目標片段克隆,最后通過酶切連接的方式 (RⅠ/d Ⅲ) 構建到廣宿主游離質粒pBBR1MCS-5上,構成了完整合成途徑的d Ⅲ--RⅠ模塊 (lipAB模塊),該模塊的構建質粒如圖3B所示。該過程在中間宿主.DH5α中完成的,隨后將重構好的質粒經電轉導入到.H24中。在含的固體平板上篩選轉化子,提取相應的質粒進行Ⅰ單酶切和Ⅰ/Ⅰ雙酶切驗證 (圖3C) 后測序得到相應正確的工程化.H24菌株。
2.3 硫辛酸功能模塊效果驗證
2.3.1 發酵罐中不同接菌比例條件的探究
在混菌發酵中,接菌比例的確定對研究結果非常重要。在不同接種比例的條件下,發酵結果存在著顯著的差異。為了探究.和.在發酵罐水平的最適接種比例,本研究設定了5種不同的比例 (體積比),.∶.分別為1∶4、1∶2、2∶1、4∶1和8∶1。發酵結果如圖4A所示,可以看出不同的接菌比例對最終的發酵結果有著顯著的影響。同時,根據現有結果推測,利用.和.在發酵罐水平實現一步混菌發酵的最適接菌比例為4∶1 (.∶.)。

圖3 硫辛酸合成模塊構建及驗證圖
2.3.2 硫辛酸功能模塊的驗證
在確定最適比例后,將構建的工程菌株與產酸菌以及原始菌株與產酸菌組成兩組混菌體系,分別為LipAB組 (實驗組) 和Go組 (對照組)。在接種最優比例4∶1 (.∶.) 的條件下,驗證硫辛酸功能模塊對混菌發酵罐發酵的影響。
由圖4B可以證明導入硫辛酸功能模塊的.菌株對一步混菌發酵體系的產酸具有明顯促進作用。在相同的發酵罐條件下,表達硫辛酸功能模塊的LipAB組的產酸量達到了73.34 g/L,相比較于Go組的產量59.09 g/L,增長了19.43%。基于上述兩種混菌體系的發酵罐產酸結果,我們進一步探究了LipAB組與Go組兩組混菌體系中菌群數量變化。利用熒光定量PCR的方法對發酵過程中不同取樣點的兩菌菌數進行測定,如圖4C所示,在發酵前期 (0–14 h).在Go+Kv體系和在Go-LipAB+Kv體系的生長狀態相似,群體數量有輕微下降的趨勢;從14 h開始,.在Go+Kv體系的生長要明顯優于在Go-LipAB+Kv體系的生長。在32 h時,.在Go-LipAB+Kv體系的群體密度達到了 (4.32±0.13)×1010CFU/mL,約為.在Go+Kv體系群體密度的2.29倍。上述結果表明,在由Go-LipAB和.組成的兩菌一步發酵體系中,Go-LipAB不僅促進了.的產酸,還促進了.的生長。我們推測,在.菌株中生成的輔酶硫辛酸可能與二氫硫辛酸乙酰基轉移酶 (E2) 或甘氨酸剪切系統H蛋白結合發揮了作用,刺激了丙酮酸脫酸生成乙酰輔酶A,增加了.代謝中的相關酶活力,從而增強了.的生長和產酸[36]。同時,依據 圖4B的變化趨勢,我們可以看出,導入硫辛酸功能模塊的.在提升混菌發酵體系產酸量的同時,也改變了混菌體系的發酵周期。從圖4B中的趨勢可知,盡管LipAB組最終的產酸量較高,但實驗的發酵周期長,在36 h左右才結束發酵,相比較于Go組在28 h左右結束,延遲了8 h。此外,LipAB組的靜止期較長,開始發酵產酸的時間較晚。我們推測,導入硫辛酸功能模塊雖然提升了一步菌輔助產酸菌生長和產酸的能力,但同時,功能模塊本身加重了.菌株的生長負擔。如圖4D所示,在0–12 h,.在Go+Kv體系和在Go-LipAB+Kv體系的生長狀態基本一致;然而,從12 h后,.在Go+Kv體系的生長要明顯優于在Go-LipAB+Kv體系的生長。在32 h時,導入硫辛酸功能模塊的.菌株在Go-LipAB+Kv體系的菌體密度比原始.菌株在Go+Kv的菌體密度低22.4%。此外,還在.單菌搖瓶發酵中得到了相似的結果,驗證了我們的推測,如圖4E所示,在2% D-山梨醇條件下,與LipAB組相比,發酵結束時,對照組中.單菌搖瓶生長的600是導入硫辛酸功能模塊LipAB組的1.44倍。綜上所述,在其他培養條件一致的情況下,導入硫辛酸功能模塊的.菌株無論是單菌搖瓶發酵,還是與.組成的兩菌一步混菌發酵,均加重了.菌株自身的生長負擔;根據文獻報道[37],硫辛酸合成會消耗一部分總細胞脂肪酸合成能力,這也可能是影響.菌株生長的另一原因。因此,以上兩種情況均可造成LipAB組發酵周期的延長。此外,LipAB組靜止期較長可能與發酵前期.的數量有關,因為此時間段.的數量有輕微下降的趨勢。

圖4 硫辛酸功能模塊的驗證
2.3.3 硫辛酸功能模塊在轉錄水平上的驗證
從2.3.2的結果可知,導入硫辛酸功能模塊的.菌株確實在混菌發酵產酸方面表現出明顯的優勢,于是進行了更深層次的探究。在生物體內,辛酰-酰基載體蛋白通過硫辛酰基合成酶 (LipA) 催化后,再由硫辛酰基轉移酶 (LipB) 催化合成輔酶硫辛酸。隨后,合成的硫辛酸通過結合在二氫硫辛酸乙酰基轉移酶 (E2) 以及甘氨酸剪切系統H蛋白上,進而發揮輔酶作用[33]。因此,首先將原始.菌株 (Go) 和導入的硫辛酸功能模塊的.菌株 (Go-LipAB)進行單菌發酵培養,取發酵時間28 h的樣品進行相關基因的轉錄水平的探究,包括與硫辛酸合成相關的LipA和LipB,以及以硫辛酸為輔酶發揮作用的二氫硫辛酸乙酰基轉移酶 (E2) 和甘氨酸剪切系統H蛋白。如圖5所示,與硫辛酸合成相關的硫辛酰基合成酶 (LipA) 和硫辛酰基轉移酶 (LipB) 在導入硫辛酸功能模塊.菌株的表達量分別是原始.菌株的2.27倍和2.99倍。此外,以硫辛酸為輔酶發揮作用的二氫硫辛酸乙酰基轉移酶 (E2) 的表達量是原始.菌株的1.95倍,甘氨酸剪切系統H蛋白是原始菌株的2.31倍。可以看出,與硫辛酸功能模塊相關的基因均有一定程度的上調。因此,我們推測由于硫辛酸功能模塊在.菌株的表達,從而促進了以硫辛酸為輔酶的蛋白的表達,因而在混菌發酵產酸時表現出明顯的優勢。

圖5 在G. oxydans中探究與硫辛酸合成和功能相關基因的表達水平
3 結論
本研究首次在維生素C發酵體系中,構建了具有硫辛酸功能模塊的.工程菌株,并對由.和.組成的兩菌一步發酵體系進行研究。此方法以D-山梨醇為底物,發酵參數控制在初始3 L裝液量,30 ℃,500 r/min,pH控制7.0,通氣1.5 vvm,在總接種量為10% (其中.為8%,.為2%) 的條件下,實驗組含硫辛酸功能模塊的兩菌一步發酵體系中的醇酸轉化率最高,達到了86.0%,證明了硫辛酸功能模塊對兩菌一步發酵的促進作用。因此,與傳統“二步發酵”法90%以上的醇酸轉化率相比,該兩菌一步發酵法具有巨大的潛能,為進一步優化維生素C發酵體系、實現一步發酵的工業化應用奠定基礎。并且,在8% D-山梨醇的條件下,與二步發酵相比,該一步發酵避免了二次滅菌的問題,將發酵周期從二步發酵的48 h縮短到現在的36 h。這不僅簡化了生產工藝,降低了能耗,還有望進一步提高設備利用率,降低生產成本。
因此,以.和.組成的兩菌一步發酵體系的功能還需進一步強化。從本研究可知,.和.組成的兩菌體系可以很好地配合生產2-KGA;然而,.和.在發酵過程中的菌種間關系及作用機制還需進一步研究明晰;同時,還可根據本文的.和.一步發酵研究結果,對菌株進行理性設計和改造,從而為進一步提高一步發酵體系的功能提供理論依據。
[1] Yun J, Mullarky E, Lu CY, et al. Vitamin C selectively killsandmutant colorectal cancer cells by targeting GAPDH. Science, 2015, 350(6266): 1391–1396.
[2] Cimmino L, Dolgalev I, Wang YB, et al. Restoration of TET2 function blocks aberrant self-renewal and leukemia progression. Cell, 2017, 170(6): 1079–1095.e20.
[3] Wei DZ, Yuan WK, Yin GL, et al. Studies on kinetic model of vitamin C two-step fermentation process. Chin J Biotech, 1992, 8(3): 277–282 (in Chinese). 魏東芝, 袁渭康, 尹光琳, 等. 維生素C二步發酵過程動力學模型的研究. 生物工程學報, 1992, 8(3): 277–282.
[4] Ma Q, Zhou J, Zhang WW, et al. Integrated proteomic and metabolomic analysis of an artificial microbial community for two-step production of vitamin C. PLoS ONE, 2011, 6(10): e26108.
[5] Zhou J, Ma Q, Yi H, et al. Metabolome profiling reveals metabolic cooperation betweenandduring induced swarm motility. Appl Environ Microbiol, 2011, 77(19): 7023–7030.
[6] Ding MZ, Zou Y, Song H, et al. Metabolomic analysis of cooperative adaptation between co-culturedand. PLoS ONE, 2014, 9(4): e94889.
[7] Zhou J, Yi H, Wang LL, et al. Metabolomic analysis of the positive effects ongrowth and 2-keto-L-gulonic acid production by reduced glutathione. OMICS, 2012, 16(7/8): 387–396.
[8] Bai L. Mechanisms of the mutualism betweenand[D]. Shenyang: Shenyang Agricultural University, 2017 (in Chinese). 白玲. 內生芽孢桿菌與普通生酮基古龍酸桿菌互作機制的研究[D]. 沈陽: 沈陽農業大學, 2017.
[9] Lü SX, Liao L, Zhang YH. Research progress on the oxidative stress relieving of acid-producing strain by companion strain in vitamin C mixed cultures fermentation. J Shenyang Agric Univ, 2017, 48(6): 641–646 (in Chinese). 呂淑霞, 廖林, 張云鶴. Vc混菌發酵中伴生菌解除產酸菌氧化脅迫的研究進展. 沈陽農業大學學報, 2017, 48(6): 641–646.
[10] Zhu YB. Mechanisms in the mutualism betweenand[D]. Wuxi: Jiangnan University, 2012 (in Chinese). 朱益波. 巨大芽孢桿菌與普通生酮基古龍酸菌互生作用研究[D]. 無錫: 江南大學, 2012.
[11] Liao L. Mechanisms on the oxidative stress relieving ofbyin vitamin C mixed culture fermentation[D]. Shenyang: Shenyang Agricultural University, 2018 (in Chinese). 廖林. Vc混菌發酵中膠紅酵母解除普通生酮基古龍酸桿菌氧化脅迫的研究[D]. 沈陽: 沈陽農業大學, 2018.
[12] Yang Y, Gao M, Yu XD, et al. Optimization of medium composition for two-step fermentation of vitamin C based on artificial neural network-genetic algorithm techniques. Biotechnol Biotechnol Equip, 2015, 29(6): 1128–1134.
[13] Wang T, Sun JB, Yuan JQ. Modeling and parameters identification of 2-keto-L-gulonic acid fed-batch fermentation. Bioprocess Biosyst Eng, 2015, 38(4): 605–614.
[14] Zhang ZX, Sun JW, Yuan JQ. Investigating the interaction betweenandfor 2-keto--gulonic acid biosynthesis in the two-step vitamin C fermentation. J Shanghai Jiaotong Univ (Sci), 2015, 20(3): 281–285.
[15] Zhu YB, Liu J, Du GC, et al. Sporulation and spore stability ofenhancepropagation and 2-keto-L-gulonic acid biosynthesis. Bioresour Technol, 2012, 107: 399–404.
[16] Liu J, Hu SB, Chang F, et al. Effects of the accompany strain on the fermentation performance of. J Taizhou Polytech Coll, 2013, 13(2): 76–78 (in Chinese). 劉杰, 胡少斌, 常芳, 等. 伴生菌對普通生酮基古龍酸菌發酵的影響. 泰州職業技術學院學報, 2013, 13(2): 76–78.
[17] Jia N, Du J, Ding MZ, et al. Genome sequence ofand analysis of its companion mechanism in the-strain consortium. PLoS ONE, 2015, 10(8): e0135104.
[18] Wang EX, Ding MZ, Ma Q, et al. Reorganization of a synthetic microbial consortium for one-step vitamin C fermentation. Microb Cell Fact, 2016, 15: 21.
[19] Gao LL, Hu YD, Liu J, et al. Stepwise metabolic engineering ofWSH-003 for the direct production of 2-keto-L-gulonic acid from D-sorbitol. Metab Eng, 2014, 24: 30–37.
[20] Anderson S, Marks CB, Lazarus R, et al. Production of 2-keto-L-gulonate, an intermediate inL-ascorbate synthesis, by a genetically modified. Science, 1985, 230(4722): 144–149.
[21] Huang Z, Zou W, Liu J, et al. Glutathione enhances 2-keto-L-gulonic acid production based onmodelWZ663. J Biotechnol, 2013, 164(4): 454–460.
[22] Ma Q, Zhang WW, Zhang L, et al. Proteomic analysis ofunder glutathione reveals high demand for thiamin transport and antioxidant protection. PLoS ONE, 2012, 7(2): e32156.
[23] Leduc S, De Troostembergh JC, Lebeault JM. Folate requirements of the 2-keto-L-gulonic acid-producing strainLMP P-20356 in l-sorbose/CSL medium. Appl Microbiol Biotechnol, 2004, 65(2): 163–167.
[24] Pan CH, Wang EX, Jia N, et al. Reconstruction of amino acid biosynthetic pathways increases the productivity of 2-keto-L-gulonic acid in-consortium via genes screening. J Ind Microbiol Biotechnol, 2017, 44(7): 1031–1040.
[25] Du J, Bai W, Song H, et al. Combinational expression of sorbose/sorbosone dehydrogenases and cofactor pyrroloquinoline quinone increases 2-keto-L-gulonic acid production in-consortium. Metab Eng, 2013, 19: 50–56.
[26] Wang PP, Xia Y, Li JH, et al. Overexpression of pyrroloquinoline quinone biosynthetic genes affectsL-sorbose production inWSH-003. Biochem Eng J, 2016, 112: 70–77.
[27] Miyazaki T, Tomiyama N, Shinjoh M, et al. Molecular cloning and functional expression of D-sorbitol dehydrogenase fromIFO3255, which requires pyrroloquinoline quinone and hydrophobic protein SldB for activity development in.. Biosci, Biotechnol, Biochem, 2002, 66(2): 262–270.
[28] Zou W, Liu LM, Zhang J, et al. Reconstruction and analysis of a genome-scale metabolic model of the vitamin C producing industrial strainWSH-001. J Biotechnol, 2012, 161(1): 42–48.
[29] Jia N, Ding MZ, Du J, et al. Insights into mutualism mechanism and versatile metabolism ofHbe602 based on comparative genomics and metabolomics studies. Sci Rep, 2016, 6: 23068.
[30] Xu Y, Zhou X, Shi CL, et al. α-Lipoic acid protects against the oxidative stress and cytotoxicity induced by cadmium in HepG2 cells through regenerating glutathione regulated by glutamate-cysteine ligase. Toxicol Mech Methods, 2015, 25(8): 596–603.
[31] Moini H, Packer L, Saris NEL. Antioxidant and prooxidant activities of α-lipoic acid and dihydrolipoic acid. Toxicol Appl Pharmacol, 2002, 182(1): 84–90.
[32] Packer L, Kraemer K, Rimbach G. Molecular aspects of lipoic acid in the prevention of diabetes complications. Nutrition, 2001, 17(10): 888–895.
[33] Ruan LJ, Hu ZC, Zheng YG. Research advances in biosynthesis of alpha-lipoic acid for antioxidant. Fine Specialty Chem, 2012, 20(7): 49–53 (in Chinese). 阮麗娟, 胡忠策, 鄭裕國. 抗氧化劑α-硫辛酸的生物合成研究進展. 精細與專用化學品, 2012, 20(7): 49–53.
[34] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod. Methods, 2001, 25(4): 402–408.
[35] Xiong XH, Zhang WC, Wang JH, et al. Method for promoting growth and acid production of: CN, CN102321698B. 2013-05-08 (in Chinese). 熊向華, 張惟材, 汪建華, 等. 一種促進酮古龍酸菌生長和產酸的方法: 中國, CN102321698B. 2013-05-08.
[36] Pan CH. The engineeredenhanced interaction with companionstrain[D]. Tianjin: Tianjin University, 2017 (in Chinese).潘才慧. 工程化改造酮古龍酸桿菌強化混菌間的互作關系[D]. 天津:天津大學, 2017.
[37] Cronan JE. Biotin and lipoic acid: synthesis, attachment, and regulation. EcoSal Plus, 2008, 3(1), doi: 10.1128/ecosalplus.3.6.3.5.
Biosynthesis of α-lipoic acid in Gluconobacter oxydans increases the production of vitamin C by one-step fermentation
Yu Liu1,2, Enxu Wang1,2, Caihui Pan1,2, Xiutao Dong1,2, and Mingzhu Ding1,2
1 Key Laboratory of Systems Bioengineering (Ministry of Education), Frontier Science Center for Synthetic Biology, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China 2 Collaborative Innovation Center of Chemical Science and Engineering (Tianjin), Tianjin University, Tianjin 300072, China
In a one-step fermentation system of vitamin C production withand, a functional module of α-lipoic acid biosynthesis was constructed in.. The engineered.was co-cultured with.to enhance the growth and 2-keto-L-gulonic acid (2-KGA) production of.. This one-step fermentation system alleviated the growth inhibition during the mono-culture of.and strengthened the interaction between the two bacteria. Moreover, the yield of vitamin C precursor (2-KGA) increased to 73.34 g/L (the control group was 59.09 g/L), and the conversion of D-sorbitol to 2-KGA increased to 86.0%. This study provides a new idea for further optimizing the one-step fermentation system of vitamin C production.
one-step fermentation,,, α-lipoic acid
January 3, 2019;
March 25, 2019
National Natural Science Foundation of China (No. 21676190).
Mingzhu Ding. Tel: +86-22-60973987; E-mail: mzding@tju.edu.cn
國家自然科學基金 (No. 21676190) 資助。
劉宇, 王恩旭, 潘才慧, 等. 氧化葡萄糖酸桿菌中硫辛酸合成模塊對維生素C一步混菌發酵的影響. 生物工程學報, 2019, 35(7): 1266–1276.
Liu Y, Wang EX, Pan CH, et al. Biosynthesis of α-lipoic acid inincreases the production of vitamin C by one-step fermentation. Chin J Biotech, 2019, 35(7): 1266–1276.
(本文責編 陳宏宇)

