大腸桿菌酪氨酸轉運系統基因敲除對酪氨酸生產的影響
王欽,曾偉主,周景文
大腸桿菌酪氨酸轉運系統基因敲除對酪氨酸生產的影響
王欽1,2,曾偉主1,2,周景文1,2
1 江南大學 糧食發酵工藝與技術國家工程實驗室,江蘇 無錫 214122 2 江南大學 生物工程學院,江蘇 無錫 214122
酪氨酸是三大芳香族氨基酸之一,廣泛用于食品、醫藥和化工等領域。轉運系統工程為代謝工程改造大腸桿菌選育酪氨酸生產菌株提供了一種重要的研究策略。大腸桿菌中酪氨酸胞內轉運主要通過和基因編碼的通透酶進行調控。以酪氨酸生產菌株HGXP為出發菌株,利用CRISPR-Cas9技術成功構建了和基因敲除菌,并通過發酵試驗考察了調節轉運系統對酪氨酸生產的影響。發酵結果表明,和基因敲除菌酪氨酸產量分別達到3.74 g/L和3.45 g/L,較出發菌株酪氨酸產量分別提高了19%和10%。對誘導溫度進行了優化,結果表明38 ℃為最佳誘導溫度。在3L發酵罐上進行了補料分批發酵,和基因敲除菌酪氨酸產量進一步提高至44.5 g/L和35.1 g/L,較出發菌株酪氨酸產量分別提高了57%和24%。研究結果對代謝工程強化大腸桿菌生產酪氨酸具有重要的參考價值。
大腸桿菌,L-酪氨酸,轉運系統,基因敲除
酪氨酸 (L-tyrosine,Tyr) 是一種人體的條件必需氨基酸,廣泛應用于食品、飼料、醫藥、化工等行業。酪氨酸常被用作苯丙酮尿癥患者的營養補充劑[1],也是多肽類激素、抗生素、L-多巴等醫藥化工產品的制備原料[2],以及合成如白藜蘆醇、柚皮素、生松素等高附加值酪氨酸衍生物的前體[3-5]。目前,工業上主要由酶法來制備酪氨酸[6],雖然其具有周期短、選擇性強、轉化率高和分離純化步驟簡單的優點,但天然酶活性低和穩定性差等缺點限制了酶法的應用[7-8]。與酶法相比,微生物發酵法可以利用生物質原料實現酪氨酸的從頭合成,可以降低生產成本。代謝工程和先進生物技術的快速發展為合理設計和優化微生物的代謝途徑以生產酪氨酸提供了有力的工具[9-10],因此微生物發酵法生產酪氨酸具有非常廣闊的發展前景[11-12]。
目前微生物發酵法生產酪氨酸的研究主要集中在提高前體物質供應、解除反饋抑制、阻斷競爭代謝途徑等方面,但對轉運系統的研究較少[13-15]。酪氨酸的轉運涉及到細胞對外界環境的感應,對優化代謝途徑也起到了重要的作用[16]。大腸桿菌中酪氨酸的胞內轉運主要是由和基因編碼的通透酶進行調控。AroP通透酶為通用芳香族氨基酸轉運體,負責酪氨酸、苯丙氨酸以及色氨酸向胞內的轉運。TyrP通透酶為酪氨酸特異性轉運體,特異性地將酪氨酸轉運到胞內。在大腸桿菌中,DAHP合成酶(DS)催化酪氨酸合成的前體物4-磷酸赤蘚糖(Erythrose-4-phosphate,E4P)和磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP)縮合生成3-脫氧-D-阿拉伯庚酮糖酸-7-磷酸(DAHP),它包含AroG、AroF和AroH這3個同工酶,它們的活性分別受胞內苯丙氨酸、酪氨酸和色氨酸的反饋阻遏和反饋抑制[17]。胞內酪氨酸積累過高會抑制DAHP合成酶的表達,進而影響酪氨酸的合成。本研究以酪氨酸生產菌株HGXP為出發菌株,利用CRISPR-Cas9技術敲除了酪氨酸轉運系統編碼基因和,從而減弱酪氨酸向胞內轉運的能力,一定程度上減輕酪氨酸的積累對DAHP合成酶的阻遏作用。并通過發酵試驗考察了酪氨酸轉運系統相關基因的敲除對大腸桿菌菌體生長和酪氨酸生產的影響。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒
出發菌株為酪氨酸生產菌株HGXP,其宿主菌HGX由大腸桿菌WSH-Z06 (pAP-B03) 通過連續傳代消除pAP-B03質粒選育而來[18]。HGXP帶有pAP-aroG-tyrA質粒,pAP-aroG-tyrA質粒帶有抗反饋抑制的大腸桿菌酪氨酸合成途徑關鍵酶基因aroG和,具有PP啟動子和Kan抗性篩選標記。酪氨酸生產菌株HGXP由實驗室前期通過基因工程手段構建。本研究以
HGXP為出發菌株,分別構建了和單基因敲除菌。基因敲除所需的工具質粒pCas和pTarget由中國科學院上海植物生理生態研究所提供[19]。本研究中所使用的菌株和質粒見表1。
1.1.2 培養基
種子培養基 (g/L):酵母粉 5,蛋白胨 10,NaCl 10。
酪氨酸發酵培養基 (g/L):葡萄糖35,蛋白胨4,酵母粉2,(NH4)2SO45,KH2PO43,MgSO4·7H2O 3,NaCl 1,檸檬酸鈉 1.5,CaCl2·2H2O 0.015,FeSO4·7H2O 0.112 5,維生素B10.075,微量元素營養液(TES) 1.5 mL/L,卡那霉素0.04,pH 6.8±0.1。搖瓶發酵時,添加12 g/L CaCO3用于調節pH。
TES (g/L):Al2(SO4)3·18H2O 2.0,CoSO4·7H2O 0.75,CuSO4·5H2O 2.5,H3BO30.5,MnSO4·H2O 24,Na2MoO4·2H2O 3.0,NiSO4·6H2O 2.5,ZnSO4·7H2O 15。
1.1.3 主要試劑
蛋白胨和酵母粉購自Oxoid公司。NaCl、葡萄糖、(NH4)2SO4、KH2PO4、MgSO4·7H2O、檸檬酸鈉、CaCl2·2H2O、FeSO4·7H2O、維生素B1、CaCO3、Al2(SO4)3·18H2O、CoSO4·7H2O、CuSO4·5H2O、H3BO3、MnSO4·H2O、Na2MoO4·2H2O、NiSO4·6H2O、ZnSO4·7H2O均購于上海國藥集團。L-酪氨酸標準品購自Sigma-Aldrich公司(上海)。卡那霉素(Kan)、壯觀霉素(Spc)、質粒提取試劑盒、PCR產物回收試劑盒和高效制備感受態細胞試劑盒均購于生工生物工程(上海) 股份有限公司。
1.2 方法
1.2.1 使用CRISPR-Cas9系統敲除大腸桿菌目的基因
Jiang等[19]先前描述了在大腸桿菌K12基因組中敲除目的基因的方法。此方法采用了雙質粒系統,其中一個為含有Cas9編碼基因的pCas質粒,另一個為含有打靶目的基因的sgRNA的pTarget質粒。將pTarget質粒和目的基因上下游同源臂同時通過電轉化到含有pCas質粒的細胞中,可以達到敲除目的基因的目的。pCas質粒在終濃度為0.01 mol/L的阿拉伯糖誘導下,合成重組酶,更有利于同源重組的發生。pTarget質粒會組成型的產生靶向目的基因的sgRNA,與pCas質粒產生的Cas9蛋白結合,sgRNA 20 bp的N20序列與目的基因堿基配對成功后Cas9蛋白會切斷目的基因的雙鏈。如果此20 bp定位在基因組上,那么基因組就會被切斷,從而無法繁殖。但是如果同時導入線性的同源臂,在切口兩側發生同源重組,那么同源臂就會取代原來的基因序列,而使得繁殖繼續下去。pCas質粒在IPTG誘導下可以產生定位在pTarget質粒上的sgRNA,從而消化pTarget質粒,pCas質粒本身在42 ℃下會被消除,因此可以把敲除目的基因的菌株中兩個質粒消除掉。本研究所用引物見表2。

表1 本研究所使用的菌株和質粒
1.2.2 培養方法
種子培養:從LB平板上挑取單菌落接種至裝有50 mL種子培養基的500 mL三角瓶中培養,37 ℃、200 r/min培養10–14 h。
搖瓶發酵培養:將培養好的種子培養液以10%的接種量,接種至裝有25 mL發酵培養基的250 mL三角瓶中進行培養,發酵溫度33 ℃,搖床轉速200 r/min,當菌體生長至600為1.5–2.0時,升溫至38 ℃誘導產L-酪氨酸。
發酵罐發酵培養:將培養好的種子液以10%的接種量接入裝有1.1 L發酵培養基的3 L發酵罐中,通過流加20%的氨水控制pH在6.7–6.9,發酵溫度33 ℃,待菌體濃度達到600=23–27時,升溫至38 ℃誘導產L-酪氨酸。初始轉速400 r/min,當溶解氧 (Dissolved oxygen,DO) 降至20%以下時逐步提高轉速使DO維持在20%以上,當培養基中葡萄糖基本耗盡時,流加700 g/L的葡萄糖使培養基中的葡萄糖濃度維持在10 g/L以內。
1.2.3 菌體濃度的測定
測定發酵罐發酵培養中的菌體濃度需在定容前加6 mol/L的HCl溶解發酵液中的酪氨酸,處理后的發酵液經12 000 r/min離心10 min,棄上清。菌體沉淀用去離子水洗滌2次,離心后得到的濕菌體在105 ℃下烘干至恒重,計算出細胞干重(Dry cell weight,DCW)。發酵液稀釋至適當的范圍后,使用722s型分光光度計測定其在600 nm處的吸光度(600),得到600與DCW的關系式。在本研究中,DCW(g/L)=0.364×600。

表2 本研究所用引物
The underlined part of the aroP-up-R, aroP-down-F, tyrP-up-R and tyrP-down-F primer sequences indicate homology extensions; the underlined part of aroP-sgRNA-F and tyrP-sgRNA-F primer sequences indicate N20sequences.
1.2.4 葡萄糖濃度的測定
取1 mL發酵液經12 000 r/min離心5 min,上清液稀釋一定倍數,采用葡萄糖-乳酸生物傳感分析儀(深圳西爾曼科技有限公司) 測定葡萄糖濃度。
1.2.5 發酵液樣品的處理方法
由于酪氨酸在室溫和中性pH下在水中的溶解度很低,因此在發酵過程中采集的大多數樣品具有大量以晶體形式存在的酪氨酸固體。將發酵液樣品以1∶1的比例用6 mol/L HCl稀釋,渦旋振蕩,以確保酪氨酸完全溶解。用去離子水將發酵液樣品進一步稀釋使最終產物濃度達到分析方法的測量范圍。渦旋振蕩,12 000 r/min離心10 min。收集上清液并過濾得到處理后的發酵液樣品用于高效液相色譜測定。
1.2.6 L-酪氨酸的測定
采用高效液相色譜法檢測發酵液中L-酪氨酸的含量。色譜柱為Agilent C18柱(250 mm×4.6 mm,5 μm),紫外檢測器的檢測波長為280 nm,流動相為0.1 mol/L乙酸鈉(冰乙酸調節pH至4.0) 和甲醇,體積百分比為90%和10%,流速為1.0 mL/min,柱溫30 ℃,進樣量10 μL[20]。
2 結果與分析
2.1 aroP和tyrP基因敲除菌的構建
由于酪氨酸合成關鍵酶的表達質粒pAP-aroG-tyrA和基因敲除的工具質粒pCas都是Kan抗性篩選標記,為避免pAP-aroG-tyrA質粒影響基因敲除菌的篩選,本研究首先在宿主菌HGX內進行酪氨酸轉運系統的基因敲除,然后通過轉化pAP-aroG-tyrA質粒獲得出發菌株HGXP的基因敲除菌。利用引物up-F和up-R擴增得到目的基因上游同源臂,利用引物down-F和down-R擴增得到目的基因下游同源臂,利用融合PCR技術擴增得到目的基因上下游同源臂。利用引物sgRNA-F和sgRNA-R以pTarget-質粒為模板通過全質粒PCR獲得帶有目的基因N20序列的pTarget質粒,用引物sgRNA-v-F和sgRNA-v-R對構建的pTarget質粒進行菌落PCR驗證(圖1A)。若能得到大小為500 bp左右的條帶,則證明pTarget質粒構建成功。將pTarget質粒和同源臂同時通過電轉化到含有pCas質粒的感受態細胞中,使用引物up-F和down-R進行菌落PCR驗證(圖1B)。若基因敲除成功則應得到大小約1 000 bp的同源臂片段。將樣品送至生工生物工程(上海) 股份有限公司進行測序驗證,核酸序列與同源臂序列一致,結果表明和基因已經成功敲除。將含有酪氨酸合成關鍵酶基因的質粒pAP-aroG-tyrA分別轉化至和基因敲除菌中,獲得酪氨酸基因工程菌HGPP和HGEP。

圖1 菌落PCR驗證瓊脂糖凝膠電泳圖
2.2 酪氨酸基因工程菌的搖瓶發酵
為了初步考察大腸桿菌酪氨酸轉運蛋白編碼基因敲除對菌株生產酪氨酸的影響,對出發菌株HGXP及構建的酪氨酸基因工程菌HGPP和HGEP進行了搖瓶發酵試驗。如圖2A所示,與對照菌株相比,基因敲除菌HGPP的最高600與對照菌株相比降低了8%;基因敲除菌HGEP的最高600與對照菌株相比提高了14%。說明基因的敲除對菌株生長有一定抑制作用,而基因的敲除對菌株的生長有一定促進作用,由于菌株的生長涉及到一系列復雜的調控,其原因有待于進一步探究。在酪氨酸生產方面,基因敲除菌HGPP發酵48 h的酪氨酸產量為3.74 g/L,與對照菌株HGXP相比提高了19%;基因敲除菌HGEP發酵48 h的酪氨酸產量為3.45 g/L,與對照菌株相比提高了10% (圖2B)。結果表明,在HGXP菌株中敲除轉運蛋白編碼基因和均對酪氨酸的生產有積極影響,基因的敲除較基因的敲除更有利于酪氨酸的生產。發酵條件的優化有望進一步提高酪氨酸基因工程菌生產酪氨酸的能力。
2.3 酪氨酸基因工程菌的誘導溫度優化
由于酪氨酸合成關鍵酶的表達質粒pAP-aroG-tyrA為熱誘導型質粒,誘導溫度與酪氨酸生物合成關鍵酶的表達有著密切的聯系,而且在不同的溫度下酪氨酸合成過程中的關鍵酶的酶活和穩定性也會受到影響。因此本實驗考察了不同的誘導溫度(36 ℃、38 ℃、40 ℃) 對酪氨酸生產菌株生產酪氨酸的影響。發酵48 h的酪氨酸產量如 圖3所示,在38 ℃的誘導條件下,HGXP、HGPP和HGEP菌株的酪氨酸產量比在33 ℃的培養條件下分別提高了96.7%、77.4%和92.6%;比在36 ℃的誘導條件下分別提高了17%、19%和18%;比在40 ℃的誘導條件下分別提高了8%、9%和12%。結果表明采用38 ℃的誘導溫度可以提高酪氨酸基因工程菌生產酪氨酸的能力,因此在3 L發酵罐水平上可以采用38 ℃的誘導條件來進一步探究其生產酪氨酸的能力。

圖2 大腸桿菌酪氨酸轉運系統基因敲除菌的搖瓶發酵

圖3 誘導溫度的優化
2.4 酪氨酸基因工程菌的補料分批發酵
由搖瓶發酵試驗得知,和基因敲除菌的酪氨酸生產能力較出發菌株HGXP都有提升。在3-L發酵罐上出發菌株HGXP的酪氨酸產量最高為28.3 g/L,為了進一步考察酪氨酸基因工程菌發酵生產酪氨酸的潛力,在3-L發酵罐上分別對HGPP和HGEP菌株進行了補料分批發酵的探究。如圖4所示,雖然在搖瓶水平上HGPP的生長情況不如HGEP,但是在發酵罐水平由于溶氧更為充足,2個菌株的最大DCW相近,分別為26.65 g/L和25.96 g/L。在酪氨酸生產方面,HGPP菌株發酵46 h的酪氨酸產量達到44.5 g/L,與出發菌株相比酪氨酸產量提高了57%,底物轉化率為0.179,生產強度為0.967 g/(L·h)。HGEP菌株發酵46 h,可以生產35.1 g/L的酪氨酸,與出發菌株相比酪氨酸產量提高了24%,底物轉化率為0.143,生產強度為0.763 g/(L·h) (表3)。結果表明,HGPP的底物轉化率和生產強度都大于HGEP,進一步證明了在HGXP菌株中基因敲除相較于基因敲除更有利于酪氨酸的生產。因此基因敲除菌可以作為酪氨酸生產的潛在優勢菌株。

圖4 大腸桿菌HGPP和HGEP的補料分批發酵
3 討論
L-酪氨酸的生物合成途徑已得到廣泛的研究[21],轉運系統的改造為代謝工程育種提供了重要的研究方向[22]。由于目前仍有許多氨基酸轉運系統相關功能基因尚未得到鑒定,因此只有少數文獻考察了轉運系統工程對氨基酸生物合成的影響[23-25]。在最近的一項研究中,Kim等[26]構建了一株生產酪氨酸的大腸桿菌菌株,通過在基因敲除菌株中過表達aroG、和,可以產生43.1 g/L酪氨酸。這是首次報道在大腸桿菌中通過改造酪氨酸轉運系統來生產酪氨酸。在本研究中分別構建了和基因敲除菌,由于同時敲除和基因后,菌株的生長受到嚴重影響,酪氨酸產量與對照菌株相比沒有提高,因此我們著重考察了酪氨酸轉運系統單基因敲除對菌株生產酪氨酸的影響。結果表明,和單基因敲除菌的酪氨酸產量與對照菌HGXP相比分別提高了19%和10%。

表3 大腸桿菌HGPP和HGEP補料分批發酵參數比較
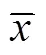
我們又對酪氨酸生產菌的誘導溫度進行了優化,結果表明在38 ℃下誘導關鍵酶的表達最有利于酪氨酸的生產。在進一步的補料分批發酵試驗中,酪氨酸最高產量為單基因敲除菌的44.5 g/L,底物轉化率為0.179,由于僅敲除了一個基因,對菌株的生長影響較小,因此可以進行后續的分子改造以進一步提高其生產酪氨酸的能力。
本研究所構建的酪氨酸生產菌株為熱誘導型菌株,相較于其他需要添加價格昂貴的誘導劑的工程菌株具有經濟節約且不易染菌的優點,更適合進行工業上的大規模生產。同時,對酪氨酸轉運系統的研究也為代謝工程育種提供了重要的研究策略。
[1] Giovannini M, Verduci E, Salvatici E, et al. Phenylketonuria: dietary and therapeutic challenges. J Inherit Metab Dis, 2007, 30(2): 145–152.
[2] Seetharam G, Saville BA. L-DOPA production from tyrosinase immobilized on zeolite. Enzyme Microb Tech, 2002, 31(6): 747–753.
[3] Katsuyama Y, Funa N, Miyahisa I, et al. Synthesis of unnatural flavonoids and stilbenes by exploiting the plant biosynthetic pathway in. Chem Biol, 2007, 14(6): 613–621.
[4] Lütke-Eversloh T, Santos CNS, Stephanopoulos G. Perspectives of biotechnological production of L-tyrosine and its applications. Appl Microbiol Biot, 2007, 77(4): 751–762.
[5] Wu JJ, Liu PR, Fan YM, et al. Multivariate modular metabolic engineering ofto produce resveratrol from L-tyrosine. J Biotechnol, 2013, 167(4): 404–411.
[6] Kim DY, Rha E, Choi SL, et al. Development of bioreactor system for L-tyrosine synthesis using thermostable tyrosine phenol-lyase. J Microbiol Biotechnol, 2007, 17(1): 116–122.
[7] Kim JH, Song JJ, Kim BG, et al. Enhanced stability of tyrosine phenol-lyase fromby DNA shuffling. J Microbiol Biotechnol, 2004, 14(1): 153–157.
[8] Rha E, Kim S, Choi SL, et al. Simultaneous improvement of catalytic activity and thermal stability of tyrosine phenol-lyase by directed evolution. FEBS J, 2009, 276(21): 6187–6194.
[9] Santos CNS, Xiao WH, Stephanopoulos G. Rational, combinatorial, and genomic approaches for engineering L-tyrosine production in. Proc Natl Acad Sci USA, 2012, 109(34): 13538–13543.
[10] Kim SC, Min BE, Hwang HG, et al. Pathway optimization by re-design of untranslated regions for L-tyrosine production in. Sci Rep, 2015, 5: 13853.
[11] Patnaik R, Zolandz RR, Green DA, et al. L-tyrosine production by recombinant: fermentation optimization and recovery. Biotechnol Bioeng, 2008, 99(4): 741–752.
[12] Olson MM, Templeton LJ, Suh W, et al. Production of tyrosine from sucrose or glucose achieved by rapid genetic changes to phenylalanine-producingstrains. Appl Microbiol Biot, 2007, 74(5): 1031–1040.
[13] Gosset G, Yong-Xiao J, Berry A. A direct comparison of approaches for increasing carbon flow to aromatic biosynthesis in. J Ind Microbiol, 1996, 17(1): 47–52.
[14] Lütke-Eversloh T, Stephanopoulos G. Feedback inhibition of chorismate mutase/prephenate dehydrogenase (TyrA) of: generation and characterization of tyrosine-insensitive mutants. Appl Environ Microbiol, 2005, 71(11): 7224–7228.
[15] Ikeda M, Katsumata R. Metabolic engineering to produce tyrosine or phenylalanine in a tryptophan-producingstrain. Appl Environ Microbiol, 1992, 58(3): 781–785.
[16] Ikeda M, Katsumata R. Transport of aromatic amino acids and its influence on overproduction of the amino acids in. J Ferment Bioeng, 1994, 78(6): 420–425.
[17] Hu CY, Jiang PH, Xu JF, et al. Mutation analysis of the feedback inhibition site of phenylalanine- sensitive 3-deoxy-D-arabino-heptulosonate 7-phosphate synthase of. J Basic Microbiol, 2003, 43(5): 399–406.
[18] Zhou HY, Liao XY, Wang TW, et al. Enhanced L-phenylalanine biosynthesis by co-expression ofpheAandaroF. Bioresour Technol, 2010, 101(11): 4151–4156.
[19] Jiang Y, Chen B, Duan CL, et al. Multigene editing in thegenome via the CRISPR-Cas9 system. Appl Environ Microbiol, 2015, 81(7): 2506–2514.
[20] Ji CX. Determination of tryptophan and tyrosine of fermentation liquid by HPLC. Anhui Chem Ind, 2014, 40(1): 68–69, 74 (in Chinese).紀傳俠. 高效液相色譜法測定發酵液中色氨酸和酪氨酸含量的研究. 安徽化工, 2014, 40(1): 68–69, 74.
[21] Juminaga D, Baidoo EEK, Redding-Johanson AM, et al. Modular engineering of L-tyrosine production in. Appl Environ Microbiol, 2012, 78(1): 89–98.
[22] Burkovski A, Kr?mer R. Bacterial amino acid transport proteins: occurrence, functions, and significance for biotechnological applications. Appl Microbiol Biotechnol, 2002, 58(3): 265–274.
[23] Ikeda M, Katsumata R. Tryptophan production by transport mutants of. Biosci Biotechnol Biochem, 1995, 59(8): 1600–1602.
[24] Vrljic M, Sahm H, Eggeling L. A new type of transporter with a new type of cellular function: L-lysine export from. Mol Microbiol, 1996, 22(5): 815–826.
[25] Okamoto K, Kino K, Ikeda M. Hyperproduction of L-threonine by anmutant with impaired L-threonine uptake. Biosci Biotechnol Biochem, 1997, 61(11): 1877–1882.
[26] Kim B, Binkley R, Kim HU, et al. Metabolic engineering offor the enhanced production of L-tyrosine. Biotechnol Bioeng, 2018, 115(10): 2554–2564.
Effect of gene knockout of L-tyrosine transport system on L-tyrosine production in Escherichia coli
Qin Wang1,2, Weizhu Zeng1,2, and Jingwen Zhou1,2
1 National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China 2 School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
L-tyrosine is one of three aromatic amino acids that are widely used in food, pharmaceutical and chemical industries. The transport system engineering provides an important research strategy for the metabolic engineering ofto breed L-tyrosine producing strain. The intracellular transport of L-tyrosine inis mainly regulated by two distinct permeases encoded byandgenes. Theandgene knockout mutants were constructed by CRISPR-Cas technique on the basis of L-tyrosine producing strain HGXP, and the effects of regulating transport system on L-tyrosine production were investigated by fermentation experiments. The fermentation results showed that theandknockout mutants produced 3.74 and 3.45 g/L L-tyrosine, respectively, which were 19% and 10% higher than that of the original strain. The optimum induction temperature was determined to be 38 °C. Fed-batch fermentation was carried out on a 3-L fermentor. The L-tyrosine yields ofandknockout mutants were further increased to 44.5 and 35.1 g/L, respectively, which were 57% and 24% higher than that of the original strain. The research results are of great reference value for metabolic engineering ofto produce L-tyrosine.
, L-tyrosine, transport system, gene knockout
December 25, 2018;
January 31, 2019
National Science Fund for Excellent Young Scholars (No. 21822806), National Natural Science Foundation of China (No. 31770097).
Jingwen Zhou. Tel: +86-510-85918312; E-mail: zhoujw1982@jiangnan.edu.cn
國家優秀青年科學基金(No. 21822806),國家自然科學基金(No. 31770097) 資助。
2019-03-12
http://kns.cnki.net/kcms/detail/11.1998.Q.20190311.1553.005.html
王欽, 曾偉主, 周景文. 大腸桿菌酪氨酸轉運系統基因敲除對酪氨酸生產的影響. 生物工程學報, 2019, 35(7): 1247–1255.
Wang Q, Zeng WZ, Zhou JW. Effect of gene knockout of L-tyrosine transport system on L-tyrosine production in. Chin J Biotech, 2019, 35(7): 1247–1255.
(本文責編 陳宏宇)

