IL-1β和IGF-1在幼兔發育性髖脫位髖臼軟骨細胞中的表達和作用*
張天久,俞 松,楊小紅,呂 欣,徐艷朋,羅 宇
(遵義醫科大學附屬醫院小兒矯形外科,貴州遵義 563000)
發育性髖關節脫位(developmental dislocation of the hip,DDH)是小兒骨科常見的骨關節畸形之一,致殘率較高,治療不及時或未經正確治療,易較早出現髖關節退行性變和骨關節炎(osteoarthritis,OA)。研究發現,正常軟骨組織中軟骨細胞的增殖與凋亡及細胞外基質的降解與合成之間處于一種動態平衡,當這種平衡被打破后即可發生關節退行性變,目前DDH發生髖關節退行性變的機制仍不清楚,可能與髖臼軟骨細胞增殖和凋亡異常密切相關[1-2]。白細胞介素-1β(interleukin-1β,IL-1β)和胰島素樣生長因子-1(insulin-like growth factor-1,IGF-1)在關節軟骨細胞的增殖、發育、成熟和凋亡過程中起重要作用,且兩者在軟骨細胞中的作用是相互拮抗的[3-4]。本實驗通過制作幼兔DDH動物模型,檢測不同時期髖臼軟骨細胞中IL-1β和IGF-1的表達情況,探討IL-1β和IGF-1在DDH髖臼軟骨細胞增殖和凋亡中的作用和意義,為兒童DDH退行性髖關節炎的預防和治療提供參考,現報道如下。
1 材料與方法
1.1材料 兔抗IL-1β多克隆抗體(bs-0812R,北京博奧森生物技術有限公司);兔抗IGF-1多克隆抗體(bs-0014R,北京博奧森生物技術有限公司);辣根過氧化物酶標記山羊抗兔IgG(H+L,ZB-2301,北京中杉金橋生物技術有限公司);DAB顯色試劑盒(CW0125,北京康為世紀生物科技有限公司);鼠抗GAPDH單克隆抗體(TA-08,北京中杉金橋生物技術有限公司,濃度1/3 000);蛋白垂直電泳儀(DYY-6C,北京市六一儀器廠);超高靈敏度化學發光成像系統[Chemi DocTMXRS+,伯樂生命醫學產品(上海)有限公司]。
1.2方法
1.2.1實驗動物分組及模型制作 4周齡實驗幼兔40只,雌雄不限,平均體質量(0.45±0.06)kg;采用硫噴妥鈉肌肉注射麻醉,左側后肢伸膝屈髖位管型石膏固定,右側后肢不做特殊處理作為對照側。實驗8周后攝髖關節正位片了解造模情況,根據實驗側Shenton線不連續、髖臼指數增大和股骨頭位于Perkin方格外側象限判定為DDH造模成功[5],造模不成功影響實驗進程需積極補充造模。選取造模成功的幼兔繼續進行實驗,分為A、B、C、D 4組,每組8只,分別在石膏固定8、12、16、20周后,采用空氣栓塞法處死,在無菌條件下解剖雙髖,將雙側髖臼邊緣軟骨塊分為兩部分,一部分迅速放入-80 ℃液氮保存,一部分放入10%中性甲醛液固定。
1.2.2免疫組織化學染色檢測IL-1β和IGF-1的表達情況 用10%中性甲醛液固定標本,然后行脫鈣、脫水、石蠟包埋、3~4 μm切片,常規脫蠟水化后,進行抗原修復,滴加3% H2O2消除組織內源性過氧化物酶的活性,切片封閉后,逐步滴加IL-1β一抗(1∶200)或IGF-1一抗(1∶400)、4 ℃冰箱過夜,室溫下孵育45 min,滴加山羊抗兔IgG(H+L)二抗工作液和DAB顯色劑工作液,蘇木素復染,脫水、透明、封片,鏡下觀察染色切片,軟骨細胞的細胞質或細胞核被染成黃色或棕黃色為陽性,陰性對照用磷酸鹽緩沖液(PBS)代替一抗,并用目鏡網格測微尺隨機選擇6個視野(×400)進行觀察,記錄陽性細胞數量。陽性率用細胞分數來表示,即6個視野內陽性軟骨細胞數占軟骨細胞總數的比值×100%。
1.2.3Western blot法檢測IL-1β和IGF-1的蛋白水平 取出用液氮保存的標本,取0.2 g組織放入研缽中充分研磨,加入500 μL的細胞裂解液研磨至勻漿無明顯顆粒,高速離心15 min,BCA蛋白定量法測定蛋白濃度,取上清液移至新的EP管,提取等量蛋白,十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳后轉至聚偏氟乙烯(PVDF)膜封閉,加入IL-1β或IGF-1一抗(1∶1 000),4 ℃搖床過夜,37 ℃水浴復溫后加二抗(1∶1 000),孵育后漂洗顯色,用GAPDH 做內參重復上述步驟,用Quatity One軟件掃描各條帶灰度值后進行定量分析(目的蛋白相對水平計算公式:目的蛋白灰度值/GAPDH灰度值)。
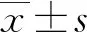
2 結 果
2.1幼兔DDH造模情況 幼兔在造模過程中肢體活動受限,進食減少,部分幼兔死亡,無關節感染及骨折并發癥發生,但經過積極補充造模,未影響實驗正常進行。實驗過程中共造模成功32只,分成4組,每組8只。

A、C:IL-1β和IGF-1在DDH實驗側髖臼軟骨中的表達,細胞質被染成黃色或淡黃色;B、D:IL-1β和IGF-1在DDH對照側髖臼軟骨中的表達,細胞質未見明顯著色
圖1IL-1β和IGF-1在髖臼軟骨中表達(免疫組織化學,×400)
2.2免疫組織化學法檢測IL-1β和IGF-1在髖臼軟骨細胞中的表達 IL-1β和IGF-1在每組實驗側和對照側的髖臼軟骨細胞中均有不同程度的表達,軟骨細胞細胞質被染成黃色或棕黃色。IL-1β在4組中實驗側髖臼軟骨中陽性率逐漸增高,B、C和D組實驗側和對照側比較,差異有統計學意義(P<0.05)。IGF-1在C組實驗側髖臼軟骨細胞中的陽性率最高,B、C組實驗側和對照側比較,差異有統計學意義(P<0.05),見圖1,表1、2。

表1 各組髖臼軟骨細胞中IL-1β陽性率的變化情況

表2 各組髖臼軟骨細胞中IGF-1陽性率的變化情況
2.3Western blot法檢測IL-1β和IGF-1在髖臼軟骨細胞中的表達水平 IL-1β在實驗側髖臼軟骨細胞中的表達水平逐漸增加,在D組中的水平最高,B、C、D組實驗側和對照側比較,差異有統計學意義(P<0.05)。IGF-1在B組實驗側髖臼軟骨細胞中的表達水平最高,B、C組實驗側和對照側比較,差異有統計學意義(P<0.05),見圖2,表3、4。

圖2 各組髖臼軟骨細胞中IL-1β和IGF-1蛋白水平Western blot表3 各組髖臼軟骨細胞中IL-1β的蛋白水平比較

組別實驗側對照側tPA組0.532±0.1630.491±0.1220.569>0.05B組0.725±0.1740.509±0.1712.504<0.05C組0.832±0.2040.512±0.1793.335<0.05D組0.906±0.3030.608±0.1682.433<0.05
表4 各組髖臼軟骨細胞中IGF-1的蛋白水平比較
3 討 論
DDH是一種兒童早期出現的髖關節發育異常性疾病,可能會隨著生長發育好轉或加重,若伴有不同程度的髖臼發育不良,易早期發生髖關節退行性變。軟骨細胞是關節軟骨中的惟一細胞類型,維持著軟骨細胞和細胞外基質的動態平衡,兒童髖臼軟骨細胞還有軟骨內化骨,促進髖臼生長發育的作用。研究發現髖臼軟骨細胞的增殖與凋亡活性異常在DDH的發展過程中有著重要意義[1],但具體機制仍不清楚。損傷性細胞因子IL-1β和合成性細胞因子IGF-1是軟骨細胞在增殖和凋亡過程中重要的細胞因子,對DDH髖臼軟骨細胞的增殖和凋亡也可能有著重要的調控作用。
IL-1β是一種主要的關節軟骨退變代謝調節因子,與軟骨破裂、基質降解密切相關,可誘導軟骨細胞變性和衰老,對軟骨細胞凋亡起到重要的調控作用,是OA的主要病因之一[6-7]。IL-1分為IL-1α和IL-1β兩種類型,正常軟骨細胞可產生少量的IL-1β,當其損傷后可大量合成和分泌大量的IL-1β,并刺激細胞膜上IL-1β受體表達增高,IL-1β與受體結合后將病變的信息傳送到細胞內,從而影響了軟骨細胞的正常代謝活動,刺激軟骨細胞分泌基質金屬蛋白酶,加速軟骨基質中蛋白多糖及膠原蛋白的降解,抑制蛋白多糖和膠原蛋白的合成,促進軟骨細胞凋亡的發生[8-9]。將 IL-1β加入到培養的軟骨細胞中,誘發型一氧化氮合酶(iNOS)水平顯著增高,一氧化氮合成、釋放增加,誘發關節軟骨細胞凋亡[10];實驗表明OA患者的關節軟骨中IL-1β有較高水平的表達[11]。在本實驗幼兔DDH動物模型中,免疫組織化學法和Western blot法檢測結果均提示實驗側髖臼軟骨中IL-1β的水平高于對照組,且隨著脫位時間的延長,差異越顯著,這可能與DDH自然病程密切相關,即當髖臼和股骨頭失去正常的解剖對位關系和生物力學刺激后,可導致了髖臼軟骨的損傷和退行性變,誘發和加速髖臼軟骨細胞的凋亡。本研究提示IL-1β可能是促進DDH髖臼軟骨細胞凋亡的原因之一。
IGF-1是一種具有胰島素樣合成代謝作用和促生長作用的多肽生長因子,促進軟骨細胞的增殖、表型的維持和軟骨細胞外基質的合成,抑制各種原因誘導的軟骨細胞的凋亡[12]。IGF-1在青春期前可通過刺激軟骨細胞的增殖和塑形使骨骼呈線性生長,在成人通過刺激軟骨細胞合成基質蛋白,抑制軟骨細胞的衰老和凋亡;IGF-1同樣也能抑制IL-1β誘導的軟骨細胞凋亡和對抗IL-1β引起的炎性介質MMP-13[13-14],IGF-1還可聯合透明質酸促進大鼠股骨關節軟骨缺損的修復,延緩周圍軟骨的退變[15]。本實驗B、C組中實驗側髖臼軟骨細胞中IGF-1表達和蛋白水平都較高,可使髖臼軟骨細胞保持著較高的增殖活性,抑制IL-1β誘導的軟骨細胞凋亡,尚能維持髖臼軟骨細胞增殖和凋亡之間的動態平衡,但隨著DDH自然病程的延長,髖臼軟骨細胞的增殖能力逐漸減弱,即發生髖臼軟骨不可逆性的損傷,這和DDH自然病程基本一致,但具體機制仍需要進一步研究。IL-1β和IGF-1在DDH早、中期髖臼軟骨中都有較高的表達,但后期IGF-1的表達減弱,提示DDH髖臼軟骨細胞在早、中期表現出較強的增殖活性與異常增高的凋亡率,后期增殖活性明顯減弱,這與部分文獻報道基本一致[1-2],IL-1β與IGF-1在DDH髖臼軟骨細胞中的表達異常,導致增殖活性和凋亡率之間失衡,可能是DDH發生髖關節退行性變的原因之一。
本實驗制作的幼兔DDH動物模型可模擬人類DDH的自然病程和髖關節的病理生理變化過程,若早期對DDH進行干預和治療,恢復髖關節的解剖關系及相應的生物力學環境,可能會改變這一自然病程,延緩退行性髖關節炎的發生。若本課題組在治療DDH時再采用其他方式進行干預,調控髖臼軟骨中IL-1β和IGF-1的生物學活性,維持髖臼軟骨細胞增殖和凋亡活性的動態平衡,或許在一定程度上能延緩或減少髖關節退行性變的發生,而這需要進一步的實驗研究。

