刺山柑總生物堿對系統性硬皮病HGF/C-Met通路的調控作用*
康小龍,何承輝,盧 軍
(1.新疆醫科大學附屬中醫醫院藥研室,烏魯木齊 830000;2.新疆維吾爾自治區藥物研究所藥劑室,烏魯木齊 830004)
系統性硬皮病(systemic sclerosis,SSc)是一種結締組織疾病,臨床表現為皮膚和內臟器官纖維化、免疫異常及血管病變[1-2]。刺山柑總生物堿系本課題組從新疆地產藥材刺山柑中提取的有效成分,擬用于SSc的治療。本實驗觀察了刺山柑總生物堿對SSc組織纖維化密切相關的肝細胞生長因子(hepatocyte growth factor,HGF)/C-Met通路的調控作用,以探討刺山柑總生物堿改善SSc組織纖維化的作用機制,現報道如下。
1 材料與方法
1.1材料
1.1.1實驗動物 選取清潔級雌性BALB/c小鼠90只,平均體質量(22.1±1.9)g,購自新疆實驗動物研究中心,合格證號:SCXK(新)2015-0027。
1.1.2藥物 刺山柑藥材:新疆麥迪森維藥有限公司飲片廠,由新疆藥物研究所何江研究員鑒別為正品;鹽酸博萊霉素粉針劑:日本化藥株式會社,批號430312;青霉胺片:上海信誼藥廠,批號052130503。
1.1.3試劑 小鼠HGF ELISA試劑盒(批號201503),購自美國R&D公司;小鼠C-Met ELISA試劑盒(批號J27030166),購自武漢華美生物科技公司;二辛可寧酸蛋白定量試劑盒(批號20150223),購自江蘇碧云天生物技術研究所。HGF抗體、α-tubulin抗體,購自美國Santa Cruz公司;山羊抗兔IgG-HRP,購自美國Cell Signaling公司。
1.1.4儀器 酶標儀(型號Multiskan Spectrum)、低溫離心機(型號Multifuge X1R),美國Thermo Fisher公司;Western blot設備(型號Mini-protean Tetra System),美國Biorad公司。
1.2方法
1.2.1刺山柑總生物堿的提取 將曬干粉碎的刺山柑果實,加10倍體積量95%乙醇80 ℃水浴回流提取30 min,提取2次,過濾,濾液備用,兩次的濾液減壓濃縮至藥材:藥液(g/g)質量比為2∶1。提取物濃縮干燥后經紫外分光光度法(UV)測得刺山柑總生物堿水平為32.0%(w/w),高效液相色譜法(HPLC)測得鹽酸水蘇堿水平為2.2%(w/w)。
1.2.2刺山柑總生物堿乳膏制備方法 在水浴中將白凡士林、單硬脂酸甘油酯、硬脂酸、月桂氮卓酮加熱至90 ℃使其熔融,作為油相;水浴加熱刺山柑總生物堿提取物濃縮液與甘油混合物,溫度達到90 ℃時作為水相;乳化劑為在適量水中加入羥基苯甲酸乙酯、十二烷基硫酸鈉,水浴加熱使其溶解;當水相、油相溫度降至85 ℃時,依次將水相和乳化劑加入油相中,邊加邊攪拌至乳化完全。
1.2.3小鼠SSc模型的建立及給藥方法 90只BALB/c小鼠,分為對照組、SSc模型組、低(225 mg/kg)、中(450 mg/kg)、高(900 mg/kg)劑量刺山柑總生物堿組及青霉胺(125 mg/kg)組,每組15只,博萊霉素皮下注射法建立SSc模型[3-4]:將小鼠背部中央區被毛剃除,鹽酸博萊霉素粉針劑用生理鹽水配成濃度為300 μg/mL的藥液,除對照組背部皮下注射生理鹽水外,其余各組注射博萊霉素30 μg/d,注射4周后,刺山柑總生物堿乳膏外敷低、中、高刺山柑總生物堿組小鼠背部,青霉胺組還給予青霉胺灌胃,對照組和SSc模型組外敷不含藥基質乳膏,每天1次,連續給藥8周。
1.2.4Western blot檢測小鼠皮膚組織HGF表達 給藥8周后,取小鼠背部皮膚,加入預冷的RIPA裂解液,組織勻漿機研磨成組織勻漿,冰浴裂解30 min,12 000 r/min離心10 min,吸取上清液,二辛可寧酸試劑盒定量上清液中蛋白水平,調整每孔上樣量,使每個加樣孔中總蛋白量相同,樣品與上樣緩沖液混合,95 ℃水浴中10 min變性蛋白,上樣后進行聚丙烯酰胺凝膠電泳,然后電轉移至聚偏氟乙烯(PVDF)膜上,5%的脫脂奶粉室溫封閉2 h,Tris-HCl-Tween洗膜后,加入HGF一抗(按1∶1 000稀釋),4 ℃孵育過夜,二抗室溫孵育1 h,ECL發光劑顯影,以α-tubulin作為內參,Image J軟件掃描條帶,比較蛋白相對表達水平。
1.2.5ELISA實驗檢測小鼠皮膚組織HGF和C-Met水平 給藥8周后,取小鼠背部皮膚,加入生理鹽水,組織勻漿機研磨成組織勻漿,4 000 r/min離心10 min后提取上清液。上清液中HGF和C-Met水平采用ELISA試劑盒測定,以每毫升上清液中總蛋白水平(二辛可寧酸蛋白定量試劑盒測定)濃度校正ELISA結果。
2 結 果
2.1各組小鼠皮膚組織HGF表達比較 Western blot結果顯示,與對照組比較,SSc模型組小鼠皮膚組織HGF表達減弱(P<0.01);與SSc模型組比較,中、高劑量刺山柑總生物堿組及青霉胺組小鼠皮膚組織HGF表達增強(P<0.05),見圖1。ELISA結果顯示,與對照組比較,SSc模型組小鼠皮膚組織HGF水平明顯降低(P<0.01);與SSc模型組比較,中、高劑量刺山柑總生物堿組及青霉胺組HGF水平明顯升高(P<0.05);中、高劑量刺山柑總生物堿組及青霉胺組比較,差異無統計學意義(P>0.05),見表1。
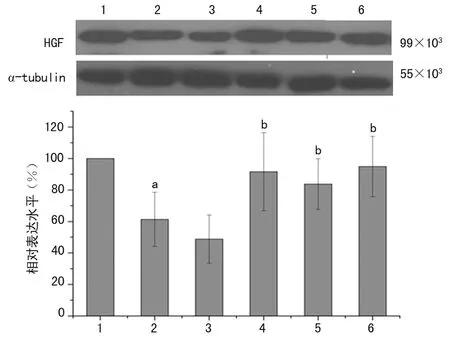
1:對照組;2:SSc模型組;3:低劑量刺山柑總生物堿組;4:中劑量刺山柑總生物堿組;5:高劑量刺山柑總生物堿組;6:青霉胺組;a:P<0.01,與對照組比較;b:P<0.05,與SSc模型組比較
圖1各組小鼠皮膚組織HGF表達比較
2.2各組小鼠皮膚組織C-Met水平比較 與對照組比較,SSc模型組小鼠皮膚組織C-Met水平明顯降低(P<0.01);與SSc模型組比較,中、高劑量刺山柑總生物堿組及青霉胺組小鼠皮膚組織C-Met水平升高(P<0.05),中、高劑量刺山柑總生物堿組及青霉胺組之間比較,差異無統計學意義(P>0.05),見表1。
表1 各組小鼠皮膚組織HGF及C-Met水平比較
a:P<0.01,與對照組比較;b:P<0.05,與SSc模型組比較
3 討 論
SSc是一種表現為多組織炎癥和纖維化的慢性自身免疫性疾病,目前認為SSc是由于過度活化的成纖維細胞合成膠原、纖維連接蛋白和糖胺聚糖等增多,細胞外基質沉積,引發組織纖維化[5-6]。
HGF主要由內皮細胞、間質成纖維細胞、腎小球系膜細胞等間質來源的細胞生成。HGF通過與細胞膜上特異性受體C-Met結合,激活下游信號通路后發揮其生物學作用,HGF是一種抗纖維化細胞因子,它通過抑制纖維化和促進血管生成,在修復受損的組織中起一定作用[7]。HGF通過抑制膠原生成,誘導成纖維細胞凋亡,降解細胞外基質等作用而發揮抗纖維化作用[8-9]。
在SSc的研究中表明HGF/C-Met通路具有明顯的抗纖維化作用。IWASAKI等[10]證實轉染HGF基因后緊皮型(TSK/+)小鼠的皮膚硬化得到明顯改善;WU等[11]研究發現用人類HGF基因轉染至經博來霉素處理過的小鼠,不僅可以阻止皮膚硬化和肺纖維化進程,而且能有效改善皮膚硬化癥狀;KAWAGUCHI等[12]證實HGF能抑制SSc成纖維細胞膠原產生;SHERRIFF等[13]也發現SSc成纖維細胞Ⅰ型膠原及結締組織生長因子的合成可被HGF抑制;BOGATKEVICH等[14]研究發現美國非洲裔SSc患者支氣管肺泡灌洗液、血清及體外肺成纖維細胞培養基中HGF濃度較白種人顯著降低,且HGF誘導的成纖維細胞C-Met受體磷酸化水平在非洲裔SSc患者也明顯低于白種人,推測這可能是美國的非洲裔SSc患者病情較重及預后差的原因,同時也表明HGF/C-Met與SSc病程密切相關。本研究也發現SSc模型組小鼠皮膚組織HGF和C-Met表達較對照組明顯減少,中、高劑量刺山柑總生物堿組HGF和C-Met表達較對照組明顯增多,而與青霉胺組比較,差異無統計學意義(P>0.05),提示刺山柑總生物堿對SSc HGF與C-Met水平的異常降低有一定升高作用,其作用與青霉胺相當。
綜上所述,本實驗發現刺山柑總生物堿可增加SSc小鼠皮膚組織HGF和C-Met表達,本課題組已經證實:給SSc小鼠外用刺山柑總生物堿乳膏后,小鼠皮膚、肺組織炎癥和纖維化等病理改變得到改善[15],增厚的真皮鱗狀上皮變薄,并可下調皮膚組織羥脯氨酸及Ⅰ、Ⅲ型膠原表達[15-16],提示刺山柑總生物堿可能通過上調HGF/C-Met通路,抑制膠原生成,降解細胞外基質,改善SSc皮膚纖維化。

