重組SSB蛋白表達、鑒定及評價*
杜 琴,盧小嵐,王 強,3,汪光蓉,3,羅文依,王舒琪,姚麗華,張國元,劉劍平,王東生△
(1.川北醫學院附屬醫院檢驗科,四川南充 637000;2.川北醫學院醫學檢驗系,四川南充 637000;3.川北醫學院醫學轉化醫學研究中心,四川南充 637000;4.川北醫學院附屬醫院醫學風濕免疫科,四川南充 637000)
干燥綜合征(SS)是臨床常見的一種自身免疫性疾病,其血清中可檢出多種自身抗體,以抗SSA抗體和抗SSB抗體最為常見,而抗SSB抗體較抗SSA抗體更為特異,是SS的血清特異性抗體,在原發性SS中陽性率可高達65%~85%。除此之外,抗SSB抗體亦可出現在其他自身免疫性疾病中,與血管炎[1]、高球蛋白血癥[2]、腎臟受累和肺病變[1]、腮腺腫大[3]、冷球蛋白血癥[4]等相關。目前抗SSB抗體的檢測主要采用免疫印跡法(IB)和酶聯免疫吸附試驗(ELISA)進行檢測[5],但與國外免疫微球技術的檢測結果相距甚遠[6]。隨著我國自動化程度的不斷提高,自身抗體的全自動定量檢測是未來的必然趨勢。因此本文通過基因克隆和重組DNA技術將SSB基因克隆至PET41a載體,構建原核表達質粒,表達并純化出SSB蛋白,為進一步建立抗SSB抗體的全自動定量檢測磁微粒化學發光試劑提供實驗基礎,現將研究結果報道如下。
1 材料與方法
1.1一般資料 收集川北醫學院附屬醫院2016年1月至2017年12月經歐蒙免疫印跡法檢出的抗SSB抗體陽性患者的血清115例。
1.2試劑 PET41a質粒購自德國Novagen公司,異丙基-β-D- 硫代半乳糖苷 (Isopropyl β-D-1-thiogalactopyranoside,IPTG)購自美國Sigma 公司;限制性內切酶BamHⅠ和XhoⅠ及T4 DNA連接酶和高保真聚合酶均購自日本TaKaRa公司;大腸埃希菌DH5α、DNA ladder、質粒提取試劑盒購自北京天根生化科技有限公司;胰蛋白胨和酵母粉購自美國Sigma公司;卡那霉素和氯霉素購自美國Gibco公司;Ni2+-樹脂填料購自美國Millipore有限公司;WB所用重組SSB蛋白購自德國Diarect公司;其余試劑均為國產或進口分析純試劑。
1.3方法
1.3.1引物設計、合成與PCR擴增 根據Genbank中SSB基因編碼序列(NM_003142),設計PCR引物,并在引物的5′端分別引入BamHⅠ和XhoⅠ的酶切位點,由上海生工生物有限公司合成。引物序列見表1(下劃線部分為酶切位點)。以Hela細胞提取總RNA后逆轉錄制備的cDNA為模板,用合成的引物進行擴增,產物經1%瓊脂糖凝膠電泳鑒定,并切膠回收,獲得目的基因片段SSB-flag。
1.3.2重組質粒的構建 將SSB-flag和PET41a質粒用BamHⅠ和XhoⅠ進行雙酶切,瓊脂糖凝膠電泳后切膠分別回收,再將兩者以T4 DNA連接酶4 ℃連接過夜。連接產物轉化感受態大腸埃希菌DH5α,在LB平板(卡那霉素50 μg/mL,氯霉素34 μg/mL)上進行初步篩選,對平板上長可生長的單個菌落進行菌落PCR和測序鑒定,鑒定正確的陽性克隆提取質粒,命名為GST-SSB-6*His-PET41a。
1.3.3SSB重組蛋白的表達形式 將GST-SSB-6*His-PET41a重組質粒轉化入感受態大腸埃希菌OverExpress C41(DE3)中,涂布于LB平板(含抗生素,濃度同上)上,37 ℃培養過夜,待長出單個菌落后進行菌落PCR鑒定,陽性克隆接種于5 mL的LB液體培養基中(抗生素濃度同上),37 ℃培養12~14 h,加入甘油保存菌種。次日將菌種以1∶100接入5 mL的液體培養基中(抗生素濃度同上),37 ℃培養至OD為0.6時,加入0.1 mmol/L IPTG,16 ℃誘導表達6 h后,8 000 r/min、4 ℃離心1 min,收集菌體。加入1 mL破碎液進行超聲波裂解。裂解條件:溫度-冰浴、功率20%、超聲2 s、間隔6 s、時間5 min。12 000 r/min、4 ℃離心1 min,收集上清液和沉淀。SDS-PAGE鑒定蛋白表達形式。
1.3.4GST-SSB-6*His重組蛋白的純化
1.3.4.1菌種擴大培養及誘導表達 菌種活化后,按1∶100的接入500 mL LB液體培養基(卡那濃度50 μg/mL,氯霉素濃度34 μg/mL),37 ℃培養至OD=0.4-0.6,加入濃度為0.1 mmol/L的IPTG,16 ℃誘導表達12 h,12 000 r/min、4 ℃離心15 min,收集菌體。加入200 mL 20 mmol/L Tris,500 mmol/L NaCl,pH8.0,10%甘油溶液重懸菌體,超聲波裂解菌體,4 ℃ 13 000 r/min離心15 min收集裂解上清。
1.3.4.2上清純化用高親和性Ni樹脂,先以20 mmol/L Tris,500 mmol/L NaCl,pH8.0,10%甘油溶液平衡(平衡溶液),再將裂解上清上樣至Ni樹脂。上樣后,用平衡溶液洗滌至OD280到0.100以下,分別用含不同濃度咪唑(20、60 mmol/L)的平衡溶液洗脫目的蛋白。
1.3.5GST-SSB-6*His重組蛋白免疫原性驗證 用純化的GST-SSB-6*His蛋白免疫BALB/c雌性小鼠,每只每次60 μg,腹腔注射。第1次免疫使用弗氏完全佐劑,第2次和第3次免疫使用弗氏不完全佐劑。第3次免疫后第7天采集小鼠血清,WB檢測Diarect公司的重組SSB蛋白,分別上樣5、10、20 ng。小鼠血清為一抗,羊抗鼠-HRP為二抗,參照文獻方法[7]。
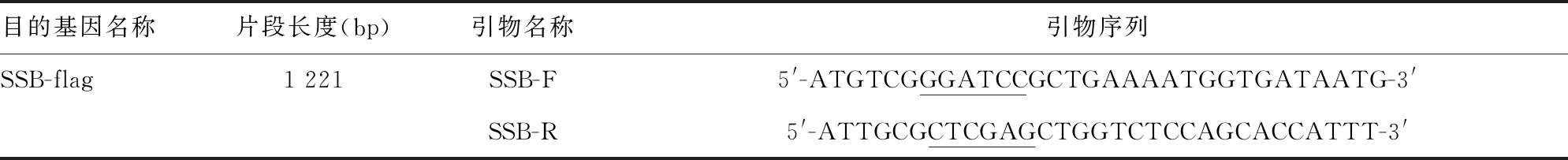
表1 SSB重組蛋白基因擴增引物序列(下劃線為酶切位點)
1.3.6GST-SSB-6*His重組蛋白用于ELISA檢測抗SSB抗體 使用GST-SSB-6*His蛋白包被酶標板,孵育不同效價的抗SSB蛋白自身抗體人血清樣品。以diarect公司的重組SSB蛋白作為對照,包被酶標板,檢測相同的人血清樣品,將兩種蛋白檢測的OD值繪制相關性曲線。
1.3.7重組蛋白特異性驗證 收集經免疫印跡法(LIA)檢測抗U1-nRNP、SmD1、SS-A、Scl-70、PM-Scl、Jo-1、CENP-B、PCNA、dsDNA、NUC、Rib-P和AMA M2等不同自身抗體陽性的血清標本各6份,采用1.2.6方法建立的ELISA反應體系檢測上述血清標本,以標本OD450nm/(0.10+陰性對照OD450nm)<1.00,即S/CO<1.00作為陰性判讀標準。
2 結 果
2.1PCR擴增結果 擴增產物經1%瓊脂糖凝膠電泳分析,可見1 200 bp左右的目的條帶,與預期大小一致,見圖1。

M:DNA marker(bp);1:SSB目的基因
圖1SSB目的基因PCR擴增產物電泳圖
2.2重組質粒的菌落PCR及測序鑒定結果 SSB目的基因與PET41a質粒均經雙酶切、膠回收后,用T4 DNA連接酶連接過夜,連接產物轉化感受態大腸埃希菌DH5α,對LB平板(含抗生素)上生長的單個菌落進行菌落PCR,均擴增出1 200 bp左右的目的條帶,測序結果顯示與Genbank中SSB基因編碼序列(NM_003142)一致,表明GST-SSB-6*His-PET41a重組質粒構建正確。菌落PCR結果見圖2。
2.3誘導表達和純化
2.3.1重組蛋白表達形式鑒定 將正確構建的重組質粒GST-SSB-6*His-PET41a轉化入OverExpress C41(DE3)中,16℃ IPTG誘導表達6 h,收集菌體經超聲破碎后分別收集上清液和沉淀,SDS-PAGE鑒定,結果示GST-SSB-6*His重組蛋白是上清液可溶性表達,相對分子質量為72×103,見圖3。
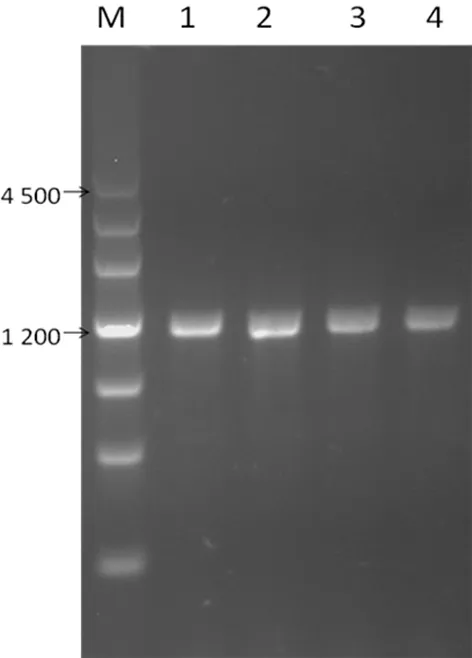
M:DNA marker(bp);1~4:挑取的單克隆菌落
圖2GST-SSB-6*His-PET41a的菌落
PCR檢測結果電泳圖
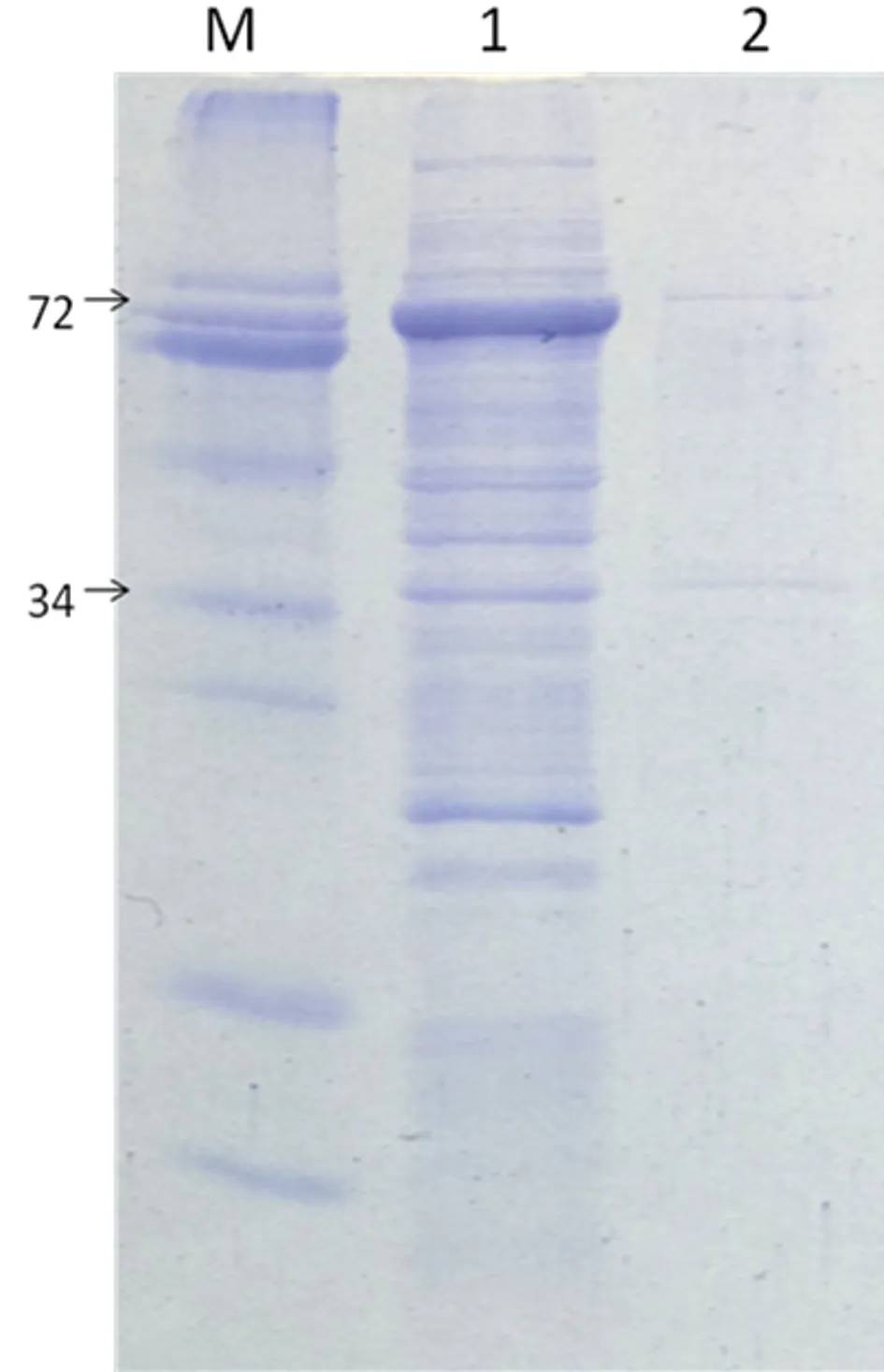
M:預染蛋白marker(KDa);1:IPTG 誘導后裂解上清液;2:IPTG 誘導后裂解沉淀
圖3重組蛋白可溶性鑒定的SDS-PAGE電泳圖
2.3.2重組蛋白大量表達后純化 將含有重組質粒GST-SSB-6*His的OverExpress C41(DE3)菌種擴大培養,IPTG誘導表達后收集菌體,超聲破碎,取上清過Ni2+樹脂柱。用平衡溶液洗滌至OD280到0.100以下,分別用含不同濃度咪唑的平衡溶液(20、60 mmol/L)洗脫目的蛋白。目的蛋白在兩個濃度咪唑下均有洗脫蛋白,電泳結果示:蛋白主帶清楚,總體純度大于90%。60 mmol/L組分產量更高,作為優選組分(圖4)。
2.3.3重組蛋白免疫原性鑒定 用純化的GST-SSB-6*His蛋白免疫BALB/c小鼠,采集小鼠血清,WB檢測Diarect公司的重組SSB蛋白,分別上樣5、10、20 ng。檢測結果顯示:GST-SSB-6*His重組蛋白免疫小鼠制備的抗血清能夠與Diarect公司的重組SSB蛋白反應,表明融合蛋白具有足夠的免疫原性(圖5)。

M:預染蛋白marker(KDa);1:IPTG 誘導后裂解上清;2:經Ni樹脂柱的流穿液;3:20 mmol/L咪唑洗脫組分;4:60 mmol/L咪唑洗脫組分
圖4擴大培養后重組蛋白洗脫條件的SDS-PAGE電泳圖
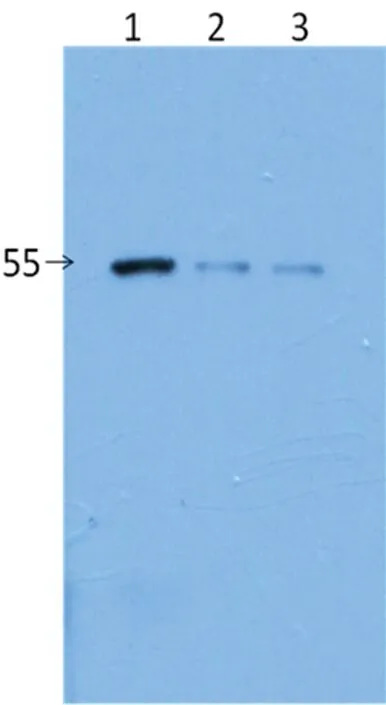
1:20 ng;2:10 ng;3:5 ng
圖5重組蛋白免疫原性的WB鑒定結果
2.3.4重組蛋白用于ELISA檢測抗SSB抗體 用GST-SSB-6*His蛋白和diarect公司的重組SSB蛋白,分別包被酶標板,檢測相同的人血清樣品(115例)。將兩種蛋白檢測的OD值做相關性曲線,表明GST-SSB-6*His蛋白檢測人血清樣品的臨床相關性與德國Diarect公司的重組SSB蛋白一致,R2=0.932(圖6)。

圖6 GST-SSB-6*His蛋白和diarect公司的重組SSB蛋白檢測人抗SSB抗體的相關性分析
2.3.5特異性鑒定 用GST-SSB-6*His蛋白包被建立的ELISA反應體系檢測抗U1-nRNP、SmD1、SS-A、Scl-70、PM-Scl、Jo-1、CENP-B、PCNA、dsDNA、NUC、和AMA M2等常見自身抗體陽性血清標本,結果均為陰性。見表2。
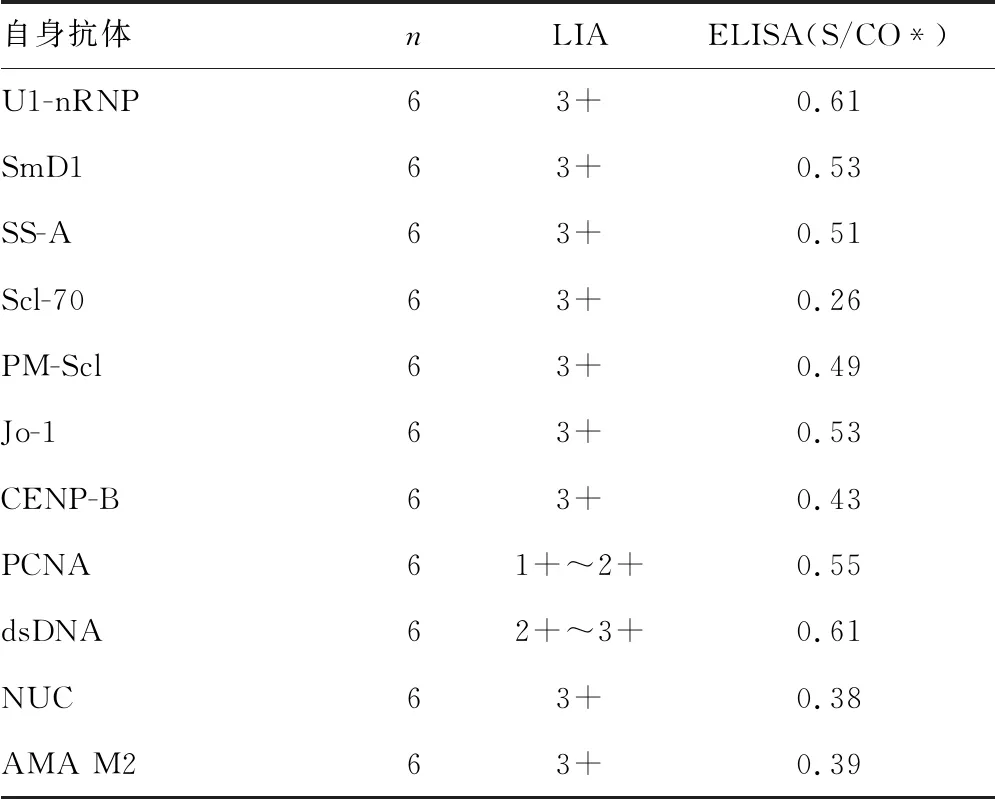
表2 GST-SSB-6*His蛋白與常見自身抗體交叉反應情況
*S/CO為樣本檢測結果均值
3 討 論
SSB抗原是原發性干燥綜合征(pSS)的特異性自身抗原之一,是ALSPAUGH等[8]在1975年用人淋巴細胞提取物檢測pSS患者的血清時發現并命名的,后經證實與1974年發現的胞漿抗原La是同一種物質,故稱之為SSB/La抗原。
SSB抗原是RNA聚合酶Ⅲ的輔助蛋白,參與基因的轉錄終止[9],幫助pre-tRNA的正確折疊和加工成熟[10]。SSB抗原主要定位于細胞核,在紫外線照射等異常情況下,SSB抗原會發生突變,且細胞內定位亦發生改變,進而刺激機體產生抗SSB抗體,引起自身免疫性疾病的發生[11]。
目前,抗SSB抗體的檢測主要采用IB和ELISA進行檢測[5]。IB法雖操作簡單,無需特殊儀器,但其檢測結果完全定性,且易受主觀因素影響,難于質量控制[12]。而ELISA操作繁瑣,重復性差,干擾因素較多。故建立一種全自動、高靈敏的定量方法才能更好滿足臨床需要。本研究構建了GST-SSB-6*His-PET41a原核表達載體,誘導純化出有活性的GST-SSB-6*His蛋白。GST-SSB-6*His-PET41a重組質粒帶有6×His和GST標簽:6×His用于目的蛋白的親和純化,且能增加目的蛋白在體外的穩定性[13];來源于日本血吸蟲的谷胱甘肽巰基轉移酶(GST)標簽,是目前應用最為廣泛的融合標簽之一[14],可提高目的蛋白的表達量和可溶性。
本實驗重組質粒中插入目的蛋白序列長度為1 221 bp,測序結果與Genbank中SSB基因編碼序列完全一致,其翻譯的目的蛋白理論相對分子質量應為44.77×103;C端6×His 標簽相對分子質量約為0.66×103;N端GST標簽蛋白的相對分子質量約為26×103,故本研究誘導純化出的目的蛋白相對分子質量大約為72 ×103,與SDS-PAGE鑒定結果一致,因此本實設計的重組蛋白制備路線正確。
本研究將GST-SSB-6*His重組蛋白免疫小鼠,所得到的小鼠抗血清能與德國Diarect公司的重組SSB蛋白發生反應,并且GST-SSB-6*His重組蛋白亦能與自身免疫性疾病患者血清中的抗SSB抗體結合,說明GST-SSB-6*His重組蛋白具有很好的免疫原性和免疫反應性,同時重組蛋白與其他常見的自身抗體之間不存在交叉反應,具有很好的特異性,其所攜帶的26×103GST標簽未對重組蛋白的蛋白活性、生物學功能等產生影響,因而重組蛋白無需切除GST標簽,直接作為抗原,為進一步建立應用于國產儀器的全自動定量檢測抗SSB自身抗體的磁微粒化學發光試劑奠定基礎。

