血清CTRP3、SLOX-1水平與OSAHS合并T2DM患者下肢血管病變的關系研究*
范 榕,白亞麗,趙雅寧△,韓 影,戈艷蕾
(1.華北理工大學護理與康復學院,河北唐山 063210;2.華北理工大學附屬醫院呼吸科,河北唐山 063000)
下肢血管病變是2型糖尿病(type 2 diabetes mellitus,T2DM)的常見并發癥之一,23.8%以上T2DM患者存在不同程度的下肢血管病變[1],極大影響疾病發展,增加患者的病死率。阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)因長期間歇低氧可誘發動脈粥樣硬化,其發生動脈粥樣硬化的風險較健康人群升高2.6倍[2]。補體C1q腫瘤壞死因子相關蛋白3(C1q/TNF-related protein 3,CTRP3)已證實參與T2DM的病理生理過程,具有抗炎作用[3]。可溶性凝集素樣氧化型低密度脂蛋白受體1(slouble lectin oxidized low density lipooprotein receptor-1,SLOX-1)是一種新型氧化低密度脂蛋白受體,是血管內皮細胞功能異常的重要介質[4]。有研究指出二者可能參與了動脈硬化的多個環節[5-6]。血清CTRP3、SLOX-1與OSAHS合并T2DM患者下肢血管病變的發生是否有直接關系,目前尚無定論。本研究通過分析血清CTRP3、SLOX-1水平與OSAHS合并T2DM患者下肢血管病變的關系,以期找到預測OSAHS合并T2DM患者下肢血管病變的血清標志物,從而為預防和治療提供新方向,現報道如下。
1 資料與方法
1.1一般資料 選取華北理工大學附屬醫院內分泌科2014年12月至2016年12月就診的OSAHS合并T2DM患者為研究對象。經下肢血管超聲檢測確診有下肢血管病變的224例患者為病例組,選擇同期未患下肢血管病變的224例OSAHS合并T2DM患者為對照組。納入標準:(1)所有患者均經血糖檢測符合1999年WHO制訂的T2DM的診斷標準;(2)經多導睡眠圖監測符合中華醫學會呼吸病學分會制訂的OSAHS診斷標準。排除標準:(1)合并甲狀腺功能異常或患有其他內分泌疾病;(2)合并其他可引起周圍血管疾病或肢體壞疽的因素;(3)急性感染、腫瘤及腫瘤術后;(4)嚴重心、肝、腎功能不全者;(5)正在服用鎮靜催眠類等影響睡眠或可導致肌肉松弛的藥物;(6)處于妊娠期患者。本研究經華北理工大學醫學倫理委員會批準,患者簽署知情同意書。
1.2方法
1.2.1資料收集 收集患者性別、年齡、吸煙與否(標準:每天至少1支且持續1年以上;已戒煙但時間短于6個月)、T2DM病程、OSAHS病情分度[輕度:睡眠呼吸紊亂指數(apnea hypopnea index,AHI)≥5~<15次/小時;中度:AHI≥15~<30次/小時;重度:AHI≥30次/小時]、夜間最低血氧飽和度(lowest oxygen saturation,LSaO2)、高血壓史。
1.2.2實驗室相關檢查 (1)CTRP3、SLOX-1水平測定:入院后次日清晨空腹(入院當日晚8點起禁飲食)抽取靜脈血2 mL,3 000 r/min離心20 min后留取上層血清,凍存于-80 ℃無菌冰箱,待標本收齊后解凍,集中采用由上海科冉實業有限公司生產的自動定量酶標儀進行酶聯免疫吸附法檢測,CTRP3、SLOX-1試劑盒購自天津灝洋生物制品科技有限責任公司。本研究依據兩組患者血清CTRP3、SLOX-1的檢驗結果按照P50分層,血清CTRP3水平低于P50者為異常,血清SLOX-1水平高于P50者為異常。(2)其他實驗室指標測定:抽取空腹靜脈血測定空腹血糖(fasting blood-glucose,FPG)、糖化血紅蛋白(glycosylated hemoglobin,HbA1c)、總膽固醇(triglycerin,TC)、三酰甘油(total cholesterol,TG)、高密度脂蛋白膽固醇(high density lipoprotein,HDL-C)、低密度脂蛋白膽固醇(low density lipoprotein,LDL-C)。
1.2.3下肢血管病變檢測 所有入組患者均于入院當日或次日采用德國西門子AcusonSequoia C512型彩色多普勒超聲診斷儀,7.5~11.0 MHz線陣探頭,檢測動脈包括雙側股淺動脈、脛后動脈及足背動脈。按常規方法進行盲法測定。將下肢血管病變的性質分為4種,并依據病變的嚴重程度評分,以診斷下肢血管病變:(1)血管內膜厚度:不厚(內膜增厚小于1.0 mm)為0分,輕度增厚(內膜增厚1.0~1.2 mm)為1分,中重度增厚(內膜增厚大于1.2 mm)為2分;(2)動脈硬化程度:正常為0分,輕度硬化(動脈內膜回聲強但未增厚,無斑塊)為1分,中重度硬化(輕度伴有斑塊或狹窄)為2分;(3)斑塊:正常(未發現斑塊)為0分,單發為1分,多發斑塊為2分,彌漫性斑塊為3分;(4)狹窄:無狹窄為0分,輕度狹窄(狹窄程度為30%~<50%)為1分,中重度狹窄(狹窄程度為50%~75%)為2分,閉塞(無血流)為3分。含有1種及以上則可診斷為下肢血管病變,得分越高血管病變越重。
1.2.4多導睡眠監測 所有入組的T2DM患者入院后均采用澳大利亞Compumedics公司生產的YH1000多導睡眠儀進行多導睡眠監測。監測當日患者禁飲酒、濃茶、咖啡,禁服用鎮靜催眠類藥物,2周內無上呼吸道感染。采集AHI及LSaO2為主要參考指標。所有研究對象需行整夜連續監測,時間不少于7 h。數據經睡眠分析軟件初步分析后由人工進一步糾正,最終由專業醫師確定監測結果。
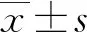
2 結 果
2.1兩組患者一般資料比較 兩組患者T2DM病程、OSAHS病情分度、LSaO2、高血壓史比較,差異有統計學意義(P<0.05);年齡、性別、吸煙史比較,差異無統計學意義(P>0.05),見表1。

表1 兩組患者一般資料比較[n(%)]
2.2兩組患者生化指標檢查結果比較 兩組間患者HDL-C、LDL-C水平比較,差異有統計學意義(P<0.05),兩組患者FPG、HbA1c、TC、TG水平比較,差異無統計學意義(P>0.05);病例組血清CTRP3水平較對照組表達下調、SLOX-1水平較對照組表達上調(P<0.05),見表2。

表2 兩組患者實驗室指標檢查結果比較
2.3OSAHS合并T2DM下肢血管病變影響因素的二元Logistic回歸分析 以OSAHS合并T2DM患者是否發生下肢血管病變為因變量,以T2DM病程、AHI、LSaO2、高血壓史、HDL-C、LDL-C、CTRP3、SLOX-1為自變量,進行二元Logistic回歸分析顯示,T2DM病程、AHI、LSaO2、LDL-C、SLOX-1是OSAHS合并T2DM患者下肢血管病變發生的危險因素,HDL-C、CTRP3是下肢血管病變發生的保護因素(P<0.05),見表3。

表3 OSAHS合并T2DM下肢血管病變影響因素的二元Logistic回歸分析
3 討 論
下肢血管病變是T2DM患者出現的常見并發癥,有研究指出T2DM患者下肢截肢的相對危險度是非T2DM患者的40倍[7],因此,下肢血管病變預后差,致殘致死率高,嚴重影響T2DM患者康復,給患者、家庭、社會帶來沉重負擔。其主要病理改變是動脈粥樣硬化,最初損傷改變為內皮功能受損,伴有血管收縮、炎癥、血脂紊亂等[8]。前期研究結果顯示,OSAHS可加重T2DM患者下肢血管病變發生,其原因可能是合并OSAHS的T2DM患者易出現更嚴重的缺氧情況,間歇低氧可導致機體氧化應激反應增強,對低氧敏感的分子可能促使粥樣斑塊形成,改變動脈粥樣硬化的臨床演變。因此,明確OSAHS合并T2DM患者下肢血管病變的發生機制,尤為重要。本研究結果顯示T2DM病程、AHI、LSaO2、HDL-C、LDL-C、CTRP3、SLOX-1與OSAHS合并T2DM患者下肢血管病變的發生有關。
本研究中LDL-C是OSAHS合并T2DM下肢血管病變發生的危險因素,HDL-C是下肢血管病變的保護因素,研究顯示T2DM患者脂代謝紊亂,嚴重影響動脈粥樣硬化性疾病的發生、發展,T2DM控制不佳,血脂水平異常可直接影響下肢血管病變發生[9]。T2DM病程是OSAHS合并T2DM患者下肢血管病變的獨立危險因素,與目前相關報道結果基本一致[10]。T2DM病程長,長期高糖刺激不僅導致胰島β細胞功能進行性下降,同時患者炎癥水平、糖脂代謝紊亂程度也不斷加重,下肢動脈硬化的發生率也隨之增高。因此應加強對T2DM病程較長患者的健康指導,糾正血脂紊亂情況,提早預防下肢血管病變的發生。AHI是OSAHS病情嚴重程度的指標,隨著OSAHS病情加重,LSaO2降低,下肢血管病變發生風險加重。龔輝成等[11]在對不同嚴重程度OSAHS患者的研究中指出,AHI與血栓調節蛋白呈正相關,重度OSAHS患者存在明顯炎性反應及氧化應激反應,引起血管內皮細胞損傷,逐漸導致動脈粥樣硬化,且與患者長時間呼吸暫停與間歇缺氧及更嚴重的睡眠呼吸結構紊亂有關,可通過改善患者氣道阻塞情況、糾正睡眠紊亂等降低下肢血管病變發生風險。
血清CTRP3是一種新發現的脂肪因子,主要表達于人體脂肪組織、肝臟和單核細胞中,其結構顯示與脂聯素具有同源性[12]。有研究顯示CTRP3可通過激活絲/蘇氨酸蛋白激酶(Akt)等信號通路起到調節糖脂代謝、抑制炎性反應、改善胰島素抵抗、促進內皮細胞增殖與遷移等作用[13]。本研究結果顯示病例組血清CTRP3水平較對照組降低,CTRP3水平下降可加重OSAHS合并T2DM患者下肢血管病變的發生風險,是其保護因素。血清CTRP3通過抑制炎性因子,發揮抗炎和抗動脈硬化的作用,而炎癥是下肢血管病變的主要發病機制[14]。OSAHS患者長期間歇低氧血癥,導致炎性因子水平增高,引發炎性反應,隨著CTRP3水平的降低,炎性反應增強,導致大量單核巨噬細胞向血管內膜浸潤,促進動脈硬化及血栓形成。正常情況下血清SLOX-1幾乎不表達,病理狀況下在血管內皮細胞豐富表達,可介導血管內皮的激活、功能失調和損傷[15]。本研究中病例組血清SLOX-1水平較對照組升高,加重發生下肢血管病變的風險,是其獨立危險因素。趙永才等[16]在對老年T2DM患者并發下肢血管病變的研究中指出,血清SLOX-1與下肢血管病變呈負相關,與本研究結果基本一致。SLOX-1可以通過特異性結合、攝取氧化低密度脂蛋白參與動脈硬化的形成,反映斑塊的不穩定狀況、復雜程度和疾病嚴重程度[17]。OSAHS合并T2DM患者由于低氧刺激可誘導急性期蛋白基因及相關細胞因子的表達增加,誘導血清SLOX-1水平上升,并發炎性反應。而SLOX-1是血管內皮細胞功能障礙、血脂紊亂與動脈硬化發生相關聯的主要受體,一方面可抑制血管內皮細胞的活性功能,加速單核細胞、平滑肌細胞和巨噬細胞泡沫化,堆積形成動脈硬化斑塊;另一方面可介導血管平滑肌細胞增殖和遷移,誘導細胞凋亡,加速動脈硬化進程[18]。從而增加了OSAHS合并T2DM患者下肢血管病變發生風險。
綜上所述,早期發現,提早干預,防止OSAHS病情加重,改善低氧狀況,可降低T2DM患者下肢血管病變發生風險,最大限度減少T2DM并發癥的危害。血清CTRP3水平下降,SLOX-1水平升高為OSAHS合并T2DM患者下肢血管病變發病機制之一,有望成為預測OSAHS合并T2DM患者下肢血管病變的生物學標志物及治療新靶點。

