曲古霉素通過自噬途徑對K7M2 wt細(xì)胞凋亡的影響*
汪 瑜,羅梅懿,黃 歆,宋永丹,陳維永△
(1.四川省成都市第七人民醫(yī)院/四川省成都市腫瘤醫(yī)院 610041;2.四川省醫(yī)學(xué)科學(xué)院·四川省人民醫(yī)院,成都 610072)
骨肉瘤是常見的骨原發(fā)性惡性腫瘤,主要發(fā)生于兒童和青少年的股骨遠(yuǎn)端和脛骨近端等長骨部位[1]。骨肉瘤起源于間葉組織,惡性程度和侵襲性高,易轉(zhuǎn)移,尤其是易轉(zhuǎn)移至肺部。早先對骨肉瘤最主要的治療方式是外科切除手術(shù),治療效果較差,患者生存率低于20%[2]。近年來,隨著化療在骨肉瘤中的應(yīng)用,患者生存率提高至70%以上,但仍未達(dá)到人們的期望水平[3]。因此,尋找一種靈敏度高、不良反應(yīng)小的抗骨肉瘤藥物成為臨床和基礎(chǔ)研究中需迫切解決的問題。曲古霉素(trichostatin A,TSA)是一種組蛋白去乙酰化酶抑制劑,對乳腺癌[4]、肝癌[5]、骨肉瘤[6]等多種腫瘤均有抑制作用,但其抗腫瘤機(jī)制尚不明確。細(xì)胞凋亡是指受基因控制的主動性程序性死亡。自噬是細(xì)胞自我保護(hù)的一種手段,通過自噬清除受損蛋白質(zhì)和細(xì)胞器,克服營養(yǎng)缺乏或低氧等環(huán)境,從而促進(jìn)腫瘤細(xì)胞的生存和發(fā)展。細(xì)胞凋亡和自噬與腫瘤的發(fā)生、發(fā)展有緊密聯(lián)系,通過凋亡和自噬途徑研究腫瘤相關(guān)機(jī)制已成為腫瘤領(lǐng)域研究熱點(diǎn)之一[7]。研究發(fā)現(xiàn)TSA殺傷乳腺癌細(xì)胞時,能夠促進(jìn)細(xì)胞的凋亡和上調(diào)自噬水平[8],而自噬在TSA殺傷骨肉瘤中的作用還未見報道。因此,本研究旨在探討自噬在TSA抑制骨肉瘤細(xì)胞增殖和誘導(dǎo)骨肉瘤細(xì)胞凋亡中的作用,為TSA治療骨肉瘤提供理論依據(jù),也為抗腫瘤藥物的研究提供新思路,現(xiàn)報道如下。
1 材料與方法
1.1材料
1.1.1細(xì)胞與試劑 小鼠骨肉瘤K7M2 wt細(xì)胞和DMEM高糖培養(yǎng)基購于武漢普諾賽公司;胎牛血清購于美國Clark公司;胰酶、雙抗購于美國Hyclone公司;CCK-8及Western blot相關(guān)試劑購于合肥Biosharp公司;異硫氰酸熒光素標(biāo)記的膜聯(lián)蛋白V(Annexin V-FITC)/碘化丙啶(PI)雙染細(xì)胞凋亡檢測試劑盒購于江蘇凱基生物公司;Bax、Bcl-2、Beclin-1、LC3抗體購于美國Abcam公司;氯喹(Chloroquine,CQ)購于美國Sigma公司。
1.1.2儀器 臺式低速離心機(jī)(TDZ4-WS,長沙湘儀離心機(jī)儀器有限公司);二氧化碳培養(yǎng)箱(MCO-15AC,上海三洋電機(jī)國際貿(mào)易有限公司);酶標(biāo)儀(Multlskan,蘇州賽默飛世爾儀器有限公司);流式分析儀(Cytoflex,美國Beckman公司)。
1.2方法
1.2.1細(xì)胞培養(yǎng) K7M2 wt細(xì)胞培養(yǎng)在含10%胎牛血清的DMEM高糖培養(yǎng)基,培養(yǎng)條件5% CO2、37 ℃的培養(yǎng)箱。細(xì)胞生長至80%融合度時,進(jìn)行傳代或進(jìn)行實(shí)驗(yàn)。
1.2.2CCK-8法檢測細(xì)胞增殖率 取培養(yǎng)的K7M2 wt細(xì)胞,調(diào)整細(xì)胞濃度為4×104/mL,接種于96孔板,繼續(xù)培養(yǎng),待細(xì)胞貼壁后,分別加入終濃度為50、100、200、400、600 nmol/L 的TSA,同時設(shè)置對照組(TSA濃度為0),每組設(shè)6個復(fù)孔。繼續(xù)培養(yǎng)12、24、48 h后,每孔加入10 μL CCK-8,4 h后終止培養(yǎng),用酶標(biāo)儀(450 nm)測定各孔細(xì)胞吸光度(OD)值。選出TSA實(shí)驗(yàn)時基礎(chǔ)濃度,并計算各組細(xì)胞存活率及半數(shù)致死濃度(IC50)。細(xì)胞存活率=(藥物組平均OD值/對照組平均OD值)×100%。
1.2.3流式細(xì)胞術(shù)檢測細(xì)胞凋亡率 取培養(yǎng)的K7M2 wt細(xì)胞,調(diào)整濃度為4×106/mL,接種于6孔板,繼續(xù)培養(yǎng)至貼壁后,用TSA的基礎(chǔ)濃度及倍數(shù)濃度與抑制劑CQ單獨(dú)或聯(lián)合作用處理24、48 h,離心收集細(xì)胞,用磷酸鹽緩沖液(PBS)重懸細(xì)胞后,分別加入5 μL Annexin V和5 μL PI,混勻后,室溫(20~25 ℃)避光孵育15 min。1 h內(nèi)上機(jī)檢測各組細(xì)胞凋亡情況,實(shí)驗(yàn)重復(fù)3次。
1.2.4Western blot檢測各蛋白表達(dá)情況 收集經(jīng)實(shí)驗(yàn)預(yù)處理的K7M2 wt細(xì)胞,提取各組細(xì)胞總蛋白并用BCA法進(jìn)行定量。各組取等量蛋白質(zhì)用10%的十二烷基硫酸鈉聚丙烯酰胺凝膠(SDS-PAGE)電泳進(jìn)行分離,分離后的蛋白質(zhì)轉(zhuǎn)移至聚偏氟乙烯(PVDF)膜上,用5%的脫脂奶粉封閉1 h后,結(jié)合一抗(Bax、Bcl-2、Beclin-1、LC3按1∶1 000稀釋,β-actin按1∶400稀釋),4 ℃孵育過夜后TBST清洗,然后二抗IgG(稀釋比例均為1∶5 000)室溫孵育1 h,TBST清洗,ECL暗室顯色。顯色后的蛋白使用Bio-Rad全功能成像系統(tǒng)采集圖像,Image-ProPlus分析光密度,以β-actin為內(nèi)參,計算各組蛋白質(zhì)的相對表達(dá)水平,實(shí)驗(yàn)重復(fù)3次。
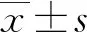
2 結(jié) 果
2.1TSA抑制K7M2 wt細(xì)胞增殖 用不同濃度TSA分別作用K7M2 wt細(xì)胞12、24、48 h,細(xì)胞存活率均受到抑制,且呈明顯濃度依賴性和時間依賴性。TSA對骨肉瘤細(xì)胞12、24和48 h的IC50分別為1 061、539和338 nmol/L。選用338 nmol/L TSA作為后期實(shí)驗(yàn)的基礎(chǔ)濃度,見圖1。

圖1 不同濃度TSA對K7M2 wt細(xì)胞存活率的影響
2.2TSA促進(jìn)K7M2 wt細(xì)胞凋亡 分別用不同濃度TSA[0(對照組)、169、338和676 nmol/L]處理細(xì)胞48 h后,隨著TSA濃度升高,細(xì)胞凋亡率也升高。與對照組比較,各TSA濃度組細(xì)胞凋亡率均顯著升高(P<0.01),見圖2。

a:P<0.05,與對照組比較
圖2TSA誘導(dǎo)骨肉瘤K7M2wt細(xì)胞凋亡

a:P<0.05,與對照組比較
圖3TSA對K7M2wt細(xì)胞凋亡及自噬相關(guān)蛋白的影響

a:P<0.05,與對照組比較
圖4CQ和TSA聯(lián)用促進(jìn)K7M2wt細(xì)胞凋亡
2.3Western blot檢測凋亡及自噬相關(guān)蛋白 用Western blot檢測凋亡相關(guān)蛋白表達(dá)變化,結(jié)果顯示用不同濃度TSA處理K7M2 wt細(xì)胞24 h后,促凋亡蛋白caspase-3和Bax表達(dá)水平均顯著上調(diào),抗凋亡蛋白Bcl-2表達(dá)顯著下調(diào);自噬相關(guān)蛋白Beclin-1和LC3-Ⅱ表達(dá)水平同樣顯著上調(diào)(P<0.05)。以676 nmol/L TSA變化最顯著,見圖3。
2.4CQ和TSA聯(lián)用對細(xì)胞凋亡的影響 用流式細(xì)胞術(shù)檢測自噬抑制劑CQ和TSA對細(xì)胞凋亡的影響,與對照組比較,CQ和TSA單獨(dú)作用或聯(lián)用均能顯著提高K7M2 wt細(xì)胞凋亡率,且聯(lián)用后細(xì)胞凋亡率顯著高于CQ和TSA單獨(dú)作用(P<0.05),表明CQ可以協(xié)同增效TSA誘導(dǎo)的K7M2 wt細(xì)胞凋亡,見圖4。
2.5CQ和TSA聯(lián)用對細(xì)胞凋亡及自噬相關(guān)蛋白的影響 Western blot檢測結(jié)果顯示,CQ能夠抑制Beclin-1和LC3-Ⅱ蛋白的表達(dá),與對照組比較,差異有統(tǒng)計學(xué)意義(P<0.05)。與對照組比較,CQ處理后促凋亡蛋白caspase-3和Bax表達(dá)上調(diào),Bcl-2表達(dá)下調(diào),其中CQ和TSA聯(lián)合作用的蛋白變化最為顯著(P<0.05),見圖5。

a:P<0.05,與對照組比較
圖5CQ和TSA聯(lián)用對K7M2wt細(xì)胞凋亡及自噬相關(guān)蛋白的影響
3 討 論
組蛋白去乙酰化是抑癌基因失活的重要機(jī)制之一,如何抑制組蛋白去乙酰化的水平,對于抗腫瘤研究具有重要的意義[9]。組蛋白去乙酰化酶抑制劑能夠抑制組蛋白去乙酰化,進(jìn)而抑制腫瘤細(xì)胞的增殖和分化,是一類有極大應(yīng)用價值的抗腫瘤藥物。TSA是第1個被發(fā)現(xiàn)的具有抑制組蛋白去乙酰化酶作用的天然產(chǎn)物。本研究通過體外培養(yǎng)小鼠骨肉瘤K7M2 wt細(xì)胞,探討TSA對K7M2 wt細(xì)胞存活率的影響,結(jié)果發(fā)現(xiàn)TSA可顯著抑制K7M2 wt細(xì)胞的存活,且呈濃度和時間依賴性。這與HEPP等[10]研究TSA對白血病細(xì)胞抑制作用相一致。
細(xì)胞凋亡是受多基因精確控制的程序性死亡。大多數(shù)抗腫瘤藥物都能引起腫瘤細(xì)胞凋亡,因此,誘導(dǎo)腫瘤細(xì)胞凋亡的能力成為評價抗腫瘤藥物藥效的主要指標(biāo)之一[11]。本研究發(fā)現(xiàn),用169 nmol/L TSA處理K7M2 wt細(xì)胞48 h后,細(xì)胞凋亡率明顯升高,隨著TSA濃度的增加,K7M2 wt細(xì)胞凋亡率增加。同時Western blot實(shí)驗(yàn)結(jié)果顯示TSA處理后,K7M2 wt細(xì)胞中促凋亡蛋白caspase-3和Bax表達(dá)上調(diào),而抗凋亡蛋白Bcl-2明顯下調(diào)。表明TSA能夠誘導(dǎo)K7M2 wt細(xì)胞發(fā)生凋亡。
自噬是不依賴caspase途徑的細(xì)胞程序性死亡,與細(xì)胞凋亡關(guān)系密切[12]。為了進(jìn)一步完善TSA抑制骨肉瘤細(xì)胞增殖的作用機(jī)制,筆者進(jìn)行了探究。Beclin-1能夠正向調(diào)控細(xì)胞自噬,是自噬形成的重要參與者[13]。LC3參與自噬體膜的形成,包括LC3-Ⅰ和LC3-Ⅱ兩種形式,其中LC3-Ⅱ定位于自噬體膜,是自噬體的分子標(biāo)志物[14]。本實(shí)驗(yàn)用不同濃度的TSA處理K7M2 wt細(xì)胞24 h后,發(fā)現(xiàn)Beclin-1和LC3-Ⅱ蛋白表達(dá)上調(diào),且呈濃度依賴性,表明TSA能夠誘導(dǎo)K7M2 wt細(xì)胞自噬的發(fā)生。
為了探究TSA對K7M2 wt細(xì)胞作用時自噬和凋亡的關(guān)系,本研究用自噬抑制劑CQ和TSA聯(lián)合作用細(xì)胞,分析細(xì)胞凋亡的變化,結(jié)果發(fā)現(xiàn)CQ聯(lián)合TSA能夠有效降低自噬相關(guān)蛋白Beclin-1和LC3-Ⅱ的表達(dá),進(jìn)一步增加細(xì)胞凋亡率和提高凋亡相關(guān)蛋白caspase-3和Bax的表達(dá),降低Bcl-2的表達(dá),提示TSA誘導(dǎo)的自噬被抑制后,提高了K7M2 wt細(xì)胞凋亡。這與周憲春等[8]報道的自噬抑制劑3-MA能夠提高TSA誘導(dǎo)T47D細(xì)胞凋亡相同。
綜上所述,本研究發(fā)現(xiàn)TSA能夠抑制K7M2 wt細(xì)胞的增殖,作用機(jī)制可能與誘導(dǎo)細(xì)胞凋亡相關(guān);自噬在TSA誘導(dǎo)K7M2 wt細(xì)胞凋亡過程中對細(xì)胞起保護(hù)作用,當(dāng)加入自噬抑制劑CQ后,降低了自噬對細(xì)胞凋亡的保護(hù)作用,從而導(dǎo)致細(xì)胞凋亡率升高。本研究證明TSA誘導(dǎo)K7M2 wt細(xì)胞凋亡可能是通過自噬途徑,但TSA通過哪些具體的通路介導(dǎo)K7M2 wt細(xì)胞發(fā)生自噬及自噬途徑如何調(diào)控K7M2 wt細(xì)胞凋亡仍不明確,TSA在體內(nèi)能否促進(jìn)骨肉瘤細(xì)胞的凋亡也不明確。因此,在后期研究中需要進(jìn)一步探究TSA介導(dǎo)K7M2 wt細(xì)胞發(fā)生自噬及自噬介導(dǎo)細(xì)胞凋亡的具體機(jī)制,并進(jìn)行裸鼠骨肉瘤體內(nèi)治療實(shí)驗(yàn)研究,進(jìn)一步研究TSA的治療效果。

