實時CEUS評估甲狀腺乳頭狀癌侵襲性及其與病理微血管密度的關系
周 易,梁 蕾,孟曉暄,盧一艷,郭 君
(北京大學航天臨床醫學院 航天中心醫院超聲科,北京 100049)
甲狀腺乳頭狀癌(papillary thyroid carcinoma, PTC)是最常見的甲狀腺惡性腫瘤[1]。目前超聲是評估甲狀腺腫瘤的首選影像學方法,能夠全面評價甲狀腺結節的位置、大小、形態和性質,且實時CEUS還能進一步反映腫瘤微循環灌注情況。病理微血管密度(microvessel density, MVD)是常用的量化及預測腫瘤血管生成的指標[2]。本研究探討PTC的CEUS特征及其與病理MVD的關系,旨在為評估PTC的侵襲性提供影像學依據。
1 資料與方法
1.1 一般資料 選取2016年1—12月在我院接受診治并經病理證實的52例PTC患者,男17例,女35例,年齡19~84歲,平均(42.7±12.9)歲。所有患者均接受手術切除+頸部淋巴結清掃,并根據病理檢查淋巴結結果分為轉移組(n=28)和未轉移組(n=24)。
1.2 儀器與方法
1.2.1 超聲檢查 采用Philips iU22彩色超聲診斷儀,L9-3探頭,頻率3~9 MHz。囑患者仰臥,充分暴露頸部。首先行二維超聲檢查,觀察甲狀腺結節的位置、大小、形態、邊界、縱橫比、內部回聲、后方回聲、有無鈣化及與被膜接觸程度等;對可疑惡性結節行CEUS,選擇脈沖反相諧波造影條件,機械指數0.07,造影劑采用聲諾維,劑量2.4 ml,經肘靜脈團注,隨后注入5 ml生理鹽水。囑患者在注入造影劑后保持體位,不移動、不說話、勿吞咽;在注射造影劑的同時啟動圖像采集,選擇病灶最大縱切面,觀察甲狀腺病灶在160 s內的回聲變化。
1.2.2 實時CEUS定量分析 采用QLAB定量分析軟件對甲狀腺ROI進行動態分析,分別在結節中心區與周邊區放置取樣框,以結節最大徑的內1/2類圓形區域為結節中心區,剩余環形區域為結節周邊區,然后描記結節輪廓;如結節與周圍正常組織分界不清或結節呈分葉狀,則以分界清楚部分確定最大徑,或包括分葉在內選定最大徑。軟件自動獲得甲狀腺病變各部分血流灌注時間-強度曲線及定量參數,包括達峰時間(time to peak, TTP)、峰值強度(peak intensity, PI)、AUC以及擬合曲線上升支斜率和下降支斜率。
1.2.3 MVD計數方法 手術切除標本均以10%甲醛溶液固定,常規處理后石蠟包埋,厚度4 μm連續切片,600℃烘烤過夜,并分別進行HE和免疫組織化學染色。采用EnVision兩步法進行CD34免疫組織化學染色。
本研究在Weidner計數方法的基礎上,采用Tissue FAXS PLUS(Tissue Gnostics GmbH)全景組織細胞定量分析系統進行甲狀腺CD34免疫組織化學切片圖像采集和病灶內MVD分析。以Tissue FAXS軟件自動識別組織區域,利用20倍物鏡對全玻片免疫組織化學圖像進行多視野(單視野面積0.23 mm2)自動成像和圖像自動無縫拼接,最終獲取200倍組織全景圖及細胞解析度圖像;然后利用Strata Quest(Tissue Gnostics GmbH)軟件對結節中心和周邊區域(選擇方法同上)MVD進行分析,獲得MVD計數。
1.3 統計學分析 采用SPSS 18.0統計分析軟件。符合正態分布的計量資料以±s表示,對轉移組與未轉移組間、結節中心與結節周邊采用t檢驗比較。采用Pearson相關分析評價病理MVD與CEUS指標的相關性。P<0.05為差異有統計學意義。
2 結果
2.1 PTC中CD34的表達 PTC中,多數CD34陽性血管內皮細胞位于乳頭的纖維血管軸心,呈節段性分布,濾泡亞型PTC常見微血管位于濾泡之間的間質中;腫瘤內壞死纖維區域多無陽性血管內皮細胞,纖維結締組織呈非特異性著色,與背景分界不清;腫瘤周邊血管分布較密集,部分癌巢呈浸潤性生長,與周圍正常甲狀腺組織分界不清,也可呈非特異性著色(圖1、2)。
2.2 MVD比較 52例PTC中MVD分布不均,結節總體MDV計數平均值為(276.81±95.49)個/mm2,結節周邊區MVD計數平均值[(296.94±107.72)個/mm2]高于中心區平均值[(256.68±92.08)個/mm2],差異有統計學意義(t=0.024,P=0.041)。轉移組結節周邊MVD計數高于未轉移組(P=0.039),2組結節中心區MVD計數差異無統計學意義(P=0.200),見表1。
表1 轉移組與未轉移組PTC患者MVD計數比較(個/mm2,±s)
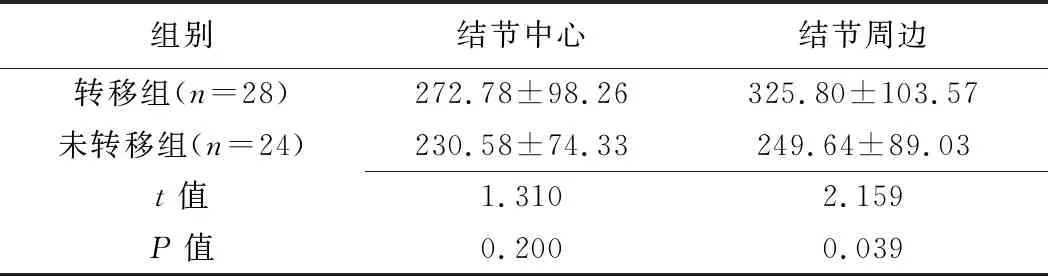
表1 轉移組與未轉移組PTC患者MVD計數比較(個/mm2,±s)
組別結節中心結節周邊轉移組(n=28)272.78±98.26325.80±103.57 未轉移組(n=24)230.58±74.33 249.64±89.03 t值1.3102.159P值0.2000.039
2.3 CEUS定量參數與MVD的相關性 結節周邊區時間-強度曲線AUC與結節周邊區、結節總體MVD計數呈正相關(r=0.45、0.41,P均<0.05),余參數間均未見明顯相關性,見表2。
3 討論
常用MVD計數方法中,需避開腫塊內出血、壞死及液化區域,計數腫瘤內“熱點”的血管密度(high-MVD, hMVD);但腫瘤周邊與正常組織接觸區域腫瘤生長活躍,新生血管豐富,腫瘤中心常發生壞死纖維
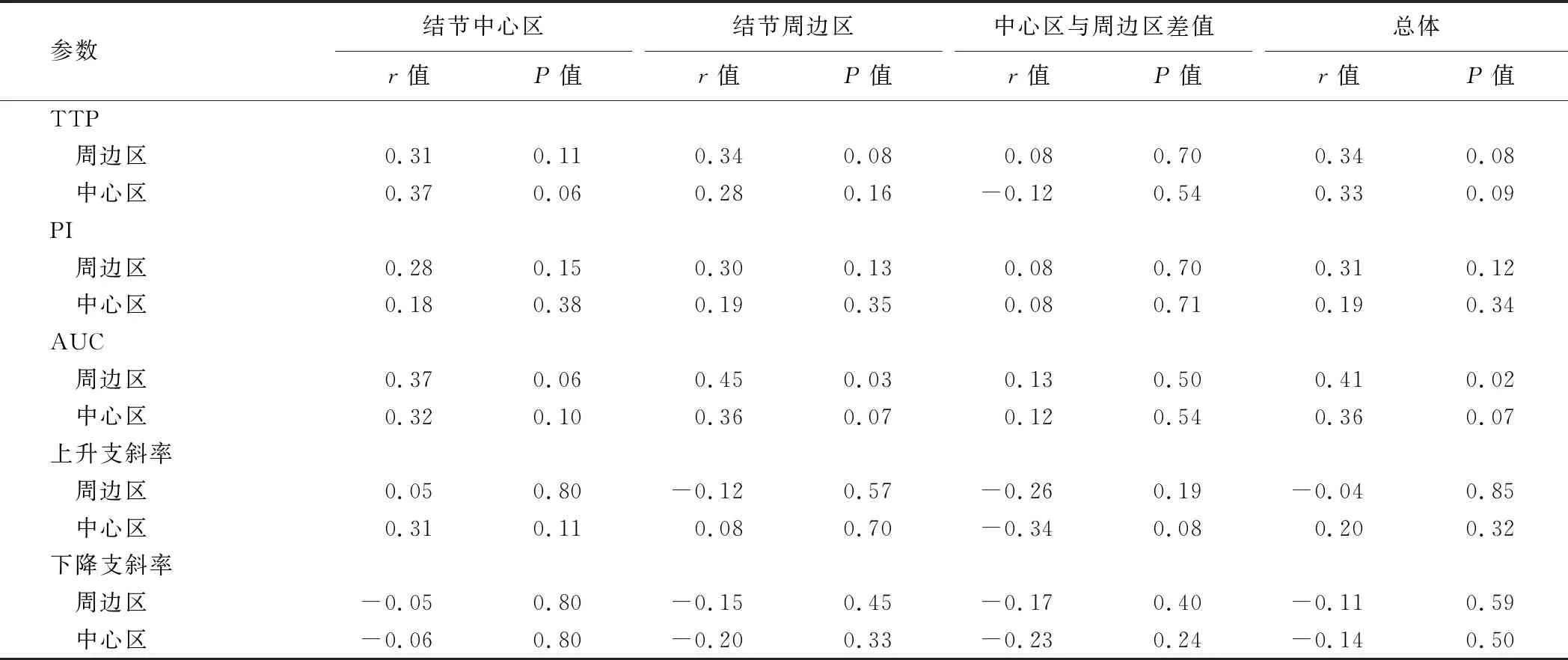
表2 PTC的CEUS定量參數與MVD計數的相關性
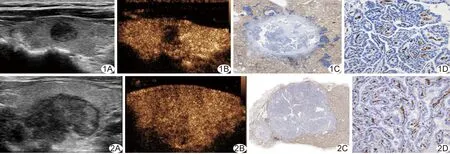
圖1 PTC患者,男,33歲,未轉移組 A.二維超聲示甲狀腺右葉中部低回聲結節,邊界清,形態規則; B.CEUS呈低增強; C.結節CD34染色全景圖像示結節中心區及周邊區可見多發壞死及纖維化區域(CD34染色,×10); D.結節內微血管呈特異性棕黃色染色,結節中心區MVD計數為85.88個/mm2,周邊區為99.93個/mm2(CD34染色,×200) 圖2 PTC患者,女,47歲,轉移組 A.二維超聲示甲狀腺右葉低回聲結節,邊界欠清,形態不規則,內可見點狀鈣化; B.CEUS呈等增強; C.結節CD34染色全景圖像顯示結節微血管豐富(CD34染色,×10); D.結節內微血管呈特異性棕黃色染色,結節中心區MVD計數為395.55個/mm2,周邊區為417.71個/mm2(CD34染色,×200)
化,血供減少,且局部區域的MVD難以反映腫瘤的整體微血管灌注。本研究在既往MVD計數方法的基礎上,運用Tissue FAXS PLUS全景組織細胞定量分析系統,使計數區域與腫瘤CEUS分析區相對應,在同一計數標準下分別獲得腫瘤中心區與周邊區域整體MVD計數,能更加真實地反映腫瘤微血管的生成情況。
CEUS評估腫瘤內MVD已廣泛用于肝臟腫瘤、前列腺癌、腎臟腫瘤等方面,且CEUS特征及定量參數與MVD具有相關性[3-6]。Du等[7]認為乳腺病變中高MVD組與低MVD組的CEUS模式不同,高MVD組的CEUS表現為非均勻增強伴有灌注缺損。本研究也發現PTC結節MVD不均,周邊區MVD計數高于中心區,同時轉移組結節周邊MVD計數高于未轉移組。其原因可能是腫瘤新生毛細血管由腫瘤周圍宿主組織原有小血管壁發出,并由外向內生長,腫瘤周邊細胞增殖活躍,但腫瘤細胞的生長速度快于微血管的形成速度,使中心區域易出現缺血壞死及血管重構,故結節整體MVD有所差異,且結節中心區MVD通常低于結節周邊區;而發生頸部淋巴結轉移的PTC具有更高的侵襲性,代謝水平更高,周邊腫瘤細胞增殖更活躍,微循環灌注更豐富,故轉移組周邊MVD較未轉移組更高,而結節中心MVD無顯著性差異。
本研究發現PTC結節周邊區、結節總體MVD計數與結節周邊區時間-強度曲線的AUC呈正相關(r=0.45、0.41,P均<0.05)。Liu等[8]同樣發現乳腺癌CEUS周邊強化組的腫瘤周邊MVD明顯高于非周邊強化組。Kabakci等[9-12]認為腫瘤CEUS定量分析時間-強度曲線中的AUC參數與腫瘤MVD相關。腫瘤內微血管形成是CEUS的基礎,時間-強度曲線的AUC反映造影劑進入ROI的總體情況,代表病變內ROI的平均血流量,能夠反映腫瘤微循環灌注情況。因此,PTC結節不同部位的MVD和相應部位的CEUS定量參數能夠更準確地反映腫瘤真實微循環情況,結節周邊區時間-強度曲線的AUC與結節周邊MVD具有相關性。
總之,CEUS定量分析對評估PTC的侵襲性具有重要價值;病理MVD可為評價PTC的侵襲性提供病理學依據。
(致謝:衷心感謝Tissue Gnostics China Division提供的全景組織細胞定量分析系統對課題的支持,誠摯感謝莊新品博士在微血管密度MVD計數中對課題的幫助。)

