右旋糖酐酶開發及應用研究進展
常國煒 黃曾慰 黎志德 梁達奉
(廣東省生物工程研究所(廣州甘蔗糖業研究所)廣東省酶制劑與生物催化工程技術研發中心,廣州 510316)
右旋糖酐是一種聚D-葡萄糖,在自然界中由微生物產生,是一種胞外多糖。右旋糖酐中葡萄糖殘基以 α-1,6 糖苷鍵連接成主鏈,α-1,2-、α-1,3-和α-1,4-糖苷鍵連接成支鏈,不同微生物產生的右旋糖酐結構上有差異[1]。但分子量一般較大,黏度較高[2]。右旋糖酐與多種生命現象有關。例如,細菌黏附于物體表面時會分泌出多種物質將自身包繞,形成大量細菌聚集膜樣物[3]。這種膜樣物稱為生物被膜,是細菌為適應自然環境以利于生存的生命現象,而某些細菌生物被膜中含有右旋糖酐,這有助于細菌的聚集和黏附[4]。此外,右旋糖酐及其改性物或復合物已被廣泛研究,研究方向包括用于糖肽或多糖富集的材料[5]、抗菌生物醫學材料[6]、抗氧化劑[7]等。
右旋糖酐酶(EC 3.2.1.11)是一類可以水解右旋糖酐內α-1,6糖苷鍵的酶。酶解使右旋糖酐分子量降低,導致性質改變。可產生右旋糖酐酶的菌種種類繁多、分布廣泛,一直有新的性能優良的右旋糖酐酶被發現。在國外,右旋糖酐酶早已開發成用于制糖行業的商品化酶制劑。隨著各種新理論的提出,有關右旋糖酐酶應用機理的研究仍有持續報道。特定分子量的右旋糖酐及其復合物已被用作血漿代用品或抗貧血藥在臨床使用多年,近年來更發現其在食品、材料等領域有著重要用途,利用右旋糖酐酶生產特定分子量右旋糖酐很可能是今后的發展趨勢。右旋糖酐酶還作為一種工具,協助探索各種生物學現象。隨著相關研究及糖生物學的發展,對右旋糖酐酶的深入研究具有重要意義。與此前的綜述不同,本文將結合本團隊的研究成果,對右旋糖酐酶開發的全過程與各領域應用的最新研究成果進行綜述,并討論開發和應用階段所遇到的問題,旨在以問題為導向,討論有關右旋糖酐酶的研發方向。
1 右旋糖酐酶開發研究
右旋糖酐酶制劑在國外早已產業化和商品化,但在國內鮮見,主要原因是國外制糖業深受葡聚糖問題困擾,該酶制劑能較好解決這一問題。而國內制糖業對葡聚糖問題的認識程度普遍不深,或未能對葡聚糖問題產生足夠的重視,所以國內的右旋糖酐酶制劑開發動力不足,開發水平不高。隨著國內制糖業對葡聚糖問題認識的加深,右旋糖酐及其水解產物用量的增大,以及右旋糖酐酶在醫藥領域深層次應用的發展,高效、安全的右旋糖酐酶制劑需求量會越來越大,相應的開發研究亦隨之增加。
1.1 基因工程菌構建、生產菌株篩選和誘變育種
為得到性能優良、能高效表達產物的工業生產菌株,基因工程菌構建、生產菌篩選及育種等均是有效可行的技術,右旋糖酐酶生產菌的獲得自然也離不開上述方法。本團隊通過基因工程方法,將朱黃青霉(Penicillium minioluteum)的右旋糖酐酶基因利用畢赤酵母(Pichia pastoris)進行表達[8];在進一步工作中,構建出組成型表達載體(圖1),實現了右旋糖酐酶在畢赤酵母中的組成型表達,使發酵過程無需使用甲醇進行誘導,提高了生產和使用安全性[9];根據畢赤酵母的密碼子偏愛對酶基因進行優化與合成,使發酵液酶活進一步提高[10]。
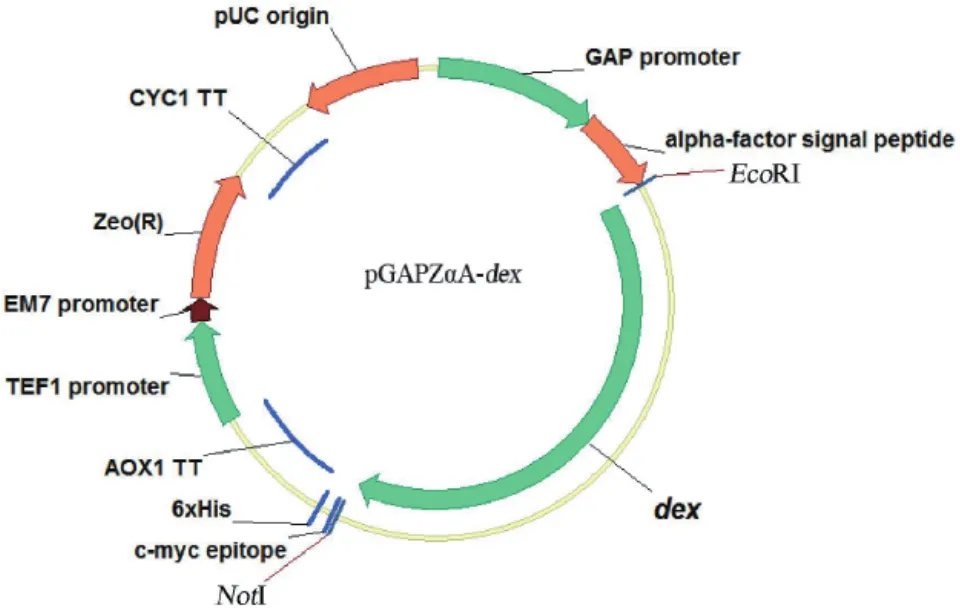
圖1 重組質粒pGAPZαA-dex的結構示意圖[9]
近年來,越來越多右旋糖酐酶產生菌和酶被發現,其中不乏性能優異的右旋糖酐酶(表1)。相當一部分右旋糖酐酶產生菌是霉菌,但霉菌菌株普遍存在產酶活性低的缺點。右旋糖酐酶常用于食品及藥物行業,除了部分霉菌已經通過食藥認證,絕大部分霉菌發酵酶液因可能含有抗生素或有害代謝物而存在安全隱患。所以,已經有可觀的人力物力在尋找細菌替代霉菌生產右旋糖酐酶。有研究人員把目光轉向了海洋細菌,并認為由這些細菌生產的酶制劑具有更高的安全性、更低的最適反應溫度,以及更有實際意義的酶活水平[11-14]。有研究顯示,由于缺乏相關水解酶,右旋糖酐在小腸中一般不被消化降解;但在大腸中,由于乳酸菌(Lactohacillussp.)和雙歧桿菌(Bifidobacteriumsp.)等益生菌的存在而容易被消化[20-21]。而其水解產物——低聚右旋糖酐或低聚異麥芽糖則有促進益生菌生長和增殖的作用[22]。有研究人員在人類糞便分離出多種右旋糖酐酶產生菌[19],這些微生物及所產生的酶可能更適應人體腸道環境,為右旋糖酐酶在人體應用提供一定指導。
1.2 發酵工藝優化
發酵生產是得到高活性酶制劑的重要一環。本團隊構建了多株產右旋糖酐酶的工程菌,同時對其發酵工藝進行了深入研究。對于甲醇誘導的菌株,先在搖瓶階段進行多因素發酵工藝優化[23],再放大到5 L發酵罐進行甲醇流加優化[24]。對于組成型表達工程菌,先在6.8 L發酵罐進行多因素的發酵工藝優化[25-26],再逐級放大到5 t發酵罐發酵,完成了規模化的生產試驗[27]。
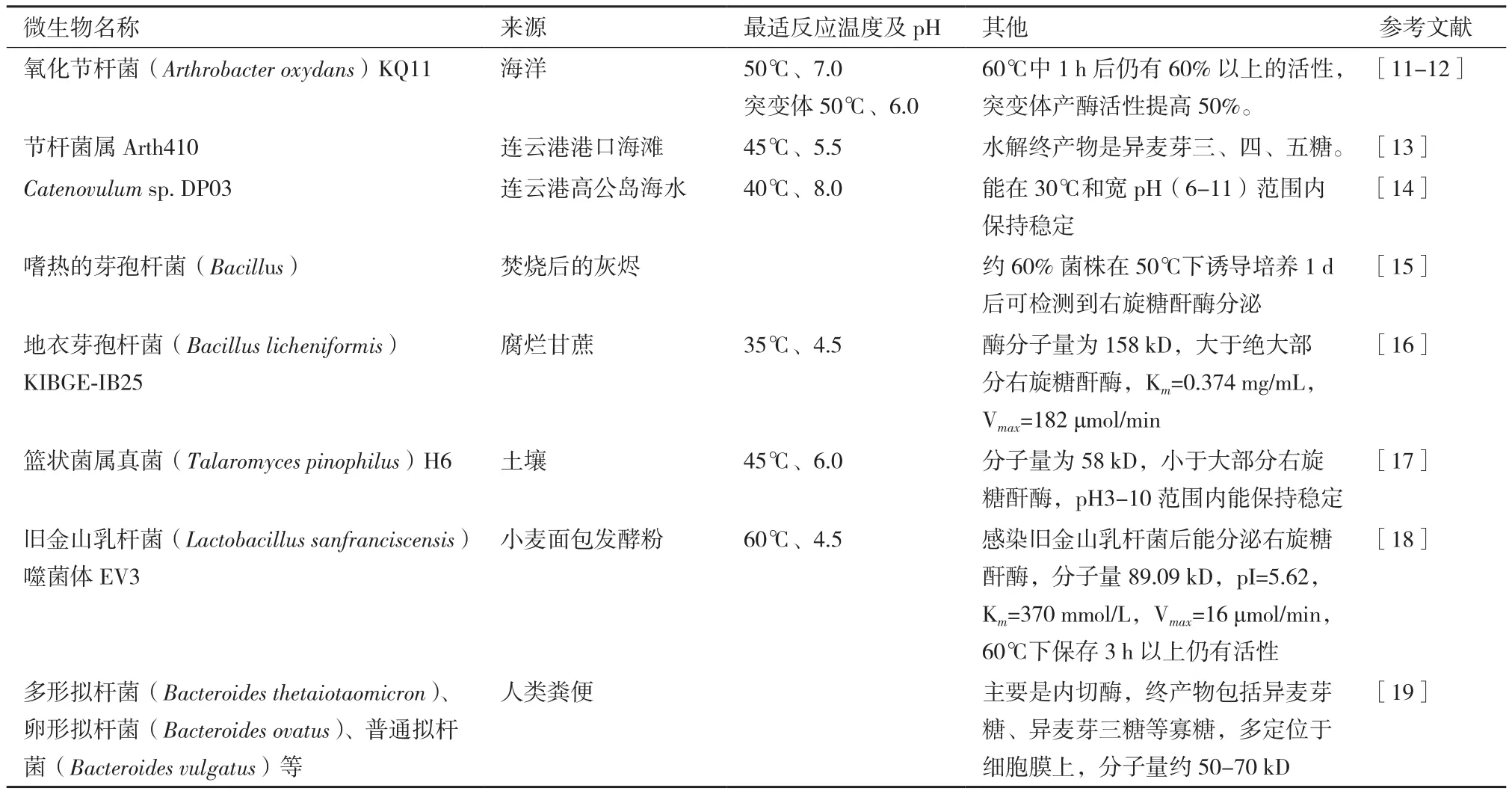
表1 近年發現的右旋糖酐酶產生菌及相關酶學性質
此外,曹研研等[28]優化了棘孢青霉菌(Penicillium aculeatum)F1001產右旋糖酐酶的發酵條件,使酶活力提高了88%。對于個別特殊的微生物,還可以輔以其他手段優化發酵。例如,細麗毛殼(Chaetomium gracile)在發酵過程中會出現菌體絮凝的現象,若輔以一定強度的低頻超聲作用,可以令絮凝現象顯著緩解,提高生理活性和產酶效率[29]。以上研究均只在小規模發酵體系中進行,并未在大規模發酵中進一步研究。
1.3 酶的純化、穩定性和固定化研究
在不同的使用場景下,對右旋糖酐酶的純度要求是不一樣的。本團隊在右旋糖酐酶的純化方面亦做了大量工作,為大規模純化打下基礎。其中,雙水相體系純化法和離子交換色譜法所用儀器簡易,所用試劑常見、無毒,整個實驗易于放大,并取得了良好的效果[30-31]。
酶的穩定性表征一般包括熱穩定性和pH穩定性,提高穩定性的常用方法是添加保護劑。本團隊所研究的右旋糖酐酶可用較高濃度的葡萄糖、蔗糖或甘油作保護劑[8,32]。有研究表明,一定比例的甘油、乙酸鈉和檸檬酸鈉混合水溶液是良好的右旋糖酐酶穩定劑,同時加以少量對羥基苯甲酸復方醋酸鈉、異抗壞血酸鈉和山梨酸鉀作為防腐劑,可大大延長酶的保存時間[33]。由于該酶制劑會在食品和醫藥行業中應用,所以后續研究中需關注各種添加劑是否會影響產品的質量。
為了使酶穩定、持久地發揮作用,固定化是一種有效的技術。Bertrand等[34]構建的固定化酶反應器可連續運作90 h和穩定儲存78 d;Shahid等[35]將右旋糖酐酶固定化在殼聚糖水凝膠微球上,熱穩定性顯著提高,連續循環使用14個周期酶活還有42%。固定化右旋糖酐酶常用于制備低分子量右旋糖酐或低聚異麥芽糖,酶活不穩定很可能造成生產不穩定,所以如何進一步提高右旋糖酐酶的穩定性值得繼續深入研究。
1.4 酶活性增強研究
通過添加金屬離子可提高酶活,但不同的酶對于不同濃度金屬離子可能有不同的效果。例如,有研究在反應體系中添加10 mmol/L Co2+可令該種右旋糖酐酶酶活提高96%[11],但在另一個研究中,添加2 mmol/L Co2+卻令另一來源的酶酶活下降至原來的62%[8]。有研究顯示,聯合運用超聲和高靜水壓可提高酶活,并發現該條件下的酶分子構象變化,包括分子表面色氨酸殘基增多,α-螺旋增加,無規卷曲減少[36]。類似地,聯合運用超聲和微波輻射亦可提高酶活,原因是酶分子的二級結構重構,該方法可在包括食品加工等工業應用中提高右旋糖酐酶的活性[37]。
1.5 酶的其他基礎研究
酶的其他基礎研究包括酶的結構、催化活性中心、作用模式、動力學和熱力學數據等,這些信息對理解酶的行為模式和改進酶的性能有著極其重要的作用,是當前急需進行的研究。利用超高效液相色譜-四極桿飛行時間質譜聯用,可高效、靈敏、直觀地分析整個酶解過程[38];Suzuki等[39]對一種耐高溫右旋糖酐酶進行了結構分析(圖2),認為環狀結構的缺失、鹽橋和表面暴露的殘留電荷這幾個結構特征可能有助于提高熱穩定性。Okazawa等[40]則詳細分析球形節桿菌(Arthrobacter globiformils)T6分泌的右旋糖酐酶結構及進化關系,為酶的工程改造奠定了基礎。Bhatia等[41]對淡紫色擬青霉(Paecilomyces lilacinus)分泌的兩種右旋糖酐酶進行研究,推測參與催化的基團可能是天冬氨酸殘基或谷氨酸殘基的羧基或組氨酸殘基的咪唑基;在其他研究中,利用親和標記試劑改性后,分析其失活動力學,得到了類似的結論[42]。
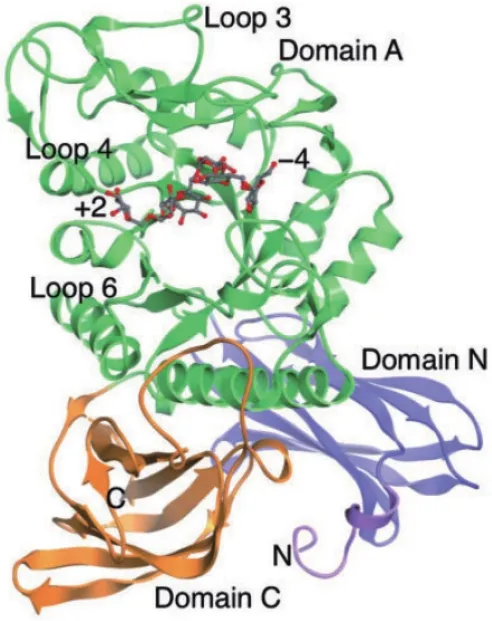
圖2 TpDex與異麥芽六糖的復合物結構圖[39]
2 右旋糖酐酶應用研究
2.1 應用于抑制口腔微生物生物被膜的研究
早在 1969年,Gibbons和 Fitzgerald[43]就指出變異鏈球菌(Streptococcus mutans)產生的右旋糖酐誘導變異鏈球菌的聚集和牙菌斑的形成。到了1971年,已有用含右旋糖酐酶的漱口水來處理牙菌斑的研究報道[44]。隨著生物被膜的深入研究,Flemming和Wingernder詳細闡述了生物被膜基質組成和結構,了解到多糖是胞外聚合物的主要成分之一[3]。可見,右旋糖酐在口腔問題中扮演著重要角色。
近年來,口腔醫學領域的研究人員利用生物被膜理論研究和解釋右旋糖酐酶的作用[11,14,45-46],在動物試驗[13]中直接利用該酶抑制牙菌斑的形成,在人體試驗[47]中利用微生物定植腔產酶方式抑制齲齒形成。Qiu等[48]在體外建立了含有變異鏈球菌、嗜酸乳桿菌(Lactobacillus acidophilus)和黏放線菌(Actinomyces viscosus)的生物被膜系統,通過分別和同時添加右旋糖酐酶和氟化鈉,考察處理后的生物量、內生多糖量和菌體生存量,并用共聚焦激光掃描顯微鏡觀察生物被膜形態,結論是聯合利用右旋糖酐酶和氟化鈉能有效地破壞了變異鏈球菌生物被膜,作用機制可能是右旋糖酐酶水解了右旋糖酐,破壞了生物被膜的結構,促進氟化鈉滲透,從而提高抗菌效果。Senpuku等[49]證明了當右旋糖酐酶存在時,變異鏈球菌無法聚集。除了傳統地用單一的酶來處理生物被膜,也有采用特殊的嵌合酶來處理的。Otsuka等[50]將來自Paenibacillus humicusNA1123的非水溶性葡聚糖酶(可以水解多糖中的α-1,3糖苷鍵)基因和變異鏈球菌ATCC 25175的右旋糖酐酶基因接入到載體中,在大腸桿菌(Escherichia coli)BL21(DE3)中表達并部分純化,得到一個具有兩種功能的嵌合酶,考察處理后的不溶性葡聚糖量、還原糖量,發現該嵌合酶能顯著降低不溶性葡聚糖量,其破壞生物被膜的效率比兩種酶的混合物高4.1倍。
雖然右旋糖酐酶對于口腔健康有著明確的積極作用,但含右旋糖酐酶的口腔清潔用品的占比仍不高。究其原因,機械力才是清潔牙齒的主要力量,酶作用只是一個輔助手段;其次,成本和公眾接受程度也是商家考慮的因素。有趣的是,現在國內市場會把添加右旋糖酐酶作為商品的賣點來提升商品檔次,這種商品一般售價更高。
2.2 應用于制糖生產過程研究
在制糖生產過程,多個環節都適合微生物滋長。腸膜明串珠菌(Leuconoseol mesenteroides)這種常見的微生物會在制糖過程通過發酵蔗糖產生高分子量右旋糖酐,令其摻雜在所有在制品和產品中,對制糖生產造成多種不利影響[51]。而清除右旋糖酐最有效的方法就是添加右旋糖酐酶。本團隊在該方面做了大量的工作。2009/2010年榨季,在廣東某糖廠進行模擬生產工藝試驗,發現使用右旋糖酐酶后蔗汁澄清的各指標都得到明顯改善[8]。2013/14年和2014/15年榨季,本團隊在廣西農墾的多家糖廠(包括甘蔗糖廠和原糖精煉糖廠)中使用右旋糖酐酶,添加方式為在壓榨工段或溶糖箱流加右旋糖酐酶液,均有效地清除了右旋糖酐,并可減少硫熏強度。部分糖廠的右旋糖酐去除率達98%以上,清混汁純度差達2AP以上,廢蜜重力純度下降0.38,煮煉回收率提高1個百分點以上,混合產糖率提高0.35個百分點[52-53]。在原糖精煉糖廠中顯示出了更為明顯的效果,在包括過濾效果、糖漿處理量和物料純度等方面均有一定程度的改善[54]。
在副產物的進一步利用過程中,右旋糖酐酶亦發揮了一定作用。在發酵甘蔗糖蜜生產乙醇過程中添加右旋糖酐酶等酶,能使糖蜜中難以發酵的糖類轉化成易于發酵的糖類,從而提高乙醇產率[55]。
2.3 應用于右旋糖酐分子量可控發酵技術
右旋糖酐及其衍生物是常用的藥物。中國藥典2015年版二部中收載了4種相關藥品,其中3種右旋糖酐作為血漿代用品,還有一種右旋糖酐與氫氧化鐵的絡合物——右旋糖酐鐵作為一種抗貧血藥[56];在日本藥典JP17中,收載了用于降血脂的硫酸葡聚糖鈉[57];英國藥典BP2017和歐洲藥典EP9.5 都收載了結痂劑聚糖酐(Dextranomer)[58-59]。不同的右旋糖酐相關藥物,其分子量要求是不一樣的。以中國藥典為例,其收載的4種右旋糖酐相關藥物中,其分子量與分子量分布要求如表2所示。
右旋糖酐的衍生物除了可作為藥物外,還可以作為物質分離純化的工具,例如藍色葡聚糖、二乙氨乙基葡聚糖等,該類物質的分子量對其分離效果有一定影響。所以,控制右旋糖酐的分子量是制備右旋糖酐類藥物和衍生物的重要環節,而右旋糖酐酶恰恰可以達到靈活控制其分子量的效果。本團隊創新性地提出并成功開發右旋糖酐分子量可控發酵工藝技術,不僅能提高蔗糖轉化效率,更能在結束發酵時,使右旋糖酐分子量落在期望范圍[60]。這將免去后續酸解工藝,直接省去大量酸堿的使用,節約因酸解工藝所需高溫的能耗,達到優化生產流程,節能減排的目的。
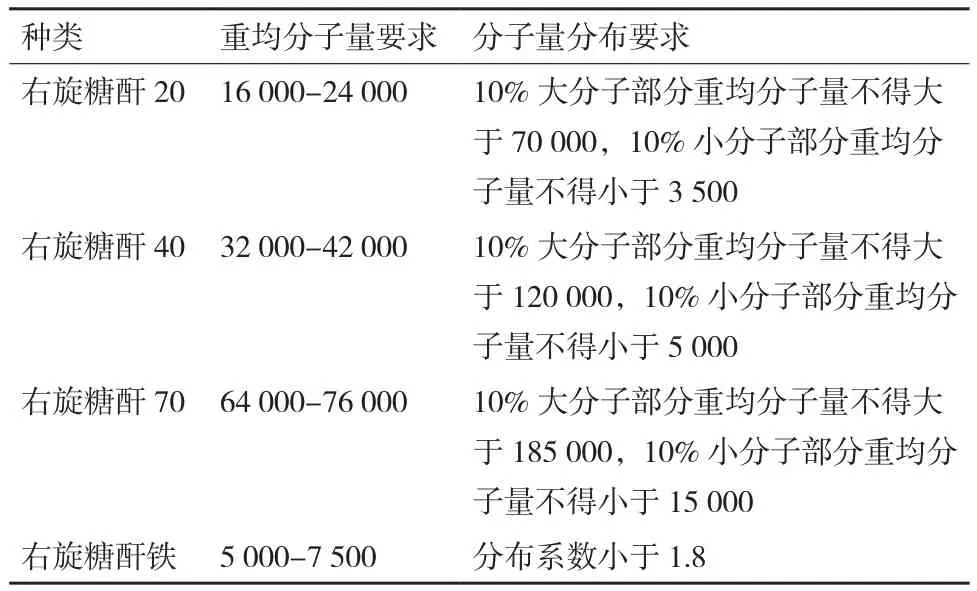
表2 不同右旋糖酐的分子量分布要求[56]
2.4 應用于制備低聚異麥芽糖和低聚右旋糖酐
益生元是指能選擇性地刺激一種或少數種菌落中細菌的生長與活性,而對寄主產生有益的影響,改善寄主健康的不可被消化的食品成分[61]。低聚異麥芽糖可將右旋糖酐水解制得,已有大量文獻報道其益生元作用,從動物試驗[62-63]到人體試驗[64-65],證實了其具有提高免疫力、改變腸道微生物組成、改善排便和腸道功能等功效。
大量的低聚異麥芽糖需求,促進了右旋糖酐酶的應用研究。Gan等[66]利用右旋糖酐蔗糖酶和右旋糖酐酶協同催化蔗糖產生低聚右旋糖酐,Bertrand等[34]和Chalane等[67]利用環氧樹脂固定化右旋糖酐酶,制備出能連續生產分子量可控的低聚異麥芽糖的固定化酶反應器,并具有酶活穩定性高等特點。利用右旋糖酐T-40作為原料,制備出的低聚異麥芽糖的益生元活性與商品化商品無異[34,67]。由于該方法需要用右旋糖酐作為原料,成本可能會較高。若聯合右旋糖酐蔗糖酶使用,在催化蔗糖合成右旋糖酐的同時,用右旋糖酐酶控制分子量,則可以利用蔗糖一步合成低聚異麥芽糖。而Tingirikari等[68]更是將右旋糖酐蔗糖酶和右旋糖酐酶用藻酸鹽微球共固定化,然后用于催化橙汁中的蔗糖轉化為低聚異麥芽糖,將橙汁制備成功能性健康飲料。
由于不同的微生物或酶在不同條件下所產生的右旋糖酐結構都有一定差異,而不同的右旋糖酐酶酶解后的水解產物的結構和比例亦有所差異,這些差異對益生元活性有何影響,是低聚異麥芽糖的進一步研究方向。
2.5 應用于右旋糖酐基質材料的降解和承載物釋放
右旋糖酐材料的應用是近期右旋糖酐相關的研究熱點。以右旋糖酐為基質可以以納米顆粒、水凝膠等形式與氨基酸、蛋白質等物質結合,在生物醫學醫藥領域有巨大的應用潛力[69-71]。在部分應用中,通過右旋糖酐酶對右旋糖酐材料進行降解,可達到釋放承載物等作用,達到某種預設的目的。Widenbring等[72]研究了右旋糖酐酶對負載著伴刀豆球蛋白A的右旋糖酐微凝膠載體的降解規律,為其在生物醫學中的應用提供參考依據。由于消化道上游不存在分泌右旋糖酐酶的微生物,而結腸中卻存在,所以利用右旋糖酐作為基質的微球或復合物可攜帶藥物定點輸送至結腸,有望用于治療結腸癌或阿米巴腸病[73-75]等疾病。
2.6 用作研究過程的輔助手段
由于不同來源的右旋糖酐的分子量不定,分子量分布可能較寬,若右旋糖酐作為雜質存在于體系中,則對其他物質的分析或純化造成不利影響。比如要純化右旋糖酐蔗糖酶時,常伴有大量右旋糖酐存在,而目標酶的分子量亦很可能在右旋糖酐的分子量分布內。此時,右旋糖酐酶就可以發揮它的作用,將右旋糖酐降解為小分子,再用膜技術就可以去除右旋糖酐,提純右旋糖酐蔗糖酶[76]。在研究多糖時也遇到類似問題:Matsuzaki等[77]發現了腸膜明串珠菌NTM048f分泌的胞外多糖可以作為一種免疫刺激劑來提高黏膜IgA的量,這種胞外多糖的主要成分是右旋糖酐,當使用右旋糖酐酶將右旋糖酐水解后,發現了殘余物中存在另外兩種果聚糖。如果不使用酶的話,果聚糖的存在將難以發現。右旋糖酐酶對某些結構中的葡萄糖殘基間的α-1,6糖苷鍵有特異性水解作用,所以亦被用于其他多糖的結構輔助分析手段,推測多糖中α-1,6糖苷鍵的比例[78]或用于尋找結構特殊的多糖[79-80]。
3 總結與展望
右旋糖酐酶的研究已超過百年,但一直沒有停止。新的右旋糖酐酶不斷被發現和開發,探索的范圍已從陸地微生物向海洋微生物發展。無論從生物化學和生物物理的基礎理論研究角度,還是從右旋糖酐酶的新型應用開發研究角度,關鍵問題在于右旋糖酐酶催化性能的廣泛發掘和催化機理的深入探究。分子生物學的發展令其研究延伸至基因層面。隨著人們對酶的三級結構了解的深入,酶的理性設計技術(如定點突變和結構域重組)將越來越普遍。加上計算化學的發展,計算機計算能力的提高,計算機算法的進步,將大大提高酶的改造效率,甚至使酶的從頭設計成為可能。更高的酶活、更寬的反應溫度和pH、更強的穩定性,這些都是可預期的。但由于應用范圍所限,開發動力不足,右旋糖酐酶基礎研究力度還不大,導致高性能的酶制劑還是難以開發。右旋糖酐的結構復雜多變,隨著對右旋糖酐質量要求的提高,很可能需要一種更精確地控制右旋糖酐的分子量和支鏈情況的技術,而利用右旋糖酐酶可能是一種很好的選擇。右旋糖酐酶的開發、應用,與右旋糖酐的研究這三者之間緊密相連,相互促進,相互制約。

