磁共振彌散峰度成像在肝臟常見實性腫瘤診斷中的應用價值
朱柳紅(通信作者)
復旦大學附屬中山醫院廈門醫院放射診斷科 (福建廈門 361015)
在過去20年間,彌散加權成像(diffusion weighted imaging,DWI)從早期的神經系統疾病應用[1],到目前體部占位性病變的應用[2],已成為臨床磁共振檢查的常規序列。DWI利用水分子的彌散特性進行成像,其理論基礎是組織內水分子高斯分布的假設。磁共振彌散峰度成像(diffusion kurtosis imaging,DKI)是由Jensen等[3]于2005年提出的一種新的磁共振成像技術,是對彌散張量成像(diffusion tensor imaging,DTI)的擴展,主要用于測量水分子偏離正態分布的程度(即峰度),可對受限的、非高斯分布的水分子進行描述,可反映活體組織結構的彌散性和不均勻性等。DKI不僅可提供彌散相關的參數,如各向異性參數(fractional anisotropy,FA)、平均彌散率(mean diffusivity,MD)、軸向彌散率(axial diffusivity,Da)及徑向彌散率(radial diffusivity,Dr),還有其特有的3個主要參數,即平均峰度(mean kurtosis,MK)、軸向峰度(axial kurtosis,Ka)及徑向峰度(radial kurtosis,Kr)。MK是總體峰度的測量,被認為是可反映復雜微觀結構的指標[4]。Ka代表沿軸突方向的峰度,在細胞毒性水腫方面意義較顯著[5-6]。Kr是與Ka垂直的峰度,其值越大表明在該方向非正態分布水分子擴散受限越明顯,反之則表明擴散受限越弱。
目前,DKI在顱內腫瘤分級[7-9]及神經系統疾病[10-11]中的應用研究已較為成熟,在受呼吸運動干擾較少的臟器,如乳腺、前列腺及直腸等中的應用亦有報道[12-14],但將DKI應用于肝臟的研究并不多見。已有部分研究將DKI應用于肝細胞肝癌(hepatocellular carcinoma,HCC)患者的療效評估[15]、肝臟纖維化[16]及HCC的微血管侵犯研究[17],結果顯示,DKI的價值高于DWI。然而,在肝臟最常見占位性病變的性質研究方面,相關的報道較少。本研究擬探討與比較DKI與DWI在描述及診斷肝臟常見占位性病變中的性能。現報道如下。
1 資料與方法
1.1 一般資料
2017年5 月至2018年3月共收集62例疑似有肝臟實性占位患者的DKI數據,患者均被告知影像檢查方法,自愿接受呼吸訓練及各序列的MR掃描。數據采集平臺基于GE 1.5T磁共振掃描儀(GE Healthcare,Waukesha,WI),8通道腹部相控陣線圈。常規檢查為軸位屏氣T1加權(TR 190 ms,TE 2.36 ms/4.71 ms)、呼吸觸發壓脂T2加權(TR 6 667 ms,TE 93.38 ms)成像及傳統DWI序列(b 800 s/mm2),層厚及層間距分別為8 mm和2 mm。DKI序列的b值分別為0、500、1 000 s/mm2,具體參數為采用呼吸觸發技術,TR/TE 3 750/99.5 ms, FOV 38 cm,Tck/sp 8 mm/2 mm;掃描時間約4 min。其中,介入栓塞術后2例,病灶位于肝臟邊緣受偽影干擾2例, 病灶最大徑<2 cm 4例,病灶為罕見病灶2例,非肺癌轉移瘤3例,肝臟囊腫10例,共23例被排除。因此共采集到39例患者的46個病灶(HCC 23個,肺癌肝轉移瘤12個,合計為惡性組;肝血管瘤11個,記為良性組)。病灶性質均由病理及(或)臨床綜合檢查確認。
1.2 方法
1.2.1 傳統的單冪數DWI信號模型
傳統的表觀彌散系數(apparent diffusion coefficient,ADC)值計算基礎均是基于兩個b值的單冪數回歸模型,如公式(1)所示:

其中,b、b0代表不同的彌散敏感系數,且b0<b,S和S0代表兩個b值下感興趣區的信號強度。在目前臨床應用中,通常將b0設置為較低值,如0 s/mm2,則對應的感興趣區的信號強度記為S0,公式(1)變換成如下:

從公式(2)可見,ADC的值依賴于b值的大小,臨床常用部位中,頭顱的高b值通常設置為1 000 s/mm2,腹盆通常設置為600 s/mm2或800 s/mm2。
1.2.2 標準的DKI信號模型
Jensen等[3]將DKI采集到的信號描述如下:

其中,S(b)是指指定b值下的信號強度,S(0)是無彌散加權的信號強度。每個方向上的Dapp及Kapp值是通過最小二乘法將信號擬合而求得;而MD是所有方向上Dapp的平均值,MK是Kapp的平均值。
1.3 參數標準化及測量計算
由于個體差異的存在,單純的參數值高低并不能說明其相應的意義,還需考慮其所處的不同背景組織。本研究將正常肝臟背景作為標準化條件,標準化公式如下:
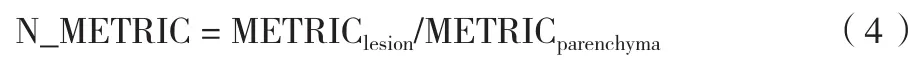
其中,METRIClesion為病灶的參數,METRICparenchyma為正常肝背景的參數。由2名醫師獨立于后處理工作站(AW.46,GE Healthcare)勾勒同一層面病灶的感興趣區及正常肝實質的感興趣區。勾勒過程遵循如下原則:血管瘤的感興趣區應包全病灶,肝癌及轉移瘤的感興趣區應避開壞死區;分別測量常規DWI序列及DKI序列同一層面上的ADC值和DKI參數值;每個感興趣區測量的結果均為兩名醫師測量結果標準化后的平均值。
1.4 統計學處理
采用SPSS 24.0(IBM Corporation)統計軟件進行數據分析,運用非參數Mann-Whitney U檢驗比較各標準化后的DKI參數及傳統的標準化ADC參數在描述病灶特征及鑒別肝臟良惡性腫瘤方面的差異,并進行ROC曲線分析,比較各參數的靈敏度及特異度。P<0.05為差異有統計學意義。
2 結果
2.1 各組MD及MK的典型表現
肝血管瘤組MD較其余兩組高,而其MK較其余兩組低。見圖1。
2.2 各組DWI及DKI標準化參數值比較
標準化后的ADC從大到小分別為肝血管瘤,HCC及肺癌肝轉移瘤;標準化后的MD與標準化后的ADC的表現基本類似,而標準化后的MK(N_MK)完全相反,肝血管瘤的復雜度相對最低,其次為HCC,肺癌肝轉移瘤的復雜度最高。見圖2。
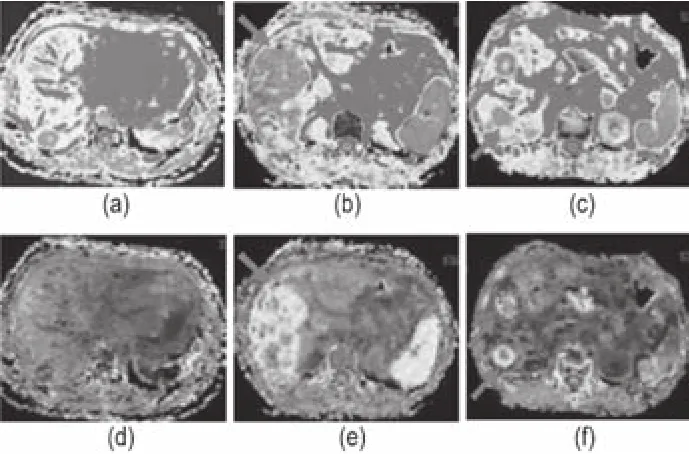
圖1 各組MD及MK的典型表現
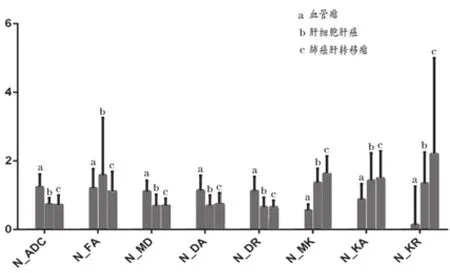
圖2 各組標準化參數
2.3 各組間非參數U檢驗
各組兩兩比較的非參數檢驗結果顯示,各參數表現基本類似,而N_MK在HCC組和肺癌肝轉移組間比較,差異有統計學意義(P<0.05),肺癌肝轉移瘤的復雜度顯著高于HCC。見表1。

表1 各組間非參數U檢驗
2.4 良性組與惡性組DWI及DKI標準化參數U檢驗及ROC分析結果
在良惡性組鑒別方面,非參數U檢驗的結果顯示,除N_FA外,其余參數在鑒別肝臟實性腫瘤的良惡性方面比較,差異均有統計學意義(P<0.05)。ROC分析結果顯示,N_MK的曲線下面積接近于1,為0.996,其次為N_ADC,為0.914,其他各參數較小;N_MK的靈敏度及特異度均高于其他參數。見表2。
3 討論
DKI模型是Jensen等于2005年提出,其初始目標是定量彌散偏離高斯分布的程度。常規單e指數模型假設水分子彌散是不受阻礙的自由運動,即水分子在隨機運動的情況下其彌散運動位移滿足高斯分布(正態分布)。而對于真實的生物組織,水分子的彌散實際上是在細胞間隙、細胞內運動,受到細胞膜、大分子蛋白、血液微循環灌注等因素的影響,該運動不是自由運動,因此,真實的水分子彌散運動位移是非高斯分布的。水分子擴散受周圍環境的限制越大,體素內組織成分越混雜,彌散的非高斯性也就越顯著[3],峰度相關參數,特別是MK也就越大。例如,Van Cauter等[18]發現高級別腦瘤具有較高的K值,與細胞密度的增大、細胞體積減小和細胞內環境復雜性增加有關。Qi等[7]也發現MK值在腦膠質瘤中會顯著升高,相對于彌散系數,MK值能更準確地區分高、低級別的膠質瘤。Sheng等[16]比較研究了DWI和DKI在評估肝纖維化中的能力,ROC結果顯示MK在區分輕度纖維化和重度纖維化方面可作為DWI的有力補充。

表2 良性組與惡性組DWI及DKI標準化參數U檢驗及ROC分析結果
本研究中,肺癌肝轉移瘤的標準化MK值最大,其次為HCC,最后為肝血管瘤。分析原因為,惡性腫瘤細胞增殖速度快,細胞密度遠高于正常背景組織,可使腫瘤內水分子擴散呈現更為嚴重的非高斯分布,則MK值越大。良性腫瘤細胞活躍度不高,細胞密度通常低于正常背景組織,MK值亦小于背景組織。ADC值越小,反映了水分子擴散受限越明顯;而水分子受限越明顯,亦揭示了周圍組織的復雜度越高,即MK值越高。且組內兩兩比較的結果顯示,標準化MK值是唯一一個可區分HCC和肺癌肝轉移瘤的指標,其余各參數表現基本類似。在鑒別良惡性方面,彌散相關參數(N_FA,N_MD,N_DA,N_DR)的能力弱于N_ADC及峰度相關參數(N_MK,N_KA,N_KR), 且N_ADC及N_MK的曲線下面積、靈敏度及特異度較高。N_ADC及N_MK的ROC曲線間Pairwise比較結果顯示,N_MK的曲線下面積顯著高于N_ADC(P<0.05)。研究結果表明,DKI參數在鑒別肝臟常見良惡性腫瘤方面比傳統的ADC值具有更高的鑒別診斷能力。
當然,本研究及DKI本身存在一定的局限性。(1)入組的良性腫瘤種類太少;(2)Rtr技術雖然能夠很好地使每個方向的同層面的結構信息盡量不變,但患者的呼吸并非能夠完全規律,因此存在一定的誤差;(3)DKI目前成像的時間較長。盡管存在一定的局限性,但本研究結果顯示DKI由于其無創性及能夠體現組織的復雜性,在肝臟常見占位性病變的診斷方面具有極大的潛力,可作為傳統DWI的補充,也可作為常見占位性病變診斷的一種新的無創的檢查手段。

