分泌尿鳥苷素工程菌的構建及其對結腸上皮細胞cGMP合成的影響
李林 魏振宇 尉秀清

【摘要】目的構建能夠分泌尿鳥苷素的嬰兒雙歧桿菌,觀察其對結腸上皮細胞環(huán)磷酸鳥苷(cGMP)合成的影響,為用尿鳥苷素基因重組雙歧桿菌治療便秘做前期準備。方法以質粒pBV220為模板,構建表達質粒pBV220-ESS-uroguanylino重組質粒pBV 220-ESS-uroguanylin電擊轉化嬰兒雙歧桿菌。用ELISA檢測重組嬰兒雙歧桿菌中尿鳥苷素的表達情況及其上調結腸癌細胞T84內cGMP合成的能力。結果pBV 220-ESS-uroguanylin陽性克隆提取質粒并進行基因測序,證實載體構建成功,測序正確無突變。ELISA檢測證實重組嬰兒雙歧桿菌成功表達尿鳥苷素,具有上調結腸癌細胞T84內cGMP合成的能力。結論重組雙歧桿菌構建成功并能分泌尿鳥苷素,提高結腸上皮細胞cGMP的合成。
【關鍵詞】尿鳥苷素;雙歧桿菌;環(huán)磷酸鳥苷
尿鳥苷素是小腸黏膜細胞分泌的一種具有調節(jié)腸道水鈉代謝作用的16膚[1]。尿鳥苷素作用于小腸黏膜上皮細胞鳥苷酸環(huán)化酶2C受體,使細胞內第二信使環(huán)磷酸鳥苷(cGMP)含量升高,進而激活蛋白激酶A,使囊性纖維化跨膜傳導調節(jié)因子(CFTR)磷酸化,增強氯離子和碳酸氫根離子的跨膜轉移,使腸腔內氯離子和碳酸氫根離子分泌增加,從而導致水鈉分泌增加、腸道蠕動能力增強,此生理作用可顯著改善慢性便秘及便秘型腸易激綜合征[2]。
隨著益生菌潛在健康益處被挖掘和基因工程技術的進步,選擇益生菌作為載體系統(tǒng),表達特定功能的蛋白質,探索其在疾病治療領域的應用潛力越來越受重視。雙歧桿菌是人類腸道重要的菌群。越來越多的研究對重組雙歧桿菌在疾病治療、疫苗制作以及對人類有益的功能性蛋白的分泌領域進行初步探索[3]。嬰兒雙歧桿菌ATCC 15697已應用于乳制品和食品領域,是一種安全的食用菌。我們將尿鳥苷素基因重組到質粒pBV220中,使其在宿主菌嬰兒雙歧桿菌中表達,然后進一步驗證其是否能夠增加結腸癌細胞T84內cGMP的合成,從而為該重組嬰兒雙歧桿菌具有通過cGMP-蛋白激酶A-CFTR調節(jié)軸而影響水鈉代謝的能力提供實驗依據(jù),為后期研究其是否能作為一種治療便秘的生物制劑做前期準備。
材料與方法
一、細胞、菌種與質粒
嬰兒雙歧桿菌ATCC 15697購自廣東省微生物菌種保藏中心,pBV220質粒購自武漢森靈生物科技有限公司,結腸癌T84細胞由中山大學附屬第三醫(yī)院消化內科實驗室保存,含有pBV220質粒的嬰兒雙歧桿菌ATCC 15697(前期已構建,由暨南大學第二理工樓734姚冬生教授實驗室保存)。
二、主要試劑和儀器
1.主要試劑
限制性內切酶(Neb,美國),尿鳥苷素ELISA試劑盒(Cusabio,武漢),cGMP ELISA試劑盒(Elabscience,武漢),TPY液體/固體培養(yǎng)基(海博生物公司,青島),ActilightP(日本Meiji公司,由上海格信企業(yè)贈送),質粒小提試劑盒(天根生化科技有限公司,北京)。
2.主要儀器
多功能酶標儀(美谷分子儀器,上海),ECM399電轉儀(BTX,美國),DYY-10型電泳儀(六一儀器廠,北京),Mini離心機(Eppendorf公司,德國)。
三、實驗方法
1.pBV220改造
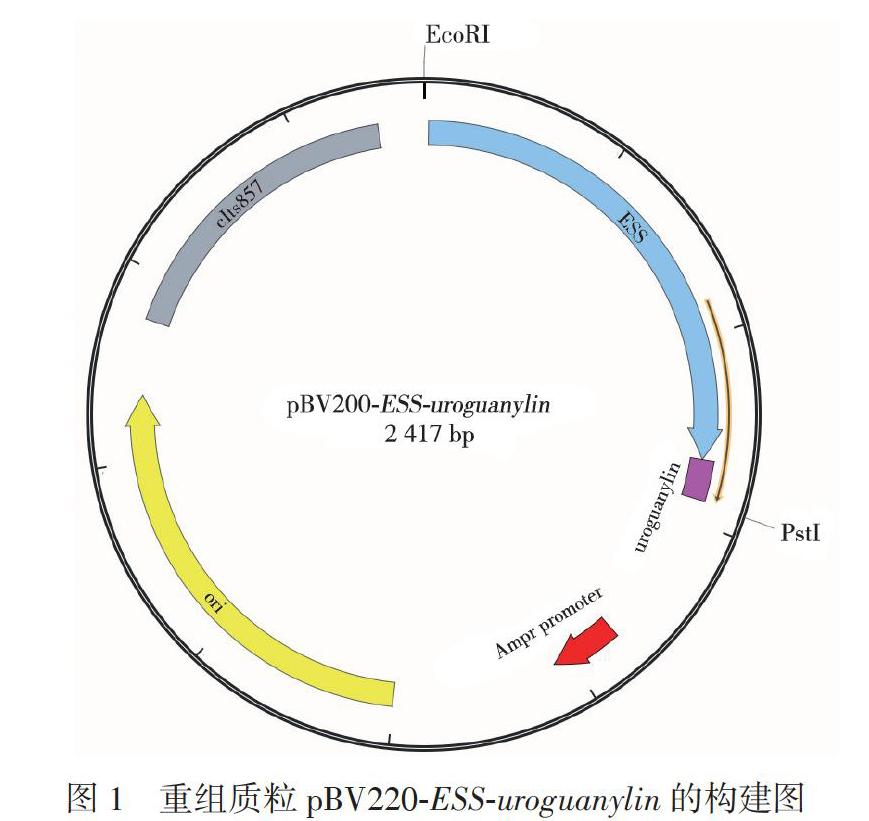
從NCBI獲得相關基因序列信息后,按圖1設計交由上海捷瑞生物工程有限公司全基因合成并組裝載體,獲得由質粒pBV220改造后得到的質粒pBV220-ESS-uroguanylino pBV220質粒由我國預防醫(yī)學院病毒研究所自行構建,屬于溫度誘導表達型,誘導溫度為42℃[4]。
2.重組質粒轉化嬰兒雙歧桿菌
將嬰兒雙歧桿菌用TPY培養(yǎng)基37℃厭氧培養(yǎng)48 h,按1:10接種于TPI培養(yǎng)基,37℃厭氧培養(yǎng)12h,再按1:20接種到120ml含有16% Actilight.P的TPY培養(yǎng)基培養(yǎng)中,12~16h后吸光度(OD)。
ESS序列包含了amy B基因(青春雙歧桿菌INT57的淀粉酶基因)中的啟動子、核糖體結合位點以及信號肽區(qū)域(參考序列GenBank編號:AY240946.1):Uroguanylin為尿鳥苷素成熟肽序列(序列前加ATG,末尾加TAA,參考序列NCBI編號為NM 007102.3);上述目的基因序列通過EcoR I和Pst I雙酶切連接到質粒pBV220的多克隆位點上;所有工作委托上海捷瑞生物工程有限公司完成值達到0.2~0.3,8000轉/分4℃離心10min,去除上清后用pH為7的5mmol幾磷酸鉀緩沖液洗3次,用1ml KMR緩沖液(5mmol/L磷酸二氫鉀,1mmol/L氯化鎂,0.3 mol幾棉子糖)重懸細胞,0℃過夜。取100μl細胞懸液與0.25μg重組質粒pBV220-ESS-uroguany&n混合,轉移至電擊杯,冰浴5min,12.5 kV/cm電擊,立即用5ml含有16%Actilight■P的TPI培養(yǎng)基復蘇細菌,37℃厭氧培養(yǎng)16h(電轉化方法參考Rossi等[5]研究)。將菌液涂布到含有100μg/ml氨芐青霉素的TPY固體平板,37℃厭氧培養(yǎng)48h,同時接種另一組未轉染抗性質粒的嬰兒雙歧桿菌至同樣含氨芐青霉素的平板上作為陰性對照。48h后挑取陽性克隆接種至10ml TPY液體培養(yǎng)基,厭氧培養(yǎng)48h,離心去除上清,用50mg/ml的溶菌酶37℃處理菌體2h,離心取上清,用質粒小提試劑盒提取質粒。提取的質粒用EcoR I和Pst I雙酶切鑒定,質粒pBV220作為陰性對照。
3.尿鳥苷素ELISA試劑盒檢測尿鳥苷素基因在雙歧桿菌的表達
將空白對照組(野生型嬰兒雙歧桿菌ATCC15697)、空載對照組(含有pBV220質粒的嬰兒雙歧桿菌ATCC 15697雙歧桿菌,前期已構建)、重組質粒組(含重組質粒pBV 220-ESS-uroguanylin的嬰兒雙歧桿菌ATCC 15697)用TPY培養(yǎng)基37℃厭氧培養(yǎng)36h,然后再42℃厭氧培養(yǎng)16h,離心取上清液作為檢測樣本。按尿鳥苷素ELISA試劑盒說明書要求進行檢測,簡要步驟如下:室溫下平衡各種試劑1h;分別加標準品、各組細菌培養(yǎng)的上清液100μl/孔,37℃孵育2h;去除孔內液體;每孔加生物素標記抗體100μl,37℃孵育1h;洗板3次:每孔加HRP-avidin100μl,37℃孵育-h;洗板5次;每孔加TMB底物90μl,37℃避光孵育20~30min:每孔加入終止液50μl。用多功能酶標儀檢測反應物的OD450。
4.cGMP ELISA試劑盒檢測工程菌分泌的尿鳥苷素的生物活性
將含重組質粒pBV 220-ESS-uroguanylin的雙歧桿菌(重組質粒組)37℃培養(yǎng)36h,然后再42℃誘導表達16h,同樣方法培養(yǎng)野生型雙歧桿菌(空白對照組)和含有pBV220質粒的雙歧桿菌(空載對照組)。在4個6孔板用含有10%胎牛血清的DMEM洗2次培養(yǎng)結腸癌細胞T84,48h后吸去每孔的培養(yǎng)基,然后每孔加入1ml含10%胎牛血清的DMEM洗2次;每孔再加入1ml含10%胎牛血清和1mmol/L 3-異丁基-1-甲基黃嘌呤的DMEM、37℃孵育1h;然后將各組細菌培養(yǎng)上清液加入到孔板中(每組菌液上清分別加8個孔,每孔1ml),孵育1h。去除培養(yǎng)液,每孔加入一ml lmol/LHCl 20℃孵育30min,裂解細胞獲得cGMP(該方法參考Cuppoletti等[6]提取腫瘤細胞cGMP的步驟);離心取上清液用cGMP ELISA試劑盒檢測工程菌分泌的尿鳥苷素的生物活性,簡要步驟如下:每孔加入標準品或樣品各50μl,立即加入50μl生物素化抗體工作液,37℃孵育45min;洗滌3次;加人100μl酶結合物工作液,37℃孵育30min;洗滌5次;加入90μl底物溶液,37℃孵育15min左右;加入50μl終止液,立即用多功能酶標儀檢測反應物的OD450。
四、統(tǒng)計學處理
應用SPSS 21.0進行統(tǒng)計學分析。實驗數(shù)據(jù)的計量資料以x1s表示,方差不齊,多組間比較采用Kruskal-Wallis檢驗,兩兩比較用Bonferroni法校正檢驗水準,α=0.05。
結果
一、重組質粒轉化嬰兒雙歧桿菌
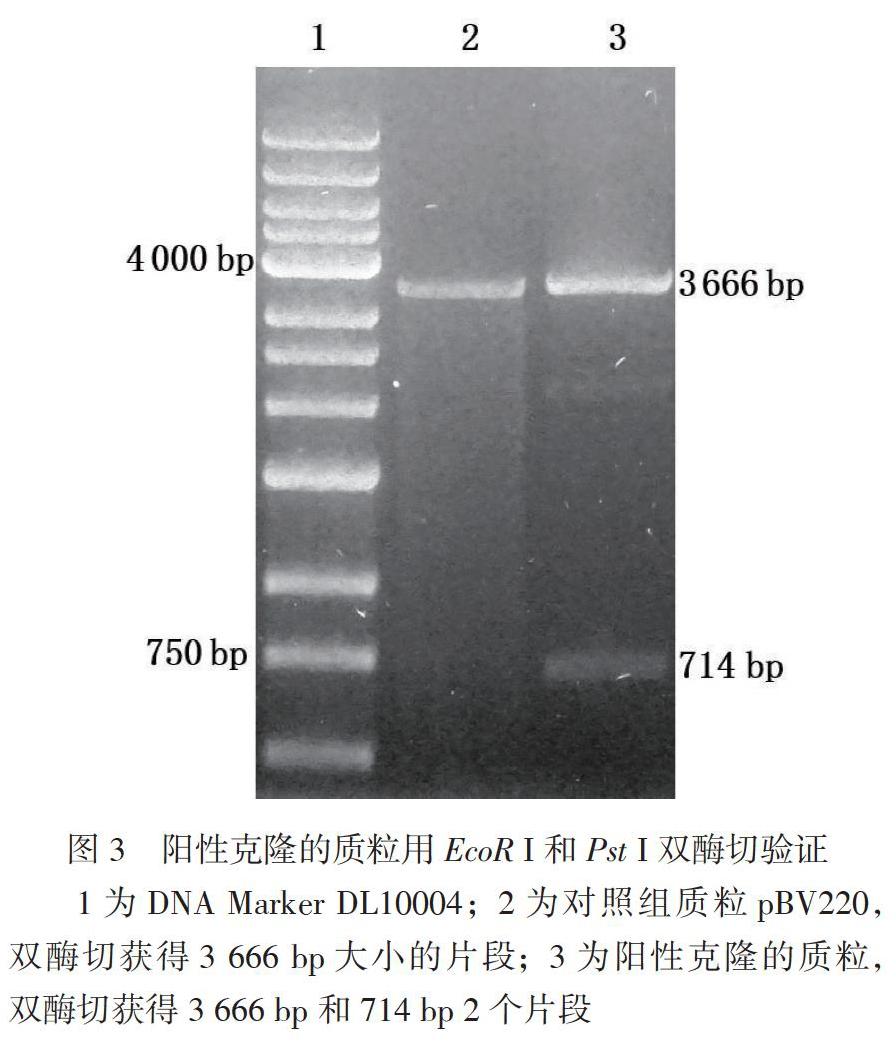
重組質粒pBV 220-ESS-uroguanylin電轉化后的雙歧桿菌在含有100μg/ml氨節(jié)青霉素的平板長滿了單克隆菌落,而野生型雙歧桿菌(空白對照組)在含有100μ/gml氨芐青霉素的平板沒有菌落生長,重組質粒成功轉化雙歧桿菌,見圖2。為了進一步驗證重組質粒已經轉人雙歧桿菌,用試劑盒提取陽性克隆的質粒后與陰性對照質粒pBV220同時做雙酶切驗證,見圖3。雙酶切驗證結果進一步證明重組質粒pBV220-ESS-uroguanylin成功轉化嬰兒雙歧桿菌。
1為DNA Marker DL10004:2為對照組質粒pBV220、雙酶切獲得3666bp大小的片段;3為陽性克隆的質粒,雙酶切獲得3666bp和714bp 2個片段
二、各組別尿鳥苷素表達情況
各組細菌尿鳥苷素表達情況ELISA檢測結果顯示:重組質粒組反應終產物OD450(0.29±0.03)分別與空白對照組反應終產物OD450(0.06 1 0.01)和空載對照組反應終產物OD450(0.07±0.02)比較差異均有統(tǒng)計學意義(Z分別為-3.733和-3.016、P均<0.05/3);而空白對照組OD450和空載對照組OD4so比較差異無統(tǒng)計學意義(Z=-0.672,P=0.501)。
已知野生型嬰兒雙歧桿菌不會分泌尿鳥苷素,因此可以證明含重組質粒pBV 220-ESS-uroguanylin的雙歧桿菌成功分泌尿鳥苷素。含重組質粒pBV220-ESS-uroguanylin的雙歧桿菌尿鳥苷素表達量的計算方法為:重組質粒組OD4so一空載對照組OD。。,然后通過標準曲線及擬合方程(由標準品檢測結果通過軟件OriginPro 8.0用4參數(shù)Logistic擬合進行回歸分析獲得標準曲線及擬合曲線,見圖4)計算出重組嬰兒雙歧桿菌尿鳥苷素表達量約為652.23 pg/ml(約0.38 nmol/L)。
三、各組別尿鳥苷素的生物活性檢測情況
尿鳥苷素的生物活性是通過其上調cGMP的作用達到的,采用cGMP ELISA試劑盒檢測。因該試劑盒采用的是競爭抑制ELISA,因此反應終產物的OD450和cGMP濃度成反比。
各組細菌ELISA檢測結果顯示:重組質粒組反應終產物OD4so(0.05±0.00)分別與空白對照組
通過標準品獲得相應濃度(作為因變量)下的OD值(作為自變量),通過軟件OriginPro 8.0用四參數(shù)Logistic擬合進行回歸分析,獲得尿鳥苷素ELISA標準曲線,其方程為y=d-(a+d)/[1+(x/c)b](a=0.007,b=0.932,c=3.525,d=5840.3),r2=0.999,檢測范圍31.25一2000pg/m反應終產物OD450(0.43±0.02)和空載對照組反應終產物OD450(0.41±0.03)比較,差異均具有統(tǒng)計學意義(Z分別為3.683和3.116,P均<0.05/3);而空白對照組OD450和空載對照組OD、、比較差異無統(tǒng)計學意義(Z=0.567,P=0.571)。
競爭抑制ELISA的反應終產物的OD450和cGMP濃度成反比,即重組質粒組的cGMP含量較對照組升高,且具有統(tǒng)計學意義,結合上一步尿鳥苷素表達檢測結果,可以證明重組嬰兒雙歧桿菌分泌表達的尿鳥苷素導致了cGMP的升高,具有和人體天然分泌的尿鳥苷素相同的生理活性。
討論
便秘是一種常見的以排便功能障礙為特征的疾病。流行病學調查顯示,世界各地便秘的平均患病率為16%左右,而60歲以上患病率升高至30%以上[7。女性患病率是男性的4倍以上[8]。便秘的高患病率和便秘治療藥物的高使用頻率給患者的生活質量帶來了嚴重影響,同時造成了巨大的社會經濟負擔和醫(yī)療資源的占用。尋找安全、方便、有效、物美價廉的便秘治療藥物是重要研究課題。
自從聯(lián)合國糧食及農業(yè)組織和WHO將益生菌定義為“數(shù)量控制在適當范圍內對宿主健康有益的微生物”以來,益生菌的商業(yè)應用和研究越來越多[9]。而隨著基因工程技術的進步,通過基因編輯技術獲得具有促進人類健康或治療疾病的能力的功能性益生菌將成為未來的一種趨勢[10]。
我們課題組利用基因工程技術,將尿鳥苷素基因表達于益生菌中,從而獲得具有調節(jié)腸道水鈉分泌功能的益生菌,并進一步探究基因工程益生菌在便秘防治中的可行性,以期獲得一種具有治療便秘功能的益生菌,為慢性便秘防治提供一種多元化的經濟有效的策略。
本文所介紹的用質粒pBV220將尿鳥苷素基因表達于嬰兒雙歧桿菌ATCC 15697為本研究的前期預實驗部分。本課題組已成功構建了一種能穩(wěn)定分泌表達尿鳥苷素的嬰兒雙歧桿菌ATCC巧697;且該重組菌分泌的尿鳥苷素和人類腸道天然分泌的尿鳥苷素一樣,可上調腸上皮細胞cGMP的含量。而研究已經表明尿鳥苷素可通過上調細胞內第二信使cGMP的含量,進而通過蛋白激酶A-CFTR調節(jié)軸,最終使氯離子和碳酸氫根離子的跨膜轉移增加,導致腸道水鈉分泌增加、腸道蠕動能力增強。因此可認為重組嬰兒雙歧桿菌具有促進腸道排泄功能的潛力。
后期實驗中,可通過基因編輯技術將重組質粒pBV 220-ESS-uroguanylin中溫控基因cItS857刪除,從而獲得能夠在人體正常體溫下表達尿鳥苷素的重組菌,然后讓其在人體腸道定植。因為重組菌分泌的尿鳥苷素為納米級,作用相對溫和,如果讓其定植在人類腸道,可能可以作為一種定植菌而達到長期促進腸道糞便排泄的效果,需后期實驗進一步探究。
參考文獻
[1]Shailubhai K,Yu HH,Karunanandaa K,Wang JY,EberSL,Wang Y,Jon NS,Kim HD,Miedema BW,Abbas SZ,Boddupalli SS,Currie MG,F(xiàn)orte LR.Uroguanylin treatmentsuppresses polyp formation in the Ape(Min/+)mouse andinduces apoptosis in human colon adenocarcinoma cells viacyclic GMP.Cancer Res,2000,60(18):5151-5157.
[2]Waldman SA,Camilleri M.Guanylate cyclase-C as a therapeutictarget in gastrointestinal disorders.Gut,2018,67(8):1543-1552
[3]Sun Z,Baur A,Zhurina D,Yuan J,Riedel CU.Accessing theinaccessible:molecular tools for bifidobacteria.Appl EnvironMicrob,2012,78(15):5035-5042.
[4]Zhao M,Li P,Xie Y,Liu X,Cheng L,Liu T,Kong L,WangO,Han F.Recombinant protein of the first two ectodomains ofcadherin 23 from erl mice shows impairment in Ca'"-dependentproteolysis protection.Protein Expr Purif、2018,147:55-60.[5]Rossi M,Brigidi P,Matteuzzi D.An efficient transformationsystem for Bifidobacterium spp.Lett Appl Microbiol,1997,24(1):33-36.
[6]Cuppoletti J,Malinowska DH,Tewari KP,Li QJ,Sherry AM,Patchen ML,Ueno R.SPI-0211 activates T84 cell chloridetransport and recombinant human CIC-2 chloride currents.Am JPhysiol Cell Physiol,2004,287(5):C1173-C1183.
[7]Forootan M,Bagheri N,Darvishi M.Chronic constipation:areview of literature.Medicine(Baltimore),2018,97(20):e10631.
[8]鐘英強,朱兆華.老年人慢性便秘的診斷與治療.新醫(yī)學,2006,37(8):497-499.
[9]Hill C,Guarner F,Reid G,Gibson GR,Merenstein DJ,PotB,Morelli L,Canani RB,F(xiàn)lint HJ,Salminen S,Calder PC,Sanders ME.Expert consensus document.The international scien-tific association for probiotics and prebiotics consensus statementon the scope and appropriate use of the term probiotic.Nat RevGastroenterol Hepatol,2014,11(8):506-514.[10]Hidalgo-Cantabrana C,0Flaherty S,Barrangou R.CRISPR-based engineering of next-generation lactic acid bacteria.CurrOpin Microbiol,2017,37:79-87.
(收稿日期:2019-01-18)
(本文編輯:楊江瑜)
DOI:10.3969/j.issn.0253-9802.2019.05.005
基金項目:國家自然科學基金(81470848)
作者單位:510630 廣州,中山大學附屬第三醫(yī)院消化內科

