大黃附子湯作用機制的靶標與通路探討
趙金龍,陳國銘,鄺梓君,湯順莉,黃 雁,陳子茵,張培嬋,劉韻韻,唐純志△
(1. 廣州中醫藥大學針灸康復臨床醫學院,廣州 510405; 2. 廣州中醫藥大學第一臨床醫學院,廣州 510405; 3. 廣州中醫藥大學第三臨床醫學院,廣州 510405)
經典中藥復方大黃附子湯來源于《金匱要略》,此方包含大黃、附子及細辛3味中藥,功效為溫里散寒、通便止痛,主治寒積里實證[1]。在較多文獻研究和臨床實際應用中,大黃附子湯主要用于治療消化系統[2]、腎病[3-4]、痛證、婦科疾病等系統或疾病[5]。霍黎生[6-7]、張林軍[8]等報道了大黃附子湯在治療功能性便秘方面的優勢和顯著療效。吳麗[8]等報道了大黃附子湯治療急性胰腺炎的作用機理。陳偉平[3]等報道了大黃附子湯治療慢性腎衰竭的臨床療效,反饋較好。由于附子與細辛具有一定的毒性,也在一定程度上限制了該方的推廣,其作用機制及原理尚未完全闡明,因此研究大黃附子湯治療的作用機制及原理,對于推廣其臨床應用及新藥開發具有重要的臨床意義。
基于系統藥理學的推導方法,對該方設計的數據進行分析,將從分子層面及通路領域預測大黃附子湯作用機制,以期為大黃附子湯的臨床推廣應用及開發新藥提供有力的循證支持。
1 資料與方法
1.1 大黃附子湯的化學分子信息庫
本研究通過中藥系統藥理學分析平臺(TCMSP),以“大黃”“附子”“細辛”3個中藥成分作為中藥名檢索大黃附子湯的化學成分。
1.2 化合物的信息提取
通過口服方式表現出來的生物利用度,是藥物ADME中最重要的藥物代謝動力學中的一個參數,其代表口服藥物到達體循環所占口服劑量的多少,作用比率高的口服生物利用度也許是決定生物活性分子類藥性的重要指標[9]。本文研究以口服生物利用度(oral bioavailability,OB)最低大于或等于30%和類藥性(druglikeness,DL)最低大于或等于0.18作為活性化合物的選取標準,將數據庫中具有較高活性的成分進行提取,以保證數據的有效性。
1.3 化合物與靶點網絡的構筑
將該方相關的化合物及靶點通過軟件Cytoscape 3.5.1構筑化合物-靶點網絡,并對其進行拓撲學數據分析,從而研討大黃附子湯的藥理學作用機理,其中靶點度值(Degree)和中介中心度(Betweenness Centrality)是拓撲學數據中2個關鍵參數,可以評判該方劑相關化合物和靶標的關鍵性。
1.4 蛋白互作(PPI)網絡的構建
蛋白質一般以相互組合的方式方能實現其生理學功能,因此蛋白相互作用網絡的分析及研究是理解生命活動如生理過程等的基礎條件。為闡明靶點蛋白在系統層面的用途,將大黃附子湯相關的靶點輸入數據庫STRING 10.5,使用相關設置功能,將評分設為0.90及以上,以此提升信息的可信性。通過以上數據處理而導出蛋白互作的可視化圖,并根據相關數據提取相關靶標蛋白的關聯頻數。
1.5 KEGG通路富集分析
KEGG(Kyoto Enclopedia of Genes and Genomes)是東京大學和日本京都大學共同開發的數據庫,研究可以通過此信息庫進行相關通路的研究,且該信息庫與David在線互聯。為了闡明本研究方劑中相關化合物的靶點蛋白在信號通路中的作用機制,本文采用David v6.8數據庫對靶點蛋白進行信號通路富集分析,從而分析大黃附子湯所涉及的相關通路。
2 結果
2.1 大黃附子湯的有效化合物數據
表1顯示,通過TCMSP共提取到大黃附子湯中有效化合物349種,其中大黃含92種,附子含65種,細辛含192種。以OB 大于或等于30% 及DL 大于或等于0.18作為提取標準,篩選出活性化合物共45種,其中大黃含有16種,附子含有21種,細辛含有8種,所有化合物經比對并去除重復化合物后共計有39種。
2.2 大黃附子湯化合物-靶點互作網絡
圖1顯示,化合物-靶點網絡中共計有164個節點(其中化合物節點共計有26個及靶點節點138個)和602條邊,其中化合物分子以紅色節點進行標注,藥物靶點以黃色節點進行標注,每條邊代表化合物和靶點之間相關性,其中共有13個化合物未進行網絡構筑。在網絡中,一個節點度值的多少代表網絡中節點之間相連邊的數量。根據網絡拓撲學的特點,選取度值較大的節點進行探討分析。表2顯示,化合物-靶點網絡中的關鍵節點及其拓撲學性質。網絡拓撲學相關結果如下,網絡集中度0.368,網絡密度0.023,網絡異質性1.916,最短路徑26732(100%)。平均度值結果3.670731707,大于平均度值的節點共計35個;節點平均中介中心度0.013573227,大于平均中介中心度的節點共計22個。根據節點的度值和中介中心度等拓撲學特征選用核心節點分析。這些連接化合物或靶點較多的節點在整個網絡中甚至起到決定性的作用,可能是核心的化合物或靶點。

表1 大黃附子湯化合物信息特征表
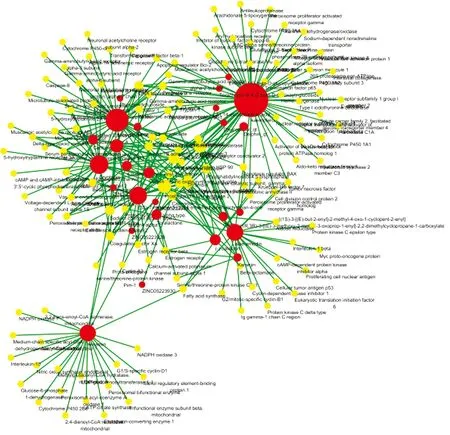
圖1 化合物-靶標關系圖

節點名稱節點類型節點度值中介中心度kaempferol化合物630.45727971beta-sitosterol化合物380.21146257Cryptopin化合物280.13304807(3S)-7-hydroxy-3-(2,3,4-trimethoxyphenyl)chroman-4-one化合物260.11886808aloe-emodin化合物240.15672641sesamin化合物230.22268755Prostaglandin G/H synthase 2靶點170.21662085EUPATIN化合物160.04435578Nuclear receptor coactivator 2靶點120.06152629Prostaglandin G/H synthase 1靶點120.05155499Heat shock protein HSP 90靶點110.04910038(-)-catechin化合物110.03680959Toralactone靶點90.013935424,9-dimethoxy-1-vinyl-$b-carboline化合物90.01425451Sodium channel protein type 5 subunit alpha靶點80.05156333Phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit, gamma iso-form靶點80.02291593DNA topoisomerase II靶點70.04485815Calmodulin靶點70.0253232mRNA of PKA Catalytic Subunit C-alpha靶點70.03393374Coagulation factor Xa靶點60.03398017Alpha-1B adrenergic receptor靶點60.01840589
網絡拓撲學分析最后表明,山奈酚(kaempferol)、β-谷甾醇(beta-sitosterol)、蘆薈大黃素(aloe-emodin)等是大黃附子湯的關鍵性化合物成分,前列腺素G/H合成酶2、熱休克蛋白HSP 90等是關鍵靶標。
山奈酚(kaempferol)是一種可從姜科植物山奈的根莖、槐樹果實等植物類果實或根莖中分離出來的有效成分[10]。現代藥理學研究結果證明,它可抑制金黃色葡萄球菌(SA)、綠膿桿菌(Pseudomonas aeruginosa)、傷寒桿菌(Salmonella typhi)等多種病原菌的生長, 具有抑制眼醛糖還原酶的作用,且能止咳祛痰兼具利尿等功效[11]。研究表明[12], 山奈酚是一類作用較大的蛋白激酶 CK2抑制劑,CK2 具有其內在的致瘤活性并與腫瘤的發生發展有著密切聯系[13],因此山奈酚可能具有一定程度抗瘤抑制作用。這一結論也與山奈酚對離體人子宮肌瘤細胞增殖具有抑制作用相符[14]。這也提示大黃附子湯可能具有抗瘤作用。
beta-sitosterol是植物甾醇類化合物—β-谷甾醇,有抗炎、抑制腫瘤、免疫調節、防治前列腺肥大、抗氧化、降血脂、鎮痛、促進傷口愈合、調節骨代謝平衡、保護胃黏膜、治療癲癇等較多的藥理作用及活性[15-16]。β-谷甾醇具有抗炎抗炎的作用[17],與現代藥理研究[18]β-谷甾醇具有較強抗炎作用不謀而合。大黃附子湯酊劑用于治療甲溝炎等炎癥[19]療效顯著,可能是此活性成分在其中起到重要作用,與臨床報道相符,從側面印證了大黃附子湯潛在的抗炎作用。
蘆薈大黃素(aloe-emodin)是一種蒽醌類生物活性成分,具有保護心血管系統、護肝、抗腫瘤、抗菌抗炎、免疫調整及瀉下等藥理作用[20]。有研究表明[21],蘆薈大黃素可明顯降低 LPS誘導的 RAW264.7細胞 NO釋放,從而抑制NO的釋放量。而諸多文獻研究成果表明[22],功能性便秘可能是由于P物質、乙酰膽堿、NO等腸神經遞質異常而引起的。也有研究顯示,大黃附子湯在便秘治療中,其機制可能與腸神經遞質的分泌有關[23]。因此,大黃附子湯在治療功能性便秘疾病時,可能是其有效化合物成分蘆薈大黃素在其中調節NO等神經遞質而起到治療功能性便秘的治療效果。這與臨床上李虹[8]等運用大黃附子湯治療便秘取得良好的療效相符。且現代藥理學研究大黃附子湯得出結論[24],其具有瀉下、興奮胃腸功能,與促進排便等藥理學功能相符。
前列腺素G/H合成酶2(Prostaglandin G/H synthase 2)被認為是“快速反應基因”,通過一系列反應起到抗炎抗癌作用[25]。Fujita H等研究發現,COX-2可以通過抑制前列腺癌細胞凋亡起到促進前列腺癌細胞增殖的作用,且COX-2與前列腺癌血管形成、癌轉移呈正相關[26]。鄧琳等研究表明,COX-2 可促進卵巢癌細胞增殖及上皮間質轉化,從而增強腫瘤細胞遷移能力[27]。COX-2作為炎性因子,會導致炎癥發生和紅腫熱痛,使用抑制劑對COX-2進行抑制則可減少這種反應[28-29]。
熱休克蛋白HSP 90(heat shock protein HSP 90)作為一種分子伴侶,具有廣泛的生物學功能。張杰等[30]定量比較(狹縫雜交法檢測)22對人肝細胞癌(HCC)及其配對非癌肝組織(PNL)和2例正常肝(NL)組織中熱休克蛋白HSP90基因mRNA的表達水平,結果顯示HSP90基因mRNA在HCC中表達最高,PNL中次之,NL中最少。此結果提示,Hsp90變化表現的時間較遲,也許在已經發生癌變的細胞中發揮某些作用,即可能與某些癌細胞如肝癌細胞的異常生長及轉移等相關。
從以上對關鍵化合物及靶標的深度分析,大黃附子湯化合物、靶標與抗癌、抗炎機制及胃腸道疾病的關系十分密切。
2.3 大黃附子湯PPI網絡的構建與分析
圖2、3顯示,為更好地理解與分析大黃附子湯的作用機制及原理,基于蛋白之間相互作用的關系,利用STRING構造本方劑中相關靶標的蛋白互作網絡圖。設置置信度大于或等于0.90,去除孤立于網絡的相關靶標蛋白,得到PPI網絡共計84個節點,470條邊,平均度值5.595238095,其中節點代表靶標蛋白,每條邊表示靶標蛋白之間的關聯性。根據節點的度值繪制大于平均度值且度值較高的9個關鍵蛋白質節點的條形圖。度值較高的3位分別為JUN、RELA、TP53,其中JUN度值(度值為23)高于其他節點,說明這個蛋白在網絡中發揮了相對重要的作用,成為聯通網絡中其他節點的關鍵節點。
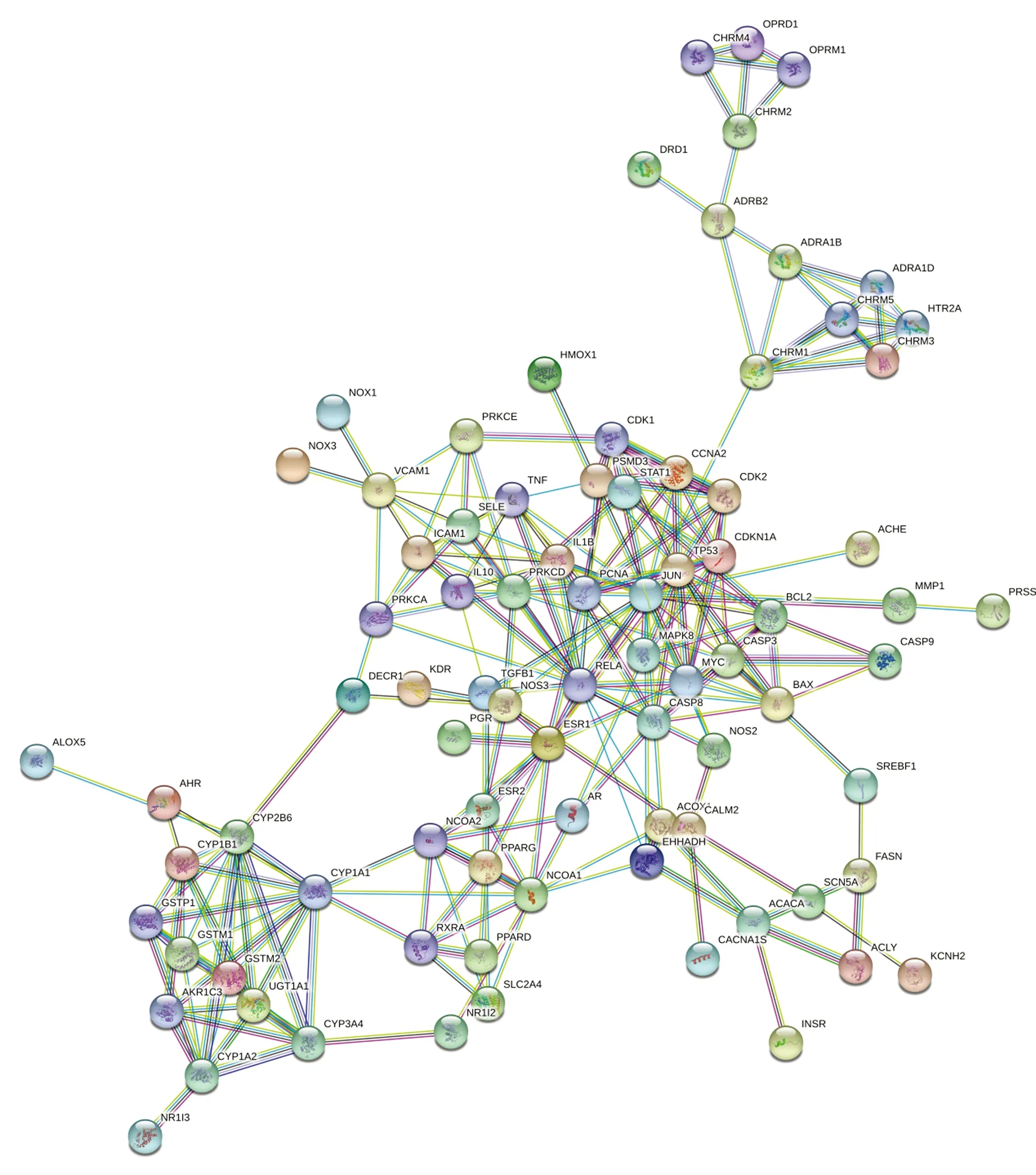
圖2 大黃附子湯靶蛋白互相作用網絡圖
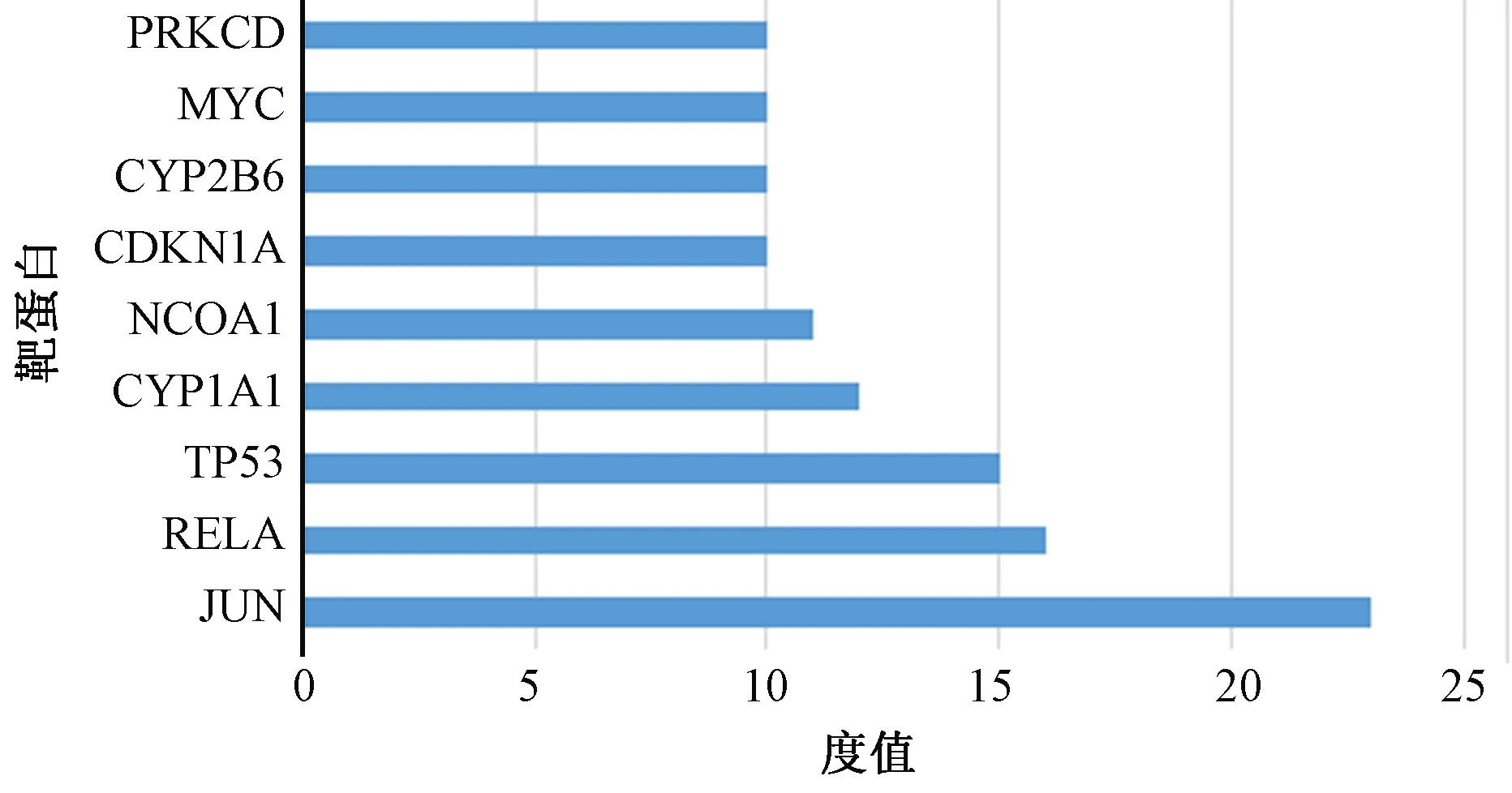
圖3 蛋白質信息條形圖
PPI網絡分析表明,JUN、RELA、TP53、CYP1A1、MAPK1等靶蛋白度值遠高于其他。c-jun蛋白水平的循環變化在腺上皮細胞的增殖和凋亡中是顯著的。c-jun蛋白的持續基質表達可以防止基質細胞在晚期分泌期進入細胞凋亡[31]。RelA/p65為NF-Kβ的亞單位,且在炎癥反應及炎癥反應相關疾病的過程中有著重要影響。NF-κB能夠引導單核巨噬細胞產生炎性細胞因子,如白細胞介素2、6、12等,從而引起強烈的炎癥反應[32]。研究顯示[33-34],外源性物質刺激生物體可以引起機體TNF-α和白細胞介素6等促炎因子的分泌,從而抗炎因子水平會降低,因而引起細胞因子水平的不平衡等,最終使得體內炎癥的發生及發展。由此推測,大黃附子湯可能是通過作用于JUN、RELA等靶蛋白,從而調整IL-2等促炎因子在體內的生物學活動,起到抗炎等生理功能。這與大黃附子湯在臨床治療急性胰腺炎[33-34]、腹膜炎[35]等炎癥疾病取得較好的臨床療效相符,從機制理論和臨床實際應用層面證實了其抗炎作用。
正常情況下TP53的活性很低,當機體受到外界刺激而引起機體DNA受到損害時其活性會提高。研究顯示,TP53基因的變化,可能與肝細胞癌的發生有較大聯系[36]。TP53突變/蛋白質分子的表達可能是2級星形膠質細胞瘤復發惡性進展的預示指征[37]。有研究認為[38],TP53基因是一種非常重要的抑癌基因,其編碼的蛋白p53能讓眾多基因保持相對穩定性,并調控細胞的相關生理過程,從而避免疾病的發生。TP53在大黃附子湯PPI網絡中度值較高,因此其作用也不可忽視。由此推測,大黃附子湯有其內在的抗瘤作用及活性,可能是通過TP53基因蛋白的作用而發揮抗瘤的生物學功能。
2.4 KEGG通路富集分析
表3顯示,使用David v6.8數據庫對大黃附子湯靶蛋白基因進行信息通路富集,結果共有122條生物信息通路,計算每條富集通路的p值(P 值小于0.01為顯著富集),對P值排序后取前10名進行分析。
為更深層次地探究大黃附子湯作用靶點在生物信號通路層面的機理,本文利用KEGG通路富集對大黃附子湯靶標基因進行研究。結果表明,差異有統計學意義的10條相關通路分別是Chemical carcinogenesis、Metabolism of xenobiotics by cytochrome P450、Hepatitis B、Drug metabolism- cytochrome P450、Steroid hormone biosynthesis、Retinol metabolism、Drug metabolism- other enzymes、Colorectal cancer、Pentose and glucuronate interconversions、Ascorbate and aldarate metabolism。由上述KEGG富集結果分析可知,大黃附子湯與化學致癌相關通路、細胞色素P450相關通路及視黃醇代謝等相關通路有較大聯系。因此本文試圖從以上幾個主要方面進行機制探討與分析,試圖理解大黃附子湯在基因功能及信號通路層面的作用機制。

表3 KEGG通路富集情況表(Top 10)
細胞色素P450不僅是內源性物質的代謝酶,同時也是外源性物質的代謝酶,參與的代謝有致癌物質和臨床藥物治療等,并具有重要的生物學功能如激素合成、外源物質降解、致癌物質消除等[39]。其中,CYP1A1等為細胞色素P450的亞型。與PPI網絡中CYP1A1出現在度值較高具有某種內在聯系,說明細胞色素P450及其亞型CYP1等在其相關通路中發揮著重要作用。有研究表明[40-41],CYP1A1的多態性基因或許會提高乳腺癌的患病概率。同時也有相關研究指出,有一類細胞保護機制是表達CYPs,如某些腫瘤細胞會通過此途徑提供給癌細胞某一類未知的解毒藥物或對癌細胞有害的物質,從而提高相關癌細胞的生存幾率[42]。由此本文認為,大黃附子湯可能是通過細胞色素P450相關通路,調整CYP1等亞型破壞腫瘤細胞的保護機制,從而起到治療癌癥的作用。
3 討論
本文運用系統藥理學對大黃附子湯的作用機制及原理進行分子機制、基因及信號通路等層面的分析,認為大黃附子湯可能是其核心化合物山奈酚(kaempferol)、β-谷甾醇(beta-sitosterol)、蘆薈大黃素(aloe-emodin)等通過Chemical carcinogenesis、Metabolism of xenobiotics by cytochrome P450等相關通路作用于JUN、RELA、TP53、CYP1A1、MAPK1等靶標而起治療作用。結果發現,大黃附子湯在治療消化系統疾病方面如便秘具有很強的科學性,由化合物-靶標網絡分析可知,其可能是通過蘆薈大黃素(aloe-emodin)等化合物、靶標及相關通路促進排便從而治療便秘。這與大黃附子湯傳統用法及現代臨床應用[8,43]相符合,同時也驗證了其在臨床上具有抗炎活性的理論機制,如臨床應用其治療如胰腺炎、腹膜炎等炎癥疾病。由PPI分析、David通路富集分析可知,大黃附子湯在理論上具有抗癌抗瘤潛在作用機制,但是臨床及基礎實驗研究中極少提及大黃附子湯在治療癌癥疾病方面有特別之處。因此,大黃附子湯是否具有抗癌抗瘤作用及其臨床療效如何,可以作為今后研究的一個方向。

