CEUS定量分析聯合血清uPA、Hpa檢測在甲狀腺結節性質判斷中的價值
李檸肖,鄺永衛,陳君耀,竇丹燕
(海南醫學院第二附屬醫院,海口570203)
甲狀腺結節大部分為良性病變,少部分為惡性癌變。甲狀腺的位置表淺,對于觸診檢查不滿意的甲狀腺結節,臨床常采用超聲診斷。常規超聲造影(CEUS)可通過增強模式和增強強度進行定性診斷,而CEUS定量技術可通過甲狀腺造影灌注的實時相關曲線參數實現定量分析,有利于提高臨床診斷效率[1]。目前,CEUS定量分析在消化道及腹腔惡性腫瘤的臨床診斷中應用廣泛,但在甲狀腺結節的性質鑒別上尚缺乏統一標準。結節病變組織病理復雜,CEUS時由于儀器的靈敏度及圖像分析技術差異可致結果差異。近年研究[2]發現,乙酰肝素酶(Hpa)、尿激酶纖溶酶原激活物(uPA)與甲狀腺結節關系密切,其與甲狀腺惡性腫瘤的發生發展、侵襲轉移及預后有密切關系,可作為潛在新的腫瘤標志物。本研究通過分析甲狀腺結節患者臨床資料,研究CEUS定量分析聯合血清uPA、Hpa檢測在甲狀腺結節性質判斷中的價值。
1 資料與方法
1.1 臨床資料 選擇2013年1月~2016年12月于本院進行治療的300例甲狀腺結節患者,男185例、女115例,年齡24~77(48.92±6.13)歲。納入標準:①在本院進行甲狀腺結節穿刺活檢或手術切除的患者;②病理診斷符合WHO甲狀腺腫瘤組織學分類標準[3];③在檢查前與患者及家屬談話,獲得知情同意書。排除標準:①同時并發其他惡性腫瘤的患者;②伴有心臟、肝臟、腎臟功能障礙患者;③甲狀腺微小癌患者;④對造影劑過敏的患者;⑤甲狀腺功能亢進、甲狀腺功能減退、橋本甲狀腺炎;⑥術前進行過手術、放療、化療等治療的患者。納入的300例患者中176例經術前穿刺活檢證實,124例手術切除治療并于術后進行組織病理檢測證實。本研究獲得本院倫理委員會批準,患者或其家屬知情同意。
1.2 CEUS定量分析 采用Simens2000彩色多普勒超聲診斷儀進行檢測,設置探頭頻率為5~9 MHz。超聲造影劑為SonoVue(Bracco公司)。注入前使用5 mL生理鹽水振蕩混勻備用,患者采取平臥位,頭部后仰,充分暴露頸部前區,先行常規二維彩色多普勒超聲檢查,觀察甲狀腺結節的大小、位置、形態、包膜、邊界、是否鈣化等,做出CEUS初步診斷。使用雙幅顯示功能,將結節固定于能顯示結節及結節周圍部分的最大切面,抽1 mL備好的造影劑于肘部淺靜脈團注,隨后注入5 mL生理鹽水沖洗使造影劑進入血液循環,開啟計時器,連續觀察造影過程3 min,觀察期間囑患者保持平靜呼吸,避免吞咽,將造影圖像動態儲存至硬盤。造影結束后,使用Contrast Dynamic 分析軟件進行造影圖像定量分析,觀察比較結節的超聲造影增強模式,選取感興趣區域,進行結合時間-強度曲線定量分析。分析峰值強度(PD)、達峰時間(TTP)、平均渡越時間(MTT)。所有數據由兩名經驗豐富的醫師進行獨立分析,意見不一致時兩人進行分析討論最后給出統一結論。
1.3 血清uPA、Hpa檢測 于術前清晨空腹采集所有患者外周血5 mL,3 000 r/min離心10 min,去上清,-80 ℃保存。采用ELISA法檢測血清uPA、Hpa濃度,試劑盒購自上海晶抗生物工程有限公司,所有操作嚴格按照說明書進行。
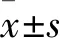
2 結果
2.1 病理檢測結果 共324個結節,結節最大直徑0.3~4.1(1.96±0.64)cm。穿刺活檢和術后病理檢查結果證實良性甲狀腺結節患者220例共236個結節(良性組),其中甲狀腺腺瘤122例,結節性甲狀腺腫86例,其他良性甲狀腺結節12例;惡性甲狀腺結節患者80例共88個結節(惡性組),其中乳頭狀甲狀腺癌50例,濾泡性甲狀腺癌24例,其他類型甲狀腺癌6例。
2.2 二維彩色多普勒超聲檢測結果 良性組邊界清晰167個(70.76%),不清晰69個(29.24%);內部回聲均勻188個(79.66%),不均勻48個(20.34%);形態規則150個(63.56%),不規則86個(36.44%);有鈣化70個(29.66%),無鈣化166個(70.34%)。惡性組邊界清晰25個(28.41%),不清晰63個(71.59%);內部回聲均勻32個(36.36%),不均勻56個(63.64%);形態規則23個(26.14%),不規則65個(73.86%);有鈣化46個(52.27%),無鈣化42個(47.73%)。兩組腫塊邊界、內部回聲、形態和鈣化情況比較差異有統計學意義(P均<0.05)。惡性結節多表現為邊界不清晰、形態不規則,內部回聲不均勻;良性結節在常規超聲中多表現為邊界清晰、內部回聲均勻。
2.3 CEUS定量分析檢測結果 良性組和惡性組的時間-強度曲線中,PD、TTP和AUC差異有統計學意義(P均<0.05),良性組和惡性組MTT比較差異無統計學意義(P>0.05),見表1。

表1 兩組CEUS定量分析檢測結果比較
2.4 CEUS定量分析判斷結節性質的價值 88枚惡性甲狀腺結節,經超聲造影及定量分析確診70枚,誤診良性18枚;236枚良性甲狀腺結節,經超聲造影及定量分析確診211枚,誤診為惡性甲狀腺結節25枚。CEUS定量分析判斷結節性質的靈敏度為79.54%,特異度為89.41%,診斷準確率為80.25%。
2.5 兩組血清uPA、Hpa水平比較 良性組與惡性組血清uPA水平分別為(814.76±197.83)、(1 254.18±361.35)pg/mL,血清Hpa水平分別為(44.67±12.29)、(79.83±140.34)U/mL,兩組比較差異有統計學意義(P均<0.05)。
2.6 各指標檢測的診斷效能比較 繪制的ROC曲線見圖1。血清Hpa檢測的臨界值為56.24 U/mL,AUC為0.760;uPA單項檢測的臨界值為1 036.75 pg/mL,AUC為0.784。CEUS定量分析、Hpa、uPA聯合檢測的AUC為0.906,高于單項檢測(P均<0.05)。聯合檢測靈敏度為90.90%,高于單項檢測(P<0.05);聯合檢測特異度為80.09%,與單項檢測比較差異無統計學意義(P>0.05);CEUS定量分析、Hpa、uPA單項檢測與聯合檢測診斷效能比較見表2。

圖1 CEUS定量分析、Hpa、uPA單項檢測與聯合檢測診斷甲狀腺結節的ROC曲線表2 CEUS定量分析、Hpa、uPA單項檢測與聯合檢測診斷效能比較

指標AUC標準誤95%可信區間靈敏度 特異度CEUS定量分析0.8010.260.750~0.85279.54%(70/88)89.83%(212/236)Hpa0.7600.270.707~0.81273.86%(65/88)85.17%(201/236)uPA0.7840.280.728~0.84070.45%(62/88)86.86%(205/236)CEUS定量分析聯合Hpa、uPA0.9060.160.874~0.93890.90%(80/88)80.09%(189/236)
3 討論
甲狀腺結節的發病率居內分泌腺體腫瘤的第一位,近年呈上升趨勢[4]。大部分甲狀腺結節為良性結節,少部分為惡性腫瘤,且惡性腫瘤中80%為低度惡性,如甲狀腺乳頭狀癌,只有少部分為高度惡性的甲狀腺未分化癌,所以確定甲狀腺結節的性質是臨床治療關鍵[5]。超聲診斷已成為甲狀腺結節病變臨床首選影像學檢查方法,但各良惡性結節腫塊在不同增生時期,其常規二維超聲特征復雜多樣,具有一定的交叉和重疊性,且人為因素亦會影響其客觀性,術前準確診斷仍有一定難度。CEUS定量分析可通過造影結合時間-強度曲線來實現定量分析,提高診斷的準確率[6]。uPA和Hpa是近年來廣受關注的兩種新的腫瘤標志物,與惡性腫瘤的發生發展和轉移密切相關[7]。 本研究結果顯示,甲狀腺癌的二維超聲主要特點為形狀不規則、邊界不清晰、無完整包膜、邊緣不光整,可伴有微鈣化,實質性低回聲,其后方回聲衰減、無完整聲暈;良性結節多表現為邊界清晰、邊緣光滑,表現為囊性或實行結節,高回聲、回聲均勻,聲暈完整,二者表現差異有統計學意義。通過超聲造影的增強模式比較發現,惡性結節多表現為不均勻強化(慢進低增強、不均勻低增強),良性結節多表現為均勻高增強或周邊環形高增強、快進低增強。時間-強度曲線定量分析發現,良性組和惡性組PD、TTP比較差異有統計學意義。原因是惡性腫瘤內部血管生長迅速,過快的惡性生長破壞正常組織結構,導致惡性結節內的血管走向雜亂無章,與原有血管不協調;與良性結節和周圍組織相比,惡性結節表現出不同的微血管密度,在增強模式上則表現為不均勻增強[8]。良性結節多為增生性病變,組織長期處于反復增生、修復過程,進而形成結節,膨脹性生長的瘤體會將正常血管往周邊推,形成周邊環狀血流,結節的血流狀態一般改變不大,較接近于正常組織,所以在增強模式上表現為周邊環形增強或均勻性增強[9]。本研究納入的良性結節多為甲狀腺腺瘤和結節性甲狀腺腫,這兩種結節血供豐富,瘤體對血管的破壞較少,所以造影劑進入更多,PD更大,表現為更大的時間-強度曲線下面積。
惡性甲狀腺腫瘤臨床比例較低,發病隱匿,不易察覺,大多在確診時可能已伴有不同程度轉移,據報道,20%~35%的甲狀腺癌患者死于癌細胞的擴散和轉移[10]。Hpa是哺乳動物體內的一種葡萄糖醛酸酯酶,是體內惟一能對乙酰肝素進行特異性識別和剪切的酶,廣泛存在于細胞膜和外基質中,參與腫瘤細胞的增殖分化、侵襲和轉移,一般在正常組織中不表達或低表達,在甲狀腺乳頭狀癌患者血清中呈高表達,對甲狀腺癌的診斷有指導意義[11]。uPA 是一種絲氨酸蛋白酶,屬于纖維蛋白溶解系統,由腫瘤細胞分泌,與腫瘤生長、浸潤和轉移有關,在諸多惡性腫瘤組織、血清、血漿中檢測到高表達[12],Higashi等[13]發現,高活性的uPA主要由甲狀腺乳頭狀癌細胞分泌,因此認為uPA可作為甲狀腺癌檢測和治療的指標。李建業等[14]采用免疫組化檢測到uPA在分化型甲狀腺癌組織中表達,且與Hpa的表達呈正相關關系,認為Hpa和uPA參與甲狀腺癌的發生發展,且與腫瘤分化程度相關。研究發現,Hpa過表達會破壞體內乙酰肝素的平衡,破壞細胞外基質和基底膜的穩定性,損害細胞間質的屏障功能,加速腫瘤細胞的侵襲和轉移,促進腫瘤發展;同時細胞外基質的降解會導致腫瘤細胞外基質上uPA釋放,增強腫瘤細胞侵襲作用[13,15]。
本研究結果顯示,單項檢測的AUC在0.760~0.801,均有較高的診斷價值,同時單項檢測均有較好的特異度,但靈敏度仍有待提升;獲得血清Hpa、uPA的診斷臨界值分別為56.24 U/mL、1 036.75 pg/mL。李建業等[16]研究發現,Hpa、uPA兩者聯合檢測的AUC為0.812,顯著高于單項檢測,可預測淋巴結是否轉移。何穎等[17]發現,聯合檢測診斷甲狀腺癌的靈敏度和特異度分別是90.48%、84.75%。本研究以CEUS定量分析檢測結果為陽性,且同時血清uPA、Hpa中任意指標檢測陽性為聯合診斷陽性,聯合診斷AUC為0.906,靈敏度為90.90%,特異度為80.09%,診斷價值高。
綜上所述,CEUS定量分析聯合血清uPA、Hpa有助于判斷甲狀腺結節的性質。

