促紅細胞生成素對缺氧誘導大鼠心肌細胞凋亡的影響及機制
熊建文,謝兆豐,江志忠,張建興,鄧偉,張利洪,張智偉
(1南方醫科大學第五附屬醫院,廣州510900;2廣東省人民醫院心血管病研究所)
促紅細胞生成素(EPO)是紅系細胞增生、分化及凋亡的關鍵調節因子。研究[1]發現,其對缺血再灌注損傷時的神經元有減少細胞凋亡的保護作用。另有研究[2]表明,轉錄因子GATA-4在減輕心肌細胞缺血再灌注損傷中發揮作用 。PI3K-Akt信號通路介導多個細胞內信號轉導,通過影響下游多種效應分子的活化狀態,促進細胞增殖[3],為促肝細胞癌發生的分子機制之一[4]。腫瘤發生的機制主要為某組織出現失控的病理性增殖,生理性凋亡被重度抑制[5]。我們認為其促腫瘤效應通過PI3K/Akt途徑激活、上調,發揮抗凋亡效應實現。這種分子機制的上調在心肌細胞缺氧情況下是否發揮保護作用尚不清楚。EPO是否對PI3K/Akt信號通路產生影響及進一步影響心肌細胞凋亡,目前尚不明確。2018年3~8月,本實驗擬建立缺氧誘導心肌細胞凋亡實驗模型,通過比色法和細胞流式法測定EPO或LY294002(PI3K特異性抑制劑)或IGF-1(PI3K特異性激活劑)干預下的肌酸激酶(CK)、乳酸脫氫酶(LDH)活力、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)陽性表達率和細胞凋亡率的變化,明確EPO能否影響缺氧誘導的心肌細胞凋亡,同時探討凋亡的可能分子機制。
1 材料與方法
1.1 主要材料與試劑 新生1~3 d的雄性SD大鼠15只[南方醫科大學實驗動物中心提供,動物許可證號SCXK(粵))2007-0006],體質量約300 g;重組促紅細胞生成素(rhEPO)購自以色列ProSpec-Tany TechnoGene Ltd公司;肌酸激酶(CK)試劑盒、乳酸脫氫酶(LDH)試劑盒購自南京建成生物工程研究所;十二烷基硫酸鈉(SDS)購自Sigma公司;CO2培養箱(Shellab 2306和Shellab 2323型,USA);ELX800全自動酶標儀(USA)。異硫氰酸熒光素(FITC)標記的人膜聯蛋白V(Annexin V)聯合碘化丙啶(PI)染色法細胞凋亡檢測試劑盒購自美國Yeasen公司。
1.2 心肌細胞原代培養 無菌操作取出新生大鼠的心室肌組織,磷酸緩沖液(PBS)沖洗并剪碎,組織胰酶消化法分離細胞,差速貼壁法和BrdU化學抑制法純化。用20%胎牛血清的DMEM培養基制成細胞懸液,并以1×109/L濃度接種至培養瓶中。5%CO2、37 ℃培養1~2 h,吸出細胞懸液,再接種至培養瓶中繼續培養,每2~3 d換液,待細胞長至瓶底面積的80%時傳代。
1.3 缺氧模型的建立及實驗分組 實驗前24 h按1×1010/L濃度接種至培養瓶中更換成無血清培養基,24 h后將培養瓶轉至厭氧培養箱中,抽真空至0.1 mPa,以95%N2、5%CO2填充,培養3 h后即為缺氧新生大鼠心肌細胞模型,并移至CO2培養箱中常規繼續培養1 h。設立正常對照組、缺氧組及低、中、高EPO干預組、LY294002干預組、IGF-1干預組共7組,正常對照組于CO2培養箱中培養,不經缺氧處理或藥物干預。缺氧組細胞經缺氧處理,不予任何藥物干預。低EPO干預組:以6.25 IU/mL的EPO預處理細胞24 h,再予缺氧處理。中EPO干預組:以25 IU/mL的EPO預處理細胞24 h,再予缺氧處理。高EPO干預組:以100 IU/mL的EPO預處理細胞24 h,再予缺氧處理。LY294002干預組:以LY294002(終濃度50 μmol/L)預處理1 h,后予缺氧處理。IGF-1干預組:以IGF-1(200 ng/mL)預處理細胞1 h,后予缺氧處理。
1.4 LDH、CK活力測定 采用比色法。細胞培養并分組干預結束后,按試劑盒操作說明書步驟收集細胞、處理檢測樣品,獲得細胞上清液。最后用酶標儀在激發波長405 nm處測定光密度(OD)值,計算CK、LDH的活力。
1.5 Caspase-3陽性表達率測算 采用流式細胞術。完成細胞培養并分組干預處理,胰酶消化后離心,1 000 r/min,5 min,收集細胞,棄上清液,細胞轉移至1.5 mL Eppendorf管中,然后進行以下操作:①用預冷的PBS洗2次;②細胞沉淀中加入300 L洗滌緩沖液,然后加入Caspase-3抑制劑Z-VAD-FMK 1 L,搖勻后置37 ℃、5% CO2孵箱中孵育30 min;③3 000 r/min,離心5 min,棄上清液,留用細胞沉淀,0.5 mL洗滌緩沖液重懸細胞沉淀,再次離心棄上清液,留細胞沉淀,進行2次0.5 mL洗滌緩沖液重懸細胞沉淀,流式細胞儀檢測,用Multicycle軟件分析Caspase-3表達。
1.6 心肌細胞凋亡率測算 采用流式細胞術Annexin V/PI雙染法檢測。完成干預培養后,選擇對數生長期細胞,1 000 r/min,離心5 min,收集細胞,棄上清液,將細胞轉移至1.5 mL Eppendorf管中,繼續以下操作:①用預冷的PBS(pH7.4)將細胞沉淀離心(800 r/min,5 min)洗滌2次;②加入100 μL Binding緩沖液和FITC-Annexin V(20 μg/mL)10 μL,室溫避光靜置30 min;③加入PI(50 μg/mL)5 μL,避光反應5 min,加入400 μL Binding緩沖液。最后以FACScan進行流式細胞術檢測分析。
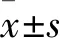
2 結果
2.1 各組心肌細胞上清液中CK、LDH活力比較 經EPO預處理,缺氧誘導的心肌細胞CK、LDH活力降低,呈劑量依賴性,低EPO干預組、中EPO干預組、高EPO干預組組間CK、LDH活力比較,P均<0.01;各組心肌細胞上清液中CK、LDH活力比較見表1。
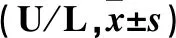
表1 各組心肌細胞上清液中CK、LDH活力比較
注:與正常對照組比較,*P<0.01;與缺氧組比較,#P<0.01;與LY294002干預組比較,cP<0.01。
2.2 各組Caspase-3陽性表達率比較 正常對照組、缺氧組、低、中、高EPO干預組、LY294002干預組及IGF-1干預組Caspase-3蛋白陽性表達率分別為1.093±0.742、48.933±3.109、45.667±6.646、13.650±4.455、3.360±0.415、84.683±6.806、3.470±0.402,缺氧組Caspase-3蛋白陽性表達率高于正常對照組(P<0.01)。低、中、高EPO干預組Caspase-3蛋白陽性表達率均低于缺氧組(P均<0.01),低、中、高EPO干預組間比較差異有統計學意義(P均<0.01)。
2.3 各組細胞凋亡率比較 正常對照組、缺氧組、低、中、高EPO干預組、LY294002干預組及IGF-1干預組心肌細胞凋亡率分別為0.63%±0.1%、35.6%±1.3%、22.4%±2.1%、12.9%±2.3%、5.39%±1.1%、83.5%±2.1%、5.01%±1.1%,各組間比較,P均<0.01。
3 討論
凋亡造成心肌細胞減少是人類多種心臟疾病的重要原因,如缺血性心肌病等[6]。凋亡為維持內環境穩定,由基因控制的細胞自主有序的死亡,但凋亡發展至晚期階段,其表現類似于細胞壞死。CK、LDH是位于細胞內的酶類,在凋亡晚期階段,細胞膜破壞時釋放至細胞外而被檢測到,而心肌細胞富含CK、LDH。即使在臨床實踐中,比色法檢測CK、LDH活力,亦是評估心肌細胞壞死的重要方法。
凋亡信號轉導是一個復雜的、由Caspases家族成員介導的蛋白酶級聯反應過程,不同的啟動性Caspases介導不同的凋亡信號。效應性Caspases激活后主要從以下幾方面導致細胞凋亡:①激活凋亡特異性核酸酶,水解DNA導致細胞凋亡的發生;②降解細胞骨架蛋白;③裂解DNA修復的關鍵酶-多聚ADP核糖多聚酶等。正常細胞中Caspase-3以酶原形式存在于胞質中,在凋亡的早期階段被激活,活化的 Caspase-3由兩個大小亞基組成, 裂解相應的胞質胞核底物,最終導致細胞凋亡。流式細胞術檢測Caspase-3蛋白表達是當今研究細胞凋亡的主流方法之一。因此,Caspase-3常被作為細胞凋亡的早期檢測指標。
在眾多檢測細胞凋亡的流式細胞術方法中,Annexin V /PI法是目前較為流行的檢測方法。細胞凋亡早期,細胞膜脂雙層結構中內層的磷脂酰絲氨酸外翻,暴露于細胞膜表面。Annexin V是一種磷脂結合蛋白,與PS有高度親和力,故可通過細胞外側暴露的PS與凋亡早期細胞的胞膜結合。PI是一種核酸染料,不能透過完整的細胞膜,但凋亡中晚期的細胞和壞死細胞由于細胞膜通透性的增加,PI能透過細胞膜而使細胞核染紅。PI 被排除在活細胞(Annexin V-/PI-)和早期凋亡細胞(Annexin V+/PI-)之外,而晚期凋亡細胞和壞死細胞同時被FITC- Annexin V 和PI 結合染色呈現雙陽性(Annexin V+/PI+)。因此將Annexin V與PI匹配使用,就可將處于不同凋亡時期的細胞區分開來。因此,因此Annexin V/PI法是目前較為理想的檢測細胞凋亡方法。其缺點是細胞膜的改變持續時間有限,選擇檢測的時機較重要[7]。
本實驗結果顯示,EPO預處理可減輕缺氧誘導的CK、LDH酶的活力,降低細胞Caspase-3的陽性表達率及Annexin V/PI法細胞凋亡率。CK、LDH作為心肌細胞壞死標志物,Caspase-3作為作為細胞凋亡指標,干預后上述指標均下降,且這種保護作用呈劑量相關性,證明EPO具有保護心肌細胞、減輕心肌細胞凋亡、抑制缺氧誘導心肌細胞損傷的作用。EPO干預后,Caspase-3陽性表達率和細胞凋亡率明顯下降,進一步提示EPO具有抗細胞凋亡的效應。Yamanaka 等[8]夾閉脊髓的供血動脈4 min,建立脊髓缺血性損傷動物模型,注射EPO干預,結果提示EPO有協同二氮嗪減輕凋亡作用。另一項研究表明,EPO對癲癇持續狀態的SD大鼠具有保護作用,其機制為減輕海馬神經元的凋亡[9]。上述研究結果均提示EPO在不同組織細胞中均有抗凋亡、減輕缺血、缺氧損傷作用。本研究結果顯示,EPO對心肌細胞有抑制凋亡、減少缺氧損傷的效應。EPO促紅系細胞生成分化、組織保護等多種作用通過與不同受體結合實現。Leist等[10]研究發現,EPO的某些衍生物(如甲氨酰化EPO)或突變體不與經典的EPO受體結合,在動物體內和體外細胞實驗中具有與EPO同等的細胞保護效力,但無促造血系統的作用。EPO促進紅系細胞增殖、分化的作用廣泛用于腎性貧血患者。近來年,EPO紅系細胞外的機體保護作用逐漸受到重視,但多數研究均集中于EPO對神經系統的保護方面。與目前已有研究不同,本研究將EPO保護機制探索領域轉移到心肌細胞,結果顯示,PI3K特異性抑制劑LY294002預處理可加重缺氧誘導的心肌細胞凋亡;PI3K特異性激活劑IGF-1預處理可抑制缺氧誘導的心肌細胞凋亡。提示PI3K/Akt信號途徑活化可抑制缺氧誘導的心肌細胞凋亡,PI3K/Akt信號途徑參與了缺氧誘導的心肌細胞凋亡機制。在EPO對視網膜神經節細胞[11]、神經元[12]保護作用研究中,ERK磷酸化介導EPO對細胞生存信號通路的促進,在EPO的保護機制中發揮關鍵作用。EPO的細胞保護作用還與維持線粒體跨膜電位有關[13]。如果檢測線粒體跨膜電位將有助于了解EPO在本實驗對線粒體穩定的影響。Chong等[14]研究發現,EPO對暴露于高糖中的血管內皮細胞有顯著保護作用。這些實驗使用不同細胞及誘導物,與本實驗結果基本相同,EPO具有抗炎、抗過氧化、抗凋亡、促血管生成作用,從而發揮細胞保護作用。
綜上所述,EPO可抑制缺氧誘導心肌細胞凋亡,其機制可能與PI3K/Akt信號途徑有關。但本研究未能對PI3K蛋白表達和pAkt蛋白表達進行檢測是本實驗的局限之一。

