干旱高溫互作下高山杜鵑幼苗生理生化變化研究
李小玲,韓 潔,侯 瑤,華智銳
(商洛學院 生物醫藥與食品工程學院,陜西 商洛 726000)
植物在其生長發育過程中常常遭受生物因子及各種非生物因子的脅迫,其中非生物因子是主要的危害因素。近年來,頻繁的人類活動排放了大量的溫室氣體,致使全球氣溫不斷上升,隨著全球氣候變暖,極端天氣的頻繁發生,如局部地區的異常干旱、高溫等已成為影響植物生長發育的重要環境因子。研究發現,在干旱、高溫互作下,植物體內積累大量的有害物質,如活性氧,引起膜質過氧化作用,抑制植物的光合作用,降低植物體內水分利用效率,最終導致植物生長發育受阻和形態發生變化。為了抵御干旱高溫對植物體的傷害,植物通過自身保護機制以降低逆境對其造成的傷害[1]。干旱、高溫不僅影響植物的生理生態過程,還成為限制植物的分布、生長和生產力的重要生態因子[2]。
杜鵑花是杜鵑花屬(Rhododendron)植物的統稱,屬于世界三大高山野生花卉之一,具有極高的觀賞及園林應用價值[3]。據調查,世界杜鵑花屬植物約有967種,我國作為世界杜鵑花資源最為豐富的地區,分布有原生種571種,其中特有種約409種,占國有種的71.6%[4]。而秦嶺地區的野生杜鵑花屬植物共有28種,占我國杜鵑花種類的5.1%[5]。秦嶺是我國杜鵑花分布的重要區域之一,且單種蘊藏量較大,耐寒性較強。秦嶺野生的杜鵑花植物作為西北地區急需開發的野生資源之一,其花朵鮮艷、枝葉繁茂,且能藥食兩用,具有極高的觀賞價值和開發利用價值[5]。杜鵑花屬植物常叢生為密不可分的灌木林,因其密集的枝條、發達的根系,在耐受極端的高山氣候環境、保持高山土壤、防止山體滑坡等方面起到作用,著稱優良的山地水土保持植物[6]。地處商洛市鎮安縣的國家木王林場中分布有秀雅杜鵑(R.concinnum)、美容杜鵑(R.calophytum)、頭花杜鵑(R.capitatum)、照山白(R.micranthum)等,其中美容杜鵑的數量最多并且分布面積最廣[7]。杜鵑花生態習性為喜冷涼、多霧、濕潤氣候,忌高溫干旱,較耐陰,光照過強常引起植株失水、葉片黃化,甚至造成日灼;光照不足影響光合作用和開花結果數量。故此,開展高山杜鵑干旱高溫互作機理的研究能為杜鵑的引種栽培提供理論參考。
目前對高山杜鵑抗逆性方面的研究大多集中于耐寒或耐高溫等單一逆境因子方面[8-11],而對于干旱高溫雙重脅迫研究尚未見報道。鑒于此,本研究以秦嶺高山杜鵑為材料,探討其在干旱高溫互作下的生長表現及葉片相應生理生化指標的變化,從理論上揭示高山杜鵑對高溫脅迫的生理生態適應機制,豐富杜鵑花的生理研究內容,并通過對干旱高溫互作下生理生化指標響應的研究及主因子的分析,為耐干旱高溫種質的遺傳改良和人工引種栽培提供理論依據。
1 材料和方法
1.1 試驗材料試驗所用高山杜鵑幼苗于2017年3月上旬采自商洛市鎮安縣國家木王林場海拔1500 m左右的杜鵑花景區。
1.2 試驗方法
1.2.1 杜鵑幼苗的預培養 將采集的大小一致、生長狀態良好的兩年生高山杜鵑實生苗移栽到直徑20 cm的花盆中,每盆栽兩株,培養基質為腐葉土∶松針土=1∶2,每天傍晚適時噴灑0.1%~0.5%的硫酸亞鐵保持70%~80%的相對濕潤,在人工氣候箱中25~27 ℃培養1周。
1.2.2 試驗設計 配制濃度為10%、15%、20%聚乙二醇(PEG-6000)溶液,設輕度干旱脅迫 (10% PEG)、中度干旱脅迫 (15% PEG)、重度干旱脅迫 (20% PEG)處理。在人工氣候箱中進行溫度處理。空氣相對濕度為75%,光照時間為12 h/d,光照強度為3級;設 25 ℃(對照)、33 ℃(輕度高溫脅迫)、40 ℃(重度高溫脅迫)3個溫度梯度。干旱與溫度交叉結合對高山杜鵑幼苗進行脅迫處理(表1),每天下午18:00對高山杜鵑幼苗葉片噴灑PEG-6000進行干旱脅迫,以室溫栽培和噴灑蒸餾水的植物為對照(CK)。每處理3次重復,每次重復3株苗。處理后隔天采樣,立即剪下適宜的葉片,洗凈,用蒸餾水沖洗,除去葉脈后剪碎,用于測定MDA含量、脯氨酸含量、可溶性蛋白含量等生理指標。

表1 干旱高溫互作試驗設計
1.2.3 生理指標的測定脯氨酸含量的測定參照李小方[12]的茚三酮法,相對電導率的測定參照陳建勛等[13]的浸泡法,MDA含量的測定參照張志良等[14]的硫代巴比妥酸法,SOD活性的測定參照李合生[15]的氮藍四唑(NBT)光還原法,POD活性的測定參照郝再彬等[16]的愈創木酚顯色法,CAT活性的測定參照高俊風等[17]的紫外光譜法,可溶性蛋白含量的測定參照高俊風等[17]的考馬斯亮藍G-250法。
1.3 數據處理
所有處理每次重復測定3次,數據為3次測定值的平均值,用Excel 2010進行數據統計,用SPSS 17.0軟件進行數據分析。
2 結果與分析
2.1 干旱高溫互作對高山杜鵑幼苗脯氨酸含量的影響
由圖1可知,與對照組相比,干旱高溫互作下各處理組的脯氨酸含量隨脅迫時間的延長而持續升高,但是各處理組的脯氨酸含量有明顯差異。與CK相比,T1、T2、T3的脯氨酸含量變化不顯著(P>0.05);而在其它濃度的處理下脯氨酸含量有顯著性差異(P<0.05),脯氨酸含量隨著脅迫時間的延長呈現逐漸增大的趨勢。其中在40 ℃高溫下,用20%的PEG處理下影響最大,其脯氨酸含量平均高達對照組的283.3%。
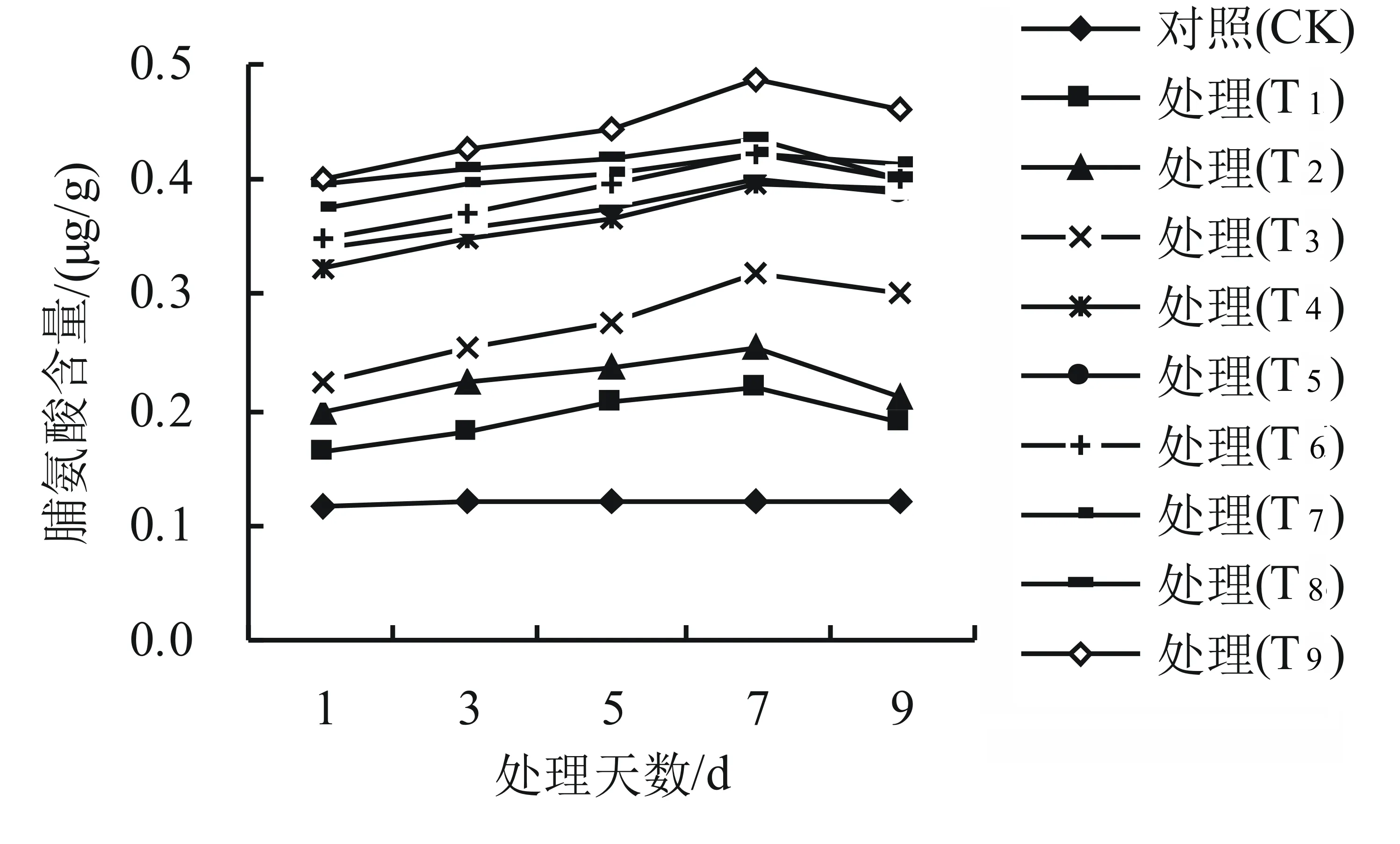
圖1 干旱高溫互作對高山杜鵑幼苗脯氨酸含量的影響
2.2 干旱高溫互作對高山杜鵑幼苗相對電導率的影響
相對電導率是衡量細胞膜透性的重要指標。由圖2可以看出,對照組的相對電導率變化不顯著;隨著干旱高溫脅迫時間的延長,各處理的相對電導率均有較大幅度的增加。對照組葉片的相對電導率為31.5%,在脅迫處理9 d后,各處理的相對電導率分別比對照組增加了96.2%、99.4%、108.9%、109.5%、120.0%、131.4%、134.3%、145.1%、163.8%。相對電導率的值越大,電解質的滲漏量越多,細胞膜受害程度越重。
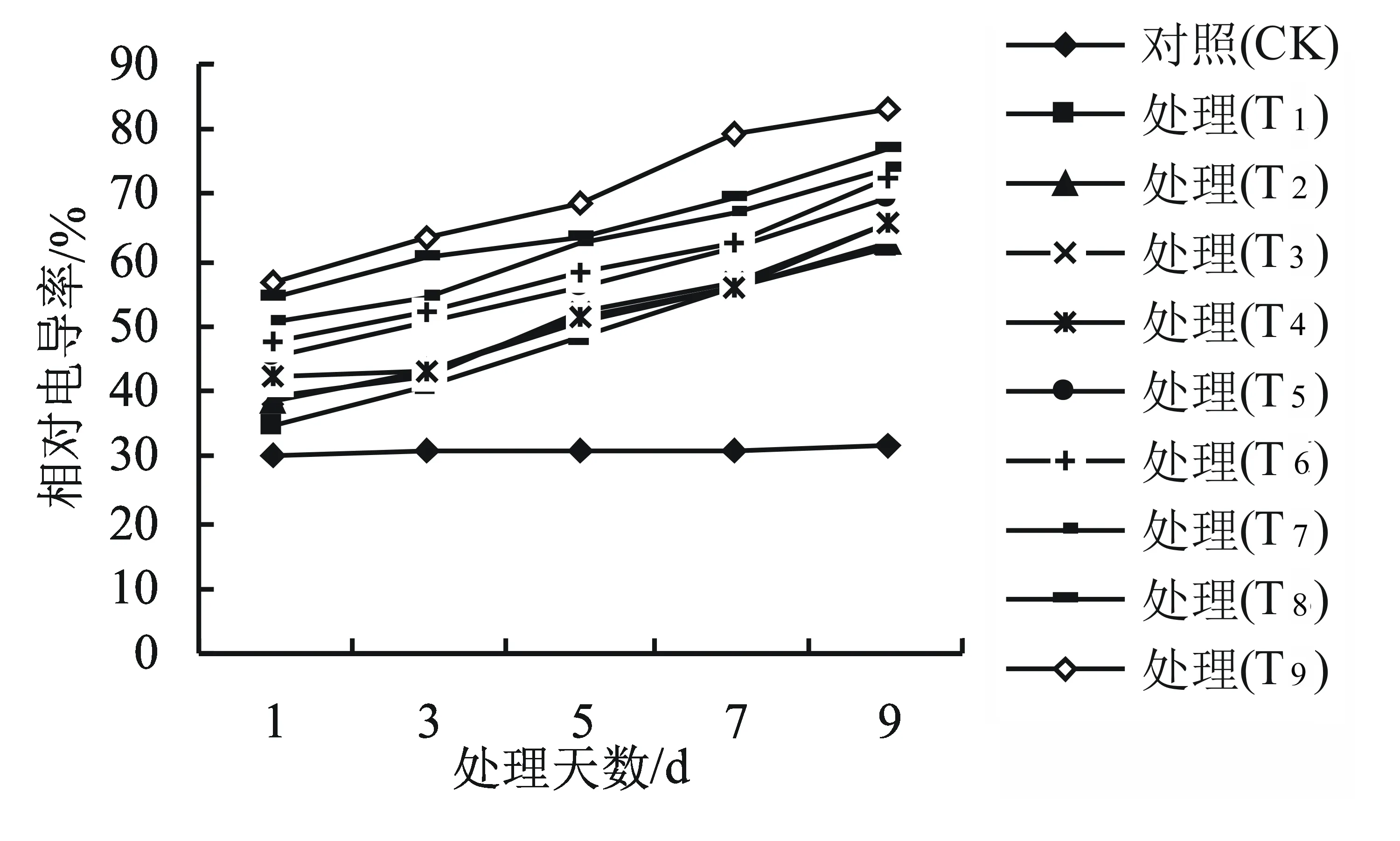
圖2 干旱高溫互作對高山杜鵑幼苗相對電導率的影響
2.3 干旱高溫互作對高山杜鵑幼苗POD、SOD和CAT活性的影響
由圖3可知,與對照組相比,SOD的活性呈先升后降的趨勢,SOD活性在第7天時達到最大以后逐漸下降,T1、T2處理的SOD活性變化不顯著(P>0.05);而T6處理的SOD活性差異最為顯著(P<0.05),與對照組相比增加了15.4%,說明干旱高溫互作顯著影響了杜鵑葉片SOD的活性。由圖4、圖5可知,干旱高溫互作下高山杜鵑的POD和CAT活性均隨著脅迫天數的增加呈上升趨勢,T1、T2、T3處理的POD活性變化不顯著(P>0.05),而T9處理的POD活性差異最為顯著(P<0.05),比對照組增長了71.9%。T1、T2處理的CAT活性變化不顯著(P>0.05), 而T9處理的CAT活性差異最為顯著(P<0.05),比對照組增長了22.9%,說明脅迫程度越大,杜鵑葉片的POD、CAT活性也逐漸增大以達到減少干旱高溫傷害的保護目的。

圖3 干旱高溫互作對高山杜鵑幼苗SOD活性的影響
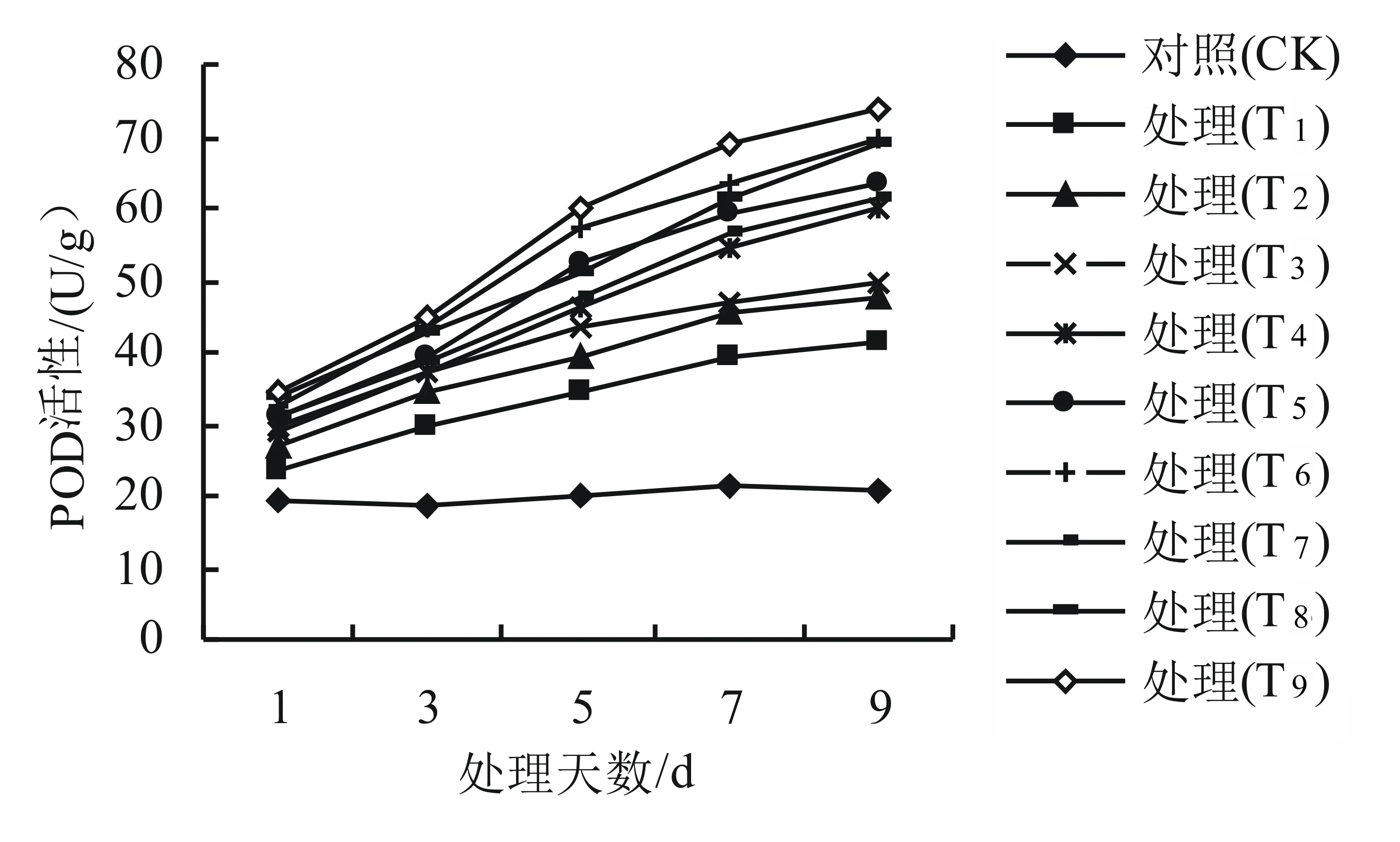
圖4 干旱高溫互作對高山杜鵑幼苗POD活性的影響
2.4 干旱高溫互作對高山杜鵑幼苗MDA含量的影響
由圖6可知,與對照組的MDA含量相比,干旱高溫互作下各處理組的MDA含量隨脅迫時間的延長而持續升高,但是各處理組的MDA含量有明顯差異。T1、T2處理的MDA含量變化不顯著(P>0.05);而T9處理的MDA含量差異最為顯著(P<0.05),與對照組相比增加了178.1%。丙二醛含量隨著脅迫時間的延長而升高,說明高溫干旱互作下細胞質膜發生了過氧化作用,引起質膜正常的生理功能發生紊亂。

圖5 干旱高溫互作對高山杜鵑幼苗CAT活性的影響

圖6 干旱高溫互作對高山杜鵑幼苗MDA含量的影響
2.5 干旱高溫互作對高山杜鵑幼苗可溶性蛋白含量的影響
可溶性蛋白質是植物體內的重要滲透調節物質。由圖7可知,對照組的可溶性蛋白含量相對穩定,而在干旱高溫互作下高山杜鵑葉片中可溶性蛋白含量隨著脅迫時間的延長均呈上升趨勢。T1、T2處理下可溶性蛋白含量與對照組相比無顯著性差異(P>0.05);處理T9與對照組相比存在顯著性差異(P<0.05),增加了28.8%。說明在抗逆境中可溶性蛋白不僅能夠維持細胞的膨壓,而且能夠起到抵御或減輕干旱、高溫傷害等作用。

圖7 干旱高溫互作對高山杜鵑幼苗可溶性蛋白含量的影響
3 討論
植物受到非生物脅迫時,體內常通過自身的防御網絡來調控相關的代謝途徑。脯氨酸不僅是細胞內最重要的滲透調節物質,而且是一種水溶性極強的氨基酸,具有較強的水合能力;此外,還可以增加蛋白質的可溶性和減少可溶性蛋白質的沉淀,保持膜結構的完整性[18]。脯氨酸能有效幫助植物細胞組織持水和防止脫水,同時具有解氨毒和保護膜完整性的作用。干旱脅迫時脯氨酸的積累最為明顯,其含量可以比正常條件下增加幾十到幾百倍[19-20]。本研究中,各處理組脯氨酸含量隨著脅迫時間的延長呈上升趨勢,在T9處理下高山杜鵑脯氨酸含量增長幅度最大。植物體內脯氨酸含量的多少在一定程度上與植物的抗逆性呈正相關,抗性強的品種往往積累的脯氨酸較多。因此脯氨酸含量可以作為衡量植物的抗逆性強弱的生理指標。
植物相對電導率是反映植物細胞膜透性的一項基本指標。在本試驗中,對照組葉片的相對膜透性沒有明顯的變化,而干旱高溫互作處理下的相對電導率變化顯著,隨著脅迫時間的延長均呈上升趨勢,但存在一定的差異,其中T9增長幅度最大。因此,植物在受到干旱高溫互作的情況下細胞膜容易被破壞,導致胞質的胞液外滲而使相對電導率增大。
在逆境脅迫下,植物體內活性氧的產生與清除平衡被打破,導致植物體在生命過程中活性氧不斷積累。SOD、POD和CAT是植物體內3種重要的保護酶。SOD是植物活性氧代謝的關鍵酶,而POD和CAT這2種酶反映了植物生理生化代謝及生長發育情況,也可作為植物抗性強弱的標志[21]。普遍認為,在逆境脅迫下,植物的 SOD、POD和CAT活性都會有一定提高[22-23]。SOD活性受超氧陰離子自由基(O2-)的誘導,歧化O2-為H2O2和O2,而CAT和POD則進一步將H2O2催化生成H2O,從而減少O2-和H2O2的積累[24]。
在本研究中,干旱高溫互作下高山杜鵑的POD、CAT活性均隨著脅迫時間延長呈上升趨勢,其中POD、CAT活性均在T9處理下增長幅度最大;而SOD的活性隨著脅迫時間延長呈現出先升后降的趨勢,其中在第7天時達到最大后逐漸下降,這與龐新華等[10]的研究結果一致。SOD的活性呈現這一趨勢,可認為,盡管SOD 可清除 O2-,減輕膜脂過氧化對細胞內其他部位的傷害,但這種保護作用是有限的;到干旱高溫脅迫后期,當脅迫壓力超過植物所能承受的極限時,干旱高溫會破壞酶的活性中心,通過改變酶的結構或抑制酶的表達,使得酶活性下降。王麗娟等[25]在對逆境脅迫下桃葉杜鵑幼苗的生理生化研究中卻發現SOD活性持續上升。這一現象可能與不同實驗研究中材料、方法或處理時間的不同或不同類型杜鵑對高溫脅迫的反應不同有關,具體原因還有待深究。
MDA是膜脂過氧化作用的產物之一,其含量高低被作為活性氧傷害的重要指標。在本試驗中,干旱高溫互作下高山杜鵑幼苗的MDA含量顯著增加,其中處理T1、T2的MDA含量增長幅度不明顯,T9處理的MDA含量增長幅度最大,高山杜鵑MDA含量隨脅迫時間的延長而增加的這一現象與對其它杜鵑花屬植物的研究結果相吻合[10],說明干旱高溫互作下脅迫程度的加深,致使抗氧化系統被破壞,植物體內的活性氧大量積累,導致了膜脂的過氧化,對細胞膜造成了嚴重的傷害。因此,MDA可被作為檢測膜損傷程度、膜脂過氧化程度和植物對逆境條件反應強弱的指標。
可溶性蛋白質是細胞內的重要滲透調節物質,對維護細胞膜結構的穩定具有重要作用。高含量的可溶性蛋白質可使細胞維持較低的滲透勢,抵抗水分脅迫帶來的傷害。本研究結果表明,隨脅迫時間的延長,可溶性蛋白質的含量呈上升趨勢,其中T1處理的可溶性蛋白質含量增長幅度不明顯,T9處理的可溶性蛋白質含量增長幅度最大。因此,可溶性蛋白不僅能夠維持細胞的膨壓,而且能夠起到抵御或減輕干旱、高溫傷害等作用。
綜合各項指標表明,干旱高溫脅迫處理程度越深,對秦嶺高山杜鵑的傷害越大,植物越容易死亡。因此,秦嶺高山杜鵑幼苗適宜在25 ℃左右的溫度下和沒有干旱脅迫的環境下生長,33 ℃和不同濃度的PEG干旱處理會導致植物生長受到抑制,但具有一定抗性;40 ℃和不同濃度的PEG干旱處理會導致植物生長受到嚴重影響。因此,將高山杜鵑引種栽培到夏季最高溫度不超過25 ℃左右的地區是可行的,但隨著近年來夏季溫度的不斷上升,通過什么方法讓杜鵑在炎熱的城市引種成功還需要進一步研究。

