噬菌體展示布魯氏菌蛋白文庫構建及差減篩選融合蛋白
布魯氏菌病(簡稱布病)是由布魯氏菌引起的一種人獸共患病,感染動物表現睪丸炎、不孕、不育、流產等癥狀,人類感染為波浪熱、關節炎、脾臟腫大,也可引起生殖系統障礙[1-2]。布病嚴重影響動物生產性能和產品品質,對畜牧業的生產和健康發展帶來重大損失。近年來在我國北方部分地區、特別是牧區出現上升趨勢,嚴重影響畜牧業發展和農牧民身體健康[3-4]。該病治療效果較差,以預防為主。故建立快速、準確診斷方法是控制、凈化布病的必要手段。
目前布病的檢測方法主要有病原學檢測、血清學檢測及分子生物學檢測。現以血清學方法最為成熟,常用的方法有平板凝集(RBT)、試管凝集(SAT)、補體結合實驗(CFT) 、ELISA等。其中RBT由于操作簡單,但敏感性、特異性均不高,而廣泛地被用作現場的大規模初篩性試驗;SAT雖然能用于定性檢測,但主要檢測血清中的IgM, 由于IgM在血清中存在時間較短、含量也不如IgG高等原因,導致該方法敏感性、特異性也不高;CFT也能用于定性檢測,但由于操作繁瑣、耗時長也不常被采用。ELISA由于其快速、操作簡單,在國際貿易中被世界動物衛生組織(OIE)規定為檢測布病的指定方法,被公認為是一種比較有前途的方法。但是血清學方法檢測的是菌體表面的脂多糖(lipopolysaccharide, LPS),布魯氏菌的LPS與傷寒沙門氏菌、副傷寒沙門氏菌、霍亂弧菌、小腸耶爾森菌O∶9等存在相似結構,故在診斷中存在假陽性[5]。因此,新型診斷抗原的研制是建立ELISA方法的關鍵。
布魯氏菌表面蛋白具有較強的免疫原性,而且在布魯氏菌各個種間具有高度的保守性,以表面蛋白作為診斷抗原不容易和其他細菌,如大腸桿菌、小腸耶爾森菌等發生交叉反應,減少假陽性[5-7]。很多表面蛋白,如omp25、 omp28、omp31和bp26都曾被用做診斷抗原研究,但究竟哪個/些表面蛋白的特異性強、敏感性高,目前仍在探索。
由于噬菌體展示技術可以構建大容量文庫并具有高通量篩選等特性,本研究利用噬菌體展示技術構建布魯氏菌蛋白文庫,通過差減篩選,選擇具有良好特異性、親和力及反應原性的表面蛋白,為確定診斷用抗原奠定基礎。
1 材料與方法
1.1材料 TG1大腸桿菌(廣州碧云天生物有限公司);羊型布魯氏菌16M株(標準熱滅活,本室保存);輔助噬菌體VCSM13(海軍總醫院周麗君教授惠贈);噬菌粒載體pYW01(梅西大學Jasna教授惠贈)。 VCSM13及pYW01經測序鑒定,序列全部正確。
Taq Master Mix、細菌基因組提取試劑盒、膠回收試劑盒、DNA Marker(康為世紀公司);T4 DNA ligase、末端快速補平試劑盒、SmaI內切酶、蝦堿性磷酸化酶(NEB公司);超聲波細胞粉碎儀(新芝SCIENTZ-IID型);電轉儀(BIO RAD公司)。噬菌粒載體pYW01引物由長春庫美生物科技有限公司合成,上游引物5′- AACATATGAAATACCTGCTGCCGAC-3′,下游引物5′- TCTTCCTCAGAGATCAGCTTCTGCT-3′。
1.2 噬菌體展示布魯氏菌16M株基因組文庫構建
1.2.1布魯氏菌16M株基因組提取及基因組片段化 以布魯氏菌16M株菌液(經熱滅活)為模板,利用細菌基因組提取試劑盒提取16M株基因組,具體操作按試劑盒進行。
將超聲條件設定為輸出功率40%,每次超聲3 s,間隔6 s,超聲次數為10下,超聲DNA總體積約500 μL,將基因組DNA隨機打斷。利用膠回收試劑盒對線性片段回收,以除去小于200 bp大于3 000 bp的片段。
1.2.2破碎基因組片段末端補平 將細菌基因組超聲片段進行隨機片段末端平齊化,體系如下:DNA隨機片段38 μL、T4 DNA polymerase 1 μL、10×T4 DNA polymerase reaction buffer 5 μL、dNTP Mixture 2 μL、H2O 4 μL,11 ℃反應20 min,70 ℃滅活10 min。補平后利用膠回收試劑盒對其進行純化,準備連接。
1.2.3酶切質粒pYW01及去磷酸化SmaⅠ單酶切噬菌粒載體pYW01,體系如下:10× buffer 5 μL、SmaI 1 μL、pYW01 30 μL,Water 14 μL。25 ℃,反應5 h。然后利用蝦堿性磷酸酶(rSAP)直接進行去磷酸化,以防止載體自連,即直接在酶切反應結束后的體系中加入rSAP 1.5 μL,37 ℃溫育60 min后65 ℃熱滅活20 min。去磷酸化后膠回收試劑盒進行純化,準備連接。
1.2.4感受態細胞制備 取1 mL TG1母液接種到200 mL新鮮的LB培養液中,37 ℃,170 r/min 振蕩培養2.5 h,使OD450達到0.7左右。冰浴30 min,4 000 r/min,4 ℃離心20 min,棄上清收集菌體。用含有10%甘油的無菌水洗滌菌體2次。最后用400 μL 10%甘油無菌水重懸細胞沉淀,分裝,每管100 μL,-80 ℃保存備用。
1.2.5連接 利用T4 DNA ligase將末端補平的布魯氏菌16M株基因組超聲片段和酶切質粒pYW01(去磷酸化)以4∶1比例(摩爾比)進行連接,體系如下:DNA隨機片段12 μL、pYW01 1 μL、T4 DNA ligase 1 μL、10×ligation buffer 2 μL、H2O 4 μL。22 ℃連接1 h 后70 ℃熱滅活5 min。
1.2.6電轉化 將連接產物20 μL電轉化至100 μL 感受態細胞中。(冰浴條件下,將連接產物和感受態細胞用槍頭緩慢混合均勻)電轉化條件為:1 mm電擊槽、電壓1 800 V、電阻200 Ω、電容25C,同時將2 μL 噬菌粒載體pYW01轉入100 μL TG1中作為對照,以檢測感受態轉化效率。電轉完成后立即加入900 μL LB液體培養基,震蕩活化45 min(37 ℃,170 r/min),此即為噬菌體展示布魯氏菌16M株基因文庫。
1.3基因文庫容量計算及隨機性檢測 取上述10 μL連接菌液用LB液體培養基稀釋至100 μL,均勻涂布于LB固體培養基(20 μg/mL氯霉素)37 ℃過夜培養。觀察各平板菌落形成數量,以公式計算庫容量(cfu/mL)=菌落數×稀釋倍數×10。
隨機挑取菌落,LB液體培養基(20 μg/mL氯霉素)搖動約6 h,取菌液行PCR,鑒定文庫插入效率。 PCR體系如下:上、下游引物各0.5 μL,Taq Master Mix 5 μL,菌液1 μL,用水補足體積至10 μL。 Touch-down PCR運行程序:94 ℃ 1 min, 94 ℃ 30 s, 65 ℃ 30 s,72 ℃ 30 s, 72 ℃ 10 min。 其中退火溫度從65 ℃依次降落到50 ℃,溫度每降落一度運行兩個循環,最后50 ℃運行10個循環,共計40個循環,1%瓊脂糖電泳檢測結果。
1.4 噬菌體展示布魯氏菌16M株蛋白文庫構建
1.4.1輔助噬菌體滴度檢測 10 μL輔助噬菌體VCSM13 用LB液體培養基10倍稀釋,稀釋成10-1~10-1010個稀釋度。分別取100 μL(10-6、10-8、10-10)稀釋輔助噬菌體和新鮮培養的宿主菌(TG1)100 μL混合均勻后,加入5 mL軟瓊脂混勻后快速倒入已預熱的LB固體培養基中(20 μg/mL氯霉素),37 ℃倒置培養12~16 h。具體操作按照文獻進行[8],噬菌體滴度(pfu/ mL)=斑數×稀釋倍數×10。
1.4.3純化噬菌體蛋白文庫 上述培養物,室溫4 000 r/min 離心10 min;棄上清,用100 mL LB培養基重懸沉淀,加入卡那霉素使其終濃度達到50 μg/mL,37 ℃培養過夜;次日將菌液 4 000 r/min 離心 20 min,將上清轉移至無菌離心管內,分別加入1/4 體積的PEG8000- NaCl溶液,劇烈搖晃后,4 ℃過夜放置,沉淀噬菌體;4 ℃,10 000 r/min 離心 30 min;棄上清,用 3 mL PBS 重懸沉淀,即為輔助噬菌體包裝后的展示蛋白文庫,0.22 μm濾膜過濾除菌即得到純凈的噬菌體懸液。
1.4.4測序鑒定蛋白文庫 利用質粒小提試劑盒提取此懸液質粒DNA,電轉化至TG1感受態細胞,條件同1.6.2。將轉化菌液涂布于含氯霉素的LB平板上,37 ℃過夜培養,隨機挑取20個單克隆送公司測序。將測序序列與GenBank中16M株序列比對,鑒定蛋白文庫。
1.5 差減淘選
1.5.1差減篩選 將噬菌體展示文庫作為流動相,將M5免疫羊血清作為固定相。將免疫血清包被在孔內,加入噬菌體展示蛋白文庫,二者進行吸附。以未被吸附的噬菌體展示文庫作為流動相,陽性血清作為固定相。提前將陽性血清包被在孔內,加入免疫血清未吸附的噬菌體展示蛋白文庫,進行淘選。對差減淘選的噬菌體文庫進行2輪富集。
1.5.2擴增陽性克隆,測序 ① 對淘選到的陽性克隆進行擴增:挑取每個單克隆轉接至新鮮2×YT液體培養基中,37 ℃振蕩培養過夜。再轉接TG1菌液中,培養至OD=0.4左右后,加入輔助噬菌體VCSM13d3(MOI=1∶100)超感染,以擴增單個陽性克隆噬菌體文庫。② 用質粒小量抽提試劑盒提取重組質粒,操作方法按說明書進行。③ 對陽性重組質粒進行Touch-down PCR鑒定,分析插入片段大小;對鑒定陽性的質粒送公司測序。
1.6噬菌體陽性克隆篩選 競爭ELISA、Western-blot評價陽性克隆的親和力、特異性及反應原性,篩選具有良好抗原性的噬菌體陽性克隆。① 提取LPS,按試劑盒操作進行;② 競爭ELISA評價陽性克隆的親和力:以篩選到的噬菌體融合蛋白包被,以提取16M株LPS作為競爭相,檢測陽性克隆的親和力;并利用prism軟件分析陽性克隆親和力;③ Western-blot評價陽性克隆的特異性及反應原性,DS-PAGE檢測:取純化后的噬菌體融合蛋白進行SDS-PAGE電泳,同時以輔助噬菌體VCSM13作為陰性對照。轉膜:剪下和凝膠大小吻合的6 張3M濾紙和1張PVDF膜(戴手套操作),PVDF膜先在甲醇溶液中浸泡15 s,轉入去離子水中漂洗后,連同3M濾紙轉入半干轉印緩沖液中,浸泡30 min。將膠用去離子水沖洗后,也放在半干緩沖液中平衡。然后將膠、膜、濾紙制成三明治,注意每一層都不能有氣泡,否則影響轉印效果。疊好后,根據膜的大小,來確定轉印時電流的大小(具體條件的設定參考儀器說明書)。本試驗采用200 mA電流下轉印60 min。
免疫檢測:轉印完成后將膜用麗春紅染色,看膠上的目的條帶是否轉到膜上;然后用蒸餾水漂洗膜,用10%馬血清封閉1 h后,用PBS洗滌3次,每次5 min;然后用新鮮配置的一抗(陽性血清)室溫封閉膜70 min,再用PBST漂洗3次,每次5 min;用新鮮配置的二抗(兔抗羊血清)封閉膜35 min,洗膜3次,操作同上,然后再用PBS洗滌1次,3 min;用DAB染色3~5 min至膜上的條帶清晰后,用蒸餾水終止反應。
應采取多種營銷方式共同發展,將傳統與新的自媒體營銷手段結合,相互促進。武當山旅游景區在建立自媒體平臺的基礎上更加應該注重的是推廣,讓更多人知道景區官方的微博以及微信公眾號。還可以通過發傳單等傳統營銷方式推廣一下自媒體營銷方式,二者相互作用,合作發展。
2 結 果
2.1羊型布魯氏菌16M株基因組提取及超聲破碎結果 羊型布魯氏菌16M株(標準熱滅活)基因組提取結果見圖1。從圖中可見DNA提取濃度較高;經OD260/280分析,基因組純度也達到要求。取DNA約500 μL進行超聲裂解,結果見圖1。瓊脂糖凝膠電泳顯示,基因組裂解后隨機片段大小集中分布在0.3~2 kb之間。
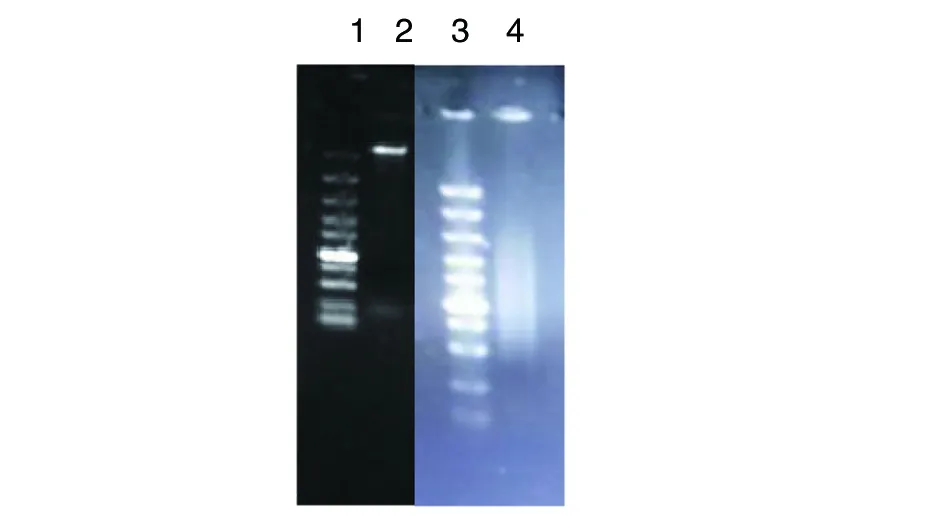
1:Marker從上到下大小依次為100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp,2 000 bp,3 000 bp,5 000 bp,10 000 bp;2:馬爾他布魯氏菌16M株DNA提取結果;3: Marker;4:基因組DNA超聲裂解結果圖1 布魯氏菌基因組及超聲破碎電泳檢測結果Fig.1 Result of DNA extraction and cleavage
2.2酶切噬菌粒載體pYW01結果 提取載體質粒pYW01,經1%瓊脂糖凝膠電泳顯示條帶大小與預期質粒大小相符(圖2)。質粒經測序(長春庫美生物有限公司)表明,提取結果正確。經SmaI單酶切后,在目的位置發現單一條帶(圖2)。 對其進行去磷酸化后,準備連接。
2.3構建羊型布魯氏菌16M株全基因組文庫 取100 μL轉化后菌液涂板,經37 ℃過夜培養后,有菌落在含氯霉素的LB平板上長出,證明重組噬菌粒載體pYW01成功電轉至TG1感受態細胞。菌落大小、形態一致。經計算庫容量約為108pfu/ mL,達到建庫要求。
隨機挑取17個單菌落,利用Touch-down RCR程序鑒定插入文庫的片段,結果見圖3。結果表明,插入片段具有較好隨機性,且插入片段大小分布在0.2~3.0 kb間。
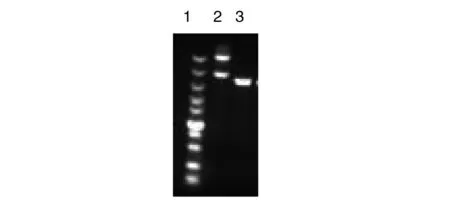
1:Marker從上到下大小依次為100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp,2 000 bp,3 000 bp,5 000 bp,10 000 bp;2:提取噬菌粒pYW01;3:SmaI單酶切噬菌粒pYW01圖2 提取質粒pYW01及SmaI單酶切結果Fig.2 Result of plasmid extraction and SmaI enzyme digestion
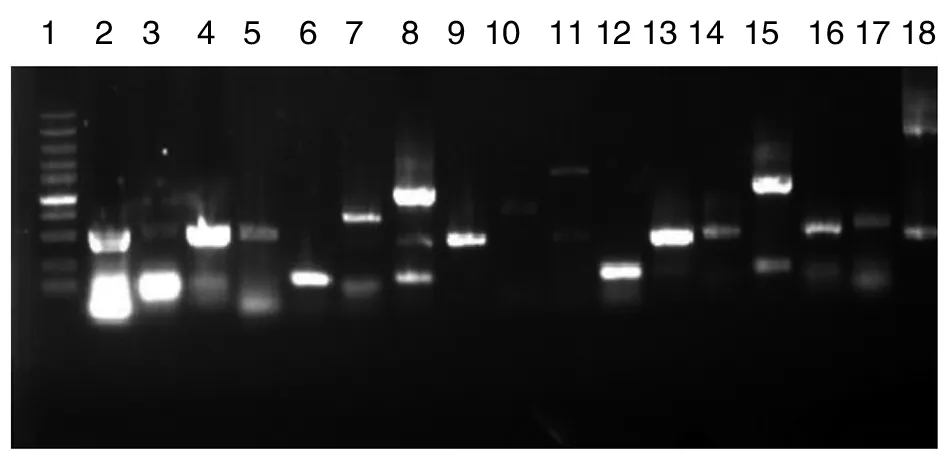
1:Marker從上到下大小依次為100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp,2 000 bp,3 000 bp,5 000 bp,10 000 bp;2~18:PCR鑒定結果圖3 1%瓊脂糖電泳檢測全基因文庫中插入片段結果Fig.3 Insert fragments of the library
2.4構建羊型布魯氏菌16M株蛋白文庫 基因文庫經輔助噬菌體VCSM13感染后,即可包裝成蛋白文庫。經PEG純化后,對原始蛋白文庫電轉化增殖,37 ℃過夜培養,即為增殖的蛋白文庫。隨機挑取LB平板上20個單克隆送公司測序。將測序結果與16M株序列比對,基因同源性達到98%以上。結果表明,成功構建羊型布魯氏菌16M株表面蛋白文庫。
2.5差減淘選,擴增陽性克隆,測序 利用免疫血清及感染血清對噬菌體展示蛋白文庫進行差減淘選、兩輪富集后,得到37個陽性克隆。每輪富集結果見表1。
表1 每輪淘選后陽性克隆數Tab.1 Number of positive clones each round of panning

第一輪(pfu/mL)第二輪(pfu/mL)富集率噬菌體投入量2.0×1072.0×107-洗脫物滴度1.0×1043.0×105300×
對陽性克隆進行擴增,提取質粒進行Touch-down PCR鑒定,分析插入片段大小;對鑒定陽性的質粒送公司測序。經Blast,篩選出6個噬菌體融合蛋白,結果見表2。
表2 陽性噬菌體融合蛋白Tab.2 Positive phage fusion protein

ACCESSIONlocus_tagproductAE008917BMEI1242hypothetical membrane spanning proteinCP007763DK63_1291hypothetical proteinCP007763DK63_1023outer membrane autotransporter barrel domain proteinCP007763DK63_628glutamate racemaseCP007763DK63_1659outer membrane autotransporter barrel domain proteinAE008918BMEII0036outer membrane protein oprf(an outer membrane porin)
2.6競爭ELISA評價陽性克隆的親和力 以篩選到的噬菌體融合蛋白包被,以提取16M株LPS作為競爭相,檢測陽性克隆的親和力,以輔助噬菌體VCSM13d3作為對照,結果表明,以融合蛋白BMEI1242、DK63-1291、BMEII0036親和力最強見圖4。且經統計學分析,3個融合蛋白之間差異沒有統計學意義(F=0.038 22,P>0.05)。
2.7Western-blot評價陽性克隆的特異性及反應原性 以布魯氏菌病陽性血清為一抗,進行Western-blot分析各個陽性克隆的特異性及反應原性,以VCSM13d3為陰性對照,結果見圖5。結果表明,這6個噬菌體融合蛋白均具有較好的反應原性及特異性,而與輔助噬菌體不發生發應。
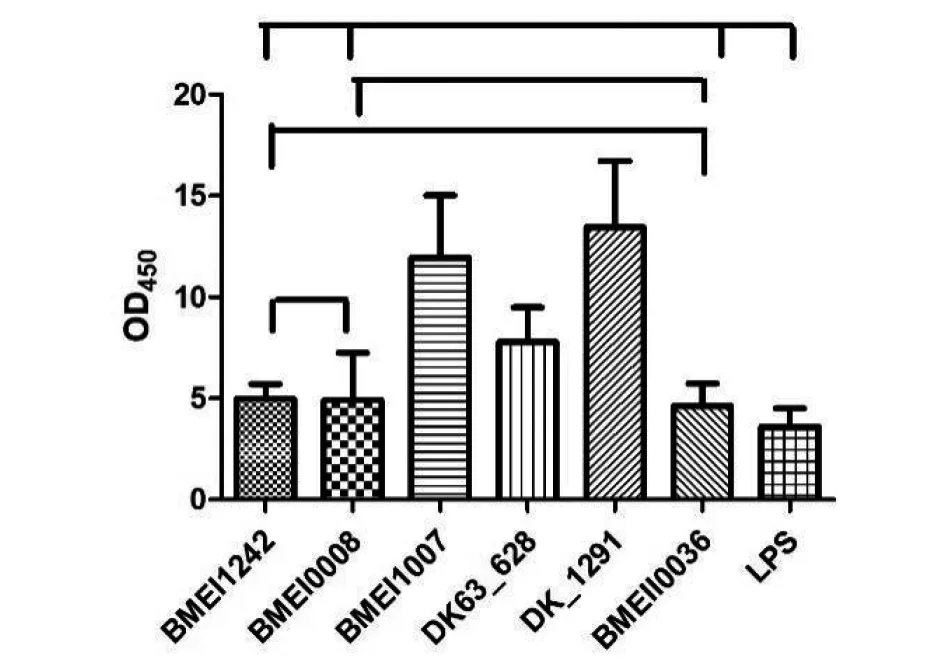
圖4 噬菌體融合蛋白c-ELISA結果Fig.4 Result of c-ELISA of phage-fusion proteins

1:低分子量蛋白Marker; 2:BMEII0036; 3:DK63_1659; 4:DK63_628; 5:DK_631023; 6:DK63_129; 7:VCSM13d3; 8:BMEI124圖5 感染/陽性血清的 Western-Blot 結果Fig.5 Result of Western-Blot
3 討 論
布魯氏菌病新型診斷抗原的研究主要集中在兩個方面。LPS作為傳統的診斷抗原,一直不斷被試圖改造[9-12]。LPS含有M和A兩個表位,其中A表位是引起交叉反應的主要原因,而這兩個表位還不能被分離[13]。因此新合成的LPS只含有M 表位或者含有被改造的A表位。但化學方法合成的LPS在生物學活性上,可能會大大降低。本研究通過利用噬菌粒載體pYW01及輔助噬菌體VCSM13構建了噬菌體展示布魯氏菌表面蛋白文庫,使目的蛋白能與噬菌體的pⅢ蛋白融合,共同展示在噬菌體表面。后續利用靶分子即可對文庫進行高通量篩選,并且該技術還可以將基因型與表型聯系起來。因此,噬菌體展示技術在腫瘤標記物的識別、新型抗毒血清治療、疫苗候選株篩選、藥物開發、蛋白質組學研究等方面得到廣泛應用[14-17]。本研究所用噬菌體展示系統,是Jasna教授等人于2013年構建,該系統能降低外源蛋白對于宿主菌(大腸桿菌)的毒性,提高展示效率等特性[18]。此系統用于構建布魯氏菌表面蛋白文庫還是首次,為布魯氏菌新型診斷抗原的篩選奠定基礎。
致謝本研究得到梅西大學Jasna Rakonjac教授,海軍總醫院周麗君教授的無私幫助。
利益沖突:無
引用本文格式:王闊鵬,于凌嬌,劉倩宏,等.噬菌體展示布魯氏菌蛋白文庫構建及差減篩選融合蛋白[J]. 中國人獸共患病學報,2019,35(5):376-381.DOI:10.3969/j.issn.1002-2694.2019.00.056

