腹腔鏡腎盂成形術與傳統腎盂成形術治療小兒腎積水療效對比研究
葛文安,王盛興,郭 濤,李國棟,陳 偉,張高峰
西安市兒童醫院泌尿外科 (西安710003)
小兒腎積水是由輸尿管阻塞,引起尿液潴留在腎盂、腎盞中導致的臨床綜合征[1]。因患兒腎內尿液積聚,壓力升高,使腎盂、腎盞擴大、腎實質萎縮[2-3]。積水量可達50 ml至數百毫升,梗阻嚴重時,炎性滲出物無法經尿排出,使患兒出現間歇性腰腹痛、血尿、尿路感染等癥[4]。目前臨床對小兒腎積水多主張行手術治療,常用的手術方式包括腹腔鏡腎盂成形術(Conventional laparoscopic pyeloplasty, CTL-P)、開腹腎盂成形術等[5-6]。為探討不同手術治療方案對腎積水患兒血流動力學、腎功能的影響,本研究選擇本科室2015年1月至2016年11月收治的60例腎積水患兒,分別給予腹腔鏡腎盂成形術及傳統腎盂成形術治療,現將結果報道如下。
資料和方法
1 一般資料 選擇本科室2015年1月至2016年11月收治的60例腎積水患兒為研究對象,以隨機抽樣軟件將60例患兒分為對照組、觀察組,每組30例。對照組男18例,女12例;年齡7個月至13歲,平均年齡(4.58±0.52)歲。左側22例,右側6例,雙側2例。觀察組男17例,女13例;年齡7個月至13歲,平均年齡(4.55±0.53)歲。左側21例,右側7例,雙側2例。兩組患者基礎資料比較,差異無統計學疑義(P>0.05)。納入標準:①經B超、靜脈腎盂造影、彩色多普勒超聲檢查確診為腎積水;②所有手術均由我科臨床經驗豐富的同一醫師完成;③患者對治療方案知情同意,并簽署知情同意書。排除標準:①同期進行結石取出術、膽囊切除術者;②存在心、腦、肺等臟器重大疾病者;③一般情況較差,無法耐受手術治療者。
2 治療方法 兩組均常規進行術前準備,均采用氣管插管全身麻醉。麻醉后留置Folly氣囊導尿管進入膀胱,并暫時夾閉。術前30 min至術后第5天,預防性應用抗生素。取患兒患側腰部墊高位,傾斜45°。①觀察組采用CTL-P治療:做臍環健側7 mm切口,置入5mm Trocar,建立氣腹。腹腔鏡引導下,分別于患側上腹部及中下腹各做一小切口,置入5 mm Trocar,經結腸旁或腸系膜路徑顯露腎臟,依次暴露腎下極、腎盂、輸尿管上段,探查狹窄部位及狹窄原因。游離輸尿管上端、積水擴張的腎盂,弧形裁剪多余的腎盂,使腎盂口呈喇叭狀,狹窄段遠端0.5 cm離斷輸尿管,去除狹窄段輸尿管。于輸尿管壁近端外側,縱行剪開2 cm。可吸收線縫合輸尿管近端、腎盂,置雙J管內引流。常規吻合后,降低氣腹壓力,確認術野無活動性出血,經下腹部套管針孔置腹膜后引流管,關閉切口。縫合腹膜及切口,最后以醫用膠粘合皮緣。②對照組采用傳統開腹腎盂成形術治療:全身麻醉,取健側仰臥位,患側季肋部墊高,手術臺向健側傾斜15°。腹前部、腹膜外入路,做上腹橫切口,內側起自腹直肌外緣,外側至腋前線,依次切開皮膚、腹外斜肌腱膜,具體手術步驟參考《實用小兒泌尿外科學》[7]中的相關內容,術后處理同腹腔鏡組。
3 觀察指標 ①手術指標比較:比較兩組手術時間、術中出血量、進食時間、住院時間。②術后并發癥:觀察術后有無尿路感染、吻合口尿漏、吻合口梗阻、腸梗阻并發癥發生。③腎血流動力學指標:分別于手術前、手術完成后,以彩色多普勒超聲斷層診斷儀檢測血流動力學指標變化情況。檢查前患兒飲足水,排空膀胱,取側臥位,必要時給予10%水合氯醛灌腸,以使患兒安靜。以彩色多普勒超聲診斷儀自帶的血流分析軟件,顯示血流收縮期峰值流速(PS)、舒張期峰值速度(ED)、平均速度(TAMx)、最低速度(TAMn)、阻力指數(RI)等指標。④血β2-MG、α1-MG、Scr水平比較:分別于治療前及治療完成后,取患兒空腹靜脈血3 ml,離心分離血清,以放射免疫法檢測血清β2-微球蛋白(β2-MG)、α1-微球蛋白(α1-MG)水平。以肌氨酸氧化酶法檢測血清肌酐(Scr)含量。

結 果
1 兩組治療過程中手術相關指標比較 見表1。兩組手術時間、術中出血量、進食時間、住院時間比較,差異均無統計學意義(P>0.05)。
2 術后并發癥發生情況比較 見表2。兩組術后尿路感染、吻合口尿漏、吻合口梗阻、腸梗阻等并發癥發生率差異無統計學意義(P>0.05)。
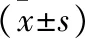
表1 兩組治療過程中手術相關指標比較

表2 術后并發癥發生情況比較[例(%)]
3 兩組腎血流動力學指標比較 見表3。兩組治療前PS、ED、TAMx、TAMn、RI差異無統計學意義(P>0.05)。治療后,兩組PS、ED、TAMx、TAMn均顯著高于同組治療前(P<0.05)。治療后,觀察組PS、ED、TAMx、TAMn顯著高于對照組(P<0.05)。兩組治療后RI差異無統計學意義(P>0.05)。
4 兩組治療前后血β2-MG、α1-MG、Scr水平比較 見表4。兩組治療前血清β2-MG、α1-MG、Scr含量差異無統計學意義(P>0.05)。治療后,兩組血清β2-MG、α1-MG水平均顯著低于同組治療前(P<0.05)。治療后,觀察組血清β2-MG、α1-MG水平顯著低于對照組(P<0.05)。兩組治療后Scr水平差異無統計學意義(P>0.05)。

表3 兩組腎血流動力學指標比較
注:與本組治療前比較,*P<0.05;與對照組治療后比較,△P<0.05

表4 治療前后血血β2-MG、α1-MG、Scr水平比較
注:與本組治療前比較,*P<0.05;與對照組治療后比較,△P<0.05
討 論
引起小兒腎積水最常見的原因為腎盂輸尿管連接部梗阻,位居泌尿系梗阻的首位。腎盂輸尿管連接部梗阻可使該部位的液體流動受阻[8],在長期的慢性炎癥的影響下,梗阻部位持續出現纖維化、膠原沉積,使肌細胞興奮傳導障礙[9],造成蠕動障礙。此外,長期梗阻還可影響腎盂輸尿管連接部尿流,增加腎盂內壓力,使腎盂腎盞出現明顯擴張,最終形成腎積水[10]。離斷式腎盂輸尿管成形術為治療腎盂輸尿管連接部梗阻的標準術式[11]。長期的臨床應用發現[12-13],該術式對患者創傷大,患者術后恢復速度慢,術后并發癥發生率也相對較高。近年來,隨著腹腔技術的不斷發展,因其對患者創傷小,患者術后恢復快,而廣泛應用于小兒腎積水的臨床治療中。
本研究對比分析了傳統腎盂成形術與腹腔鏡腎盂成形術在小兒腎積水中的臨床應用效果,結果顯示,兩組在手術時間、術中出血量、進食時間、住院時間等手術指標的比較中,在術后尿路感染等并發癥發生率的比較中,差異均無統計學意義。這與Kandur等[14]的研究結論類似。說明兩種治療方案的手術指標及術后安全性指標無顯著性差異。這可能與施術者手術熟練度較高,醫療設備改進有關,說明腹腔鏡技術為治療小兒腎積水的安全、有效的方法。
既往臨床常用靜脈腎盂造影(IVP)造影顯示腎積水情況及腎功能損傷[15],但嚴重積水時IVP無法顯影。近年來的報道顯示[16],多普勒測量的腎血流動力學改變與腎積水具有相關性。彩色多普勒超聲RI值與24 h腎穿刺引流量間存在明顯的相關性[17],可間接反映腎功能狀態。尤其是對于腎積水RI大于0.81的患者,可初步判斷該側腎臟功能預后情況。我們對60例腎積水患兒行彩色超聲多普勒檢查,結果發現,觀察組患兒治療后PS、ED、TAMx、TAMn顯著高于對照組,說明觀察組治療方案可使腎實質的血液循環盡快得到恢復,血流動力學指標顯著好轉。
β2-MG是人白細胞抗原分子的β輕鏈,由淋巴細胞、血小板、多形核白細胞等有核細胞分泌,廣泛存在于血漿、尿液、腦脊液、初乳中等各種體液中[18]。生理情況下,β2-MG合成、釋放維持恒定,在腎小球可自由濾過,絕大部分在近端腎小管吸收。血清β2-MG升高可反映腎小球濾過功能受損或濾過負荷增加[19]。α1-MG是由肝臟、淋巴細胞合成的低分子量糖蛋白,廣泛存在于體液、淋巴細胞膜表面[20]。血液中α1-MG有兩種形式:游離型、結合型。游離型可被腎小球濾過,幾乎完全被腎小球吸收、代謝。IgA結合型不易被腎小球濾過。腎間質小管出現損傷時,包括尿α1-MG、β2-MG等多種小分子量的蛋白,血液中含量顯著升高,且升高程度與腎積水程度呈正相關。本研究中,腎積水患兒血清α1-MG、β2-MG均顯著高于正常參考值,經手術治療后,兩組患兒血清α1-MG、β2-MG均有程度不同的下降,觀察組下降程度更顯著。說明觀察組治療方案對腎功能的改善效果更佳。
綜上所述,采用腹腔鏡腎盂成形術治療小兒腎積水,可顯著改善血流動力學指標及腎功能,適于在臨床推廣應用。

