右美托咪啶復合帕瑞昔布對膽總管結扎大鼠術后血管新生相關因子表達的影響*
楊明友,張 超,張 銘,魯開智
陸軍軍醫大學第一附屬醫院麻醉科(重慶 400038)
肝肺綜合征(Hepatopulmonary syndrome, HPS)病死率高、防治困難,近年報道發現病理性肺血管新生在HPS的發生發展中起到重要作用[1]。同時動物實驗也證實VEGF、SDF-1以及CX3CL1等血管新生相關因子在HPS大鼠外周血和肺組織中表達增高,這些因子一方面可通過直接作用于微血管內皮細胞促進其增殖,另一方面可以通過募集干細胞及單核細胞間接的促進HPS大鼠肺病理性血管新生[2-4]。右美托咪定是一種選擇性α2腎上腺素能受體激動劑,具有鎮靜、抗焦慮、抗交感和鎮痛的藥理作用,可減輕手術應激反應并且可抑制促炎細胞因子的釋放,具有一定的器官保護作用[5]。我們的研究也發現術中持續給予右美托咪定能夠顯著降低肝門阻斷患者圍手術期血漿SDF-1的表達水平[6]。由于環氧化酶-2(COX-2)在炎癥反應中具有重要作用,并且研究發現COX-2的激活明顯促進了膽總管結扎(CBDL)大鼠巨噬細胞聚集以及炎癥性血管新生[4]。為此,本研究擬通過建立HPS動物模型,術后應用右美托咪啶復合COX-2抑制劑帕瑞昔布并對比單純應用右美托咪啶的效果,檢測不同時間點血漿和肺組織中VEGF、SDF-1以及CX3CL1等血管新生相關因子的表達變化以及術后3周動脈血氧合的改善情況,為進一步研究肝肺綜合征患者的臨床治療方案提供基礎。
材料和方法
1 實驗動物 SPF級健康雄性SD大鼠,體重(200~220)g,購自第三軍醫大學野戰外科研究所動物室,飼養在有燈光控制分12 h白晝變換的房間,自由飲水和進食標準食物。實驗前至少1周在該房間適應環境。
2 實驗分組及梗阻性黃疸模型的建立 將實驗動物分為四組,每組24只:Sham手術組(S組)、CBDL手術組(C組)、CBDL+右美托咪啶組(D組)、CBDL+右美托咪啶復合帕瑞昔布組(DP組),四組均以術后7、14 d 和21 d三個時相點分為三個亞組,每組樣本數為8只。在實驗之前,大鼠禁食12 h,僅給自由飲水。麻醉方法:腹腔注射5% 水合氯醛麻醉(0.08 ml/kg)。CBDL大鼠手術方法:沿上腹正中線切開皮膚,剪開皮下組織、腹膜進腹;沿肝十二指腸韌帶尋找膽總管,于胰腺上方近十二指腸處游離膽總管,雙重結扎,并于兩結扎線之間切斷;連續縫合腹膜、皮下組織、皮膚、關腹;待復溫至動物蘇醒后,移入動物房,術后動物自由飲食。具體給藥方式如下(術后第1天開始):D組每日尾靜脈注射10 μg/kg右美托咪啶;DP組每日靜脈注射10 μg/kg右美托咪啶+10 mg/kg帕瑞昔布;C組和S組每日靜脈注射等量生理鹽水。S組手術方法:僅行一個簡單的剖腹手術,分離但總管但并不結扎,然后在7、14、21 d處死動物取血漿、肺,保存于-80℃待測。
3 組織勻漿 取組織塊(0.2~1 g),在冰冷的生理鹽水中漂洗,除去血液,濾紙拭干,稱重,放入5 ml的小燒杯內,然后用移液管量取0.86%冷生理鹽水,勻漿介質或生理鹽水的體積總量是組織塊重量的9倍,用移液管或移液器取總量的2/3的勻漿介質或生理鹽水于燒杯中,眼科小剪盡快剪碎組織塊。將剪碎的組織倒入玻璃勻漿管中,再將剩余的1/3勻漿介質或生理鹽水沖洗殘留在燒杯中的碎組織塊,一起倒入勻漿管中進行勻漿,左手持勻漿管將下端插入盛有冰水混合物的器皿中,右手將搗桿垂直插入套管中,上下轉動研磨數10次(6~8 min),充分研碎,使組織勻漿化。勻漿的組織以3000 r/min離心10 min,取上清液待測。
4 VEGF、SDF-1、CX3CL1檢測 獲取各組大鼠血漿以及按上述方法得到的勻漿肺組織上清液后;采用ELISA法按照試劑盒說明書檢測各組不同時間點血漿以及肺組織中VEGF、SDF-1和CX3CL1的表達水平。
5 動脈血氣分析 從大鼠腹主動脈抽取動脈血并使用ABL 700血氣分析儀進行血氣分析。
6 肺組織HE染色 取大鼠左肺下葉,用PBS將殘留血液漂洗干凈,經4%多聚甲醛固定48 h、制成石蠟切片并進行HE染色后,在光鏡下觀察肺組織的病理學變化。
7 統計學方法 采用SPSS 13.0統計學軟件包進行分析,計量資料以均數±標準差表示,組間比較采用成組t檢驗,P<0.05為差異有統計學意義。
結 果
1 四組各時間點血漿和肺組織VEGF、SDF-1和CX3CL1表達變化 與S組相比,C組血漿和肺組織SDF-1以及CX3CL1在各個時間點的表達均明顯升高,而VEGF僅在術后21 d高于S組。C組和D組相比,血漿和肺組織中各時間點VEGF和CX3CL1的表達水平均無統計學差異(P>0.05),其中SDF-1的表達僅在術后7 d有差異。而DP組與C組相比,術后各時間點血漿及肺組織VEGF、SDF-1和CX3CL1表達均明顯降低(P<0.05)。見表1~3。
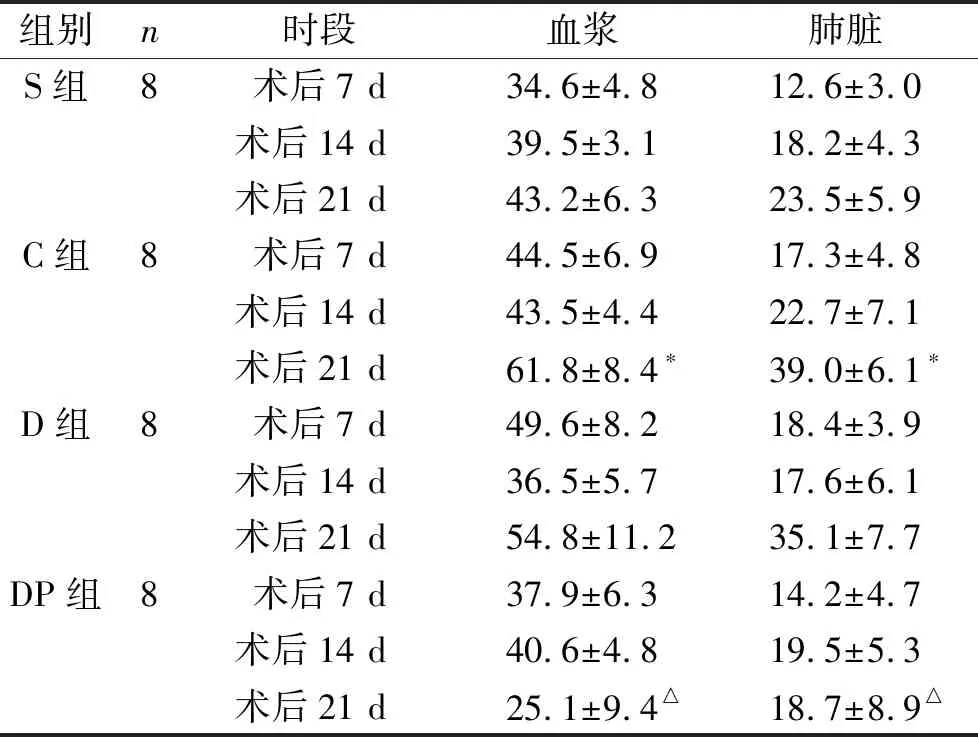
表1 四組各時間點血漿和肺組織VEGF表達水平 (pg/ml)
注:與S組同時間點比較,*P<0.05;與C組同時間點比較,△P<0.05
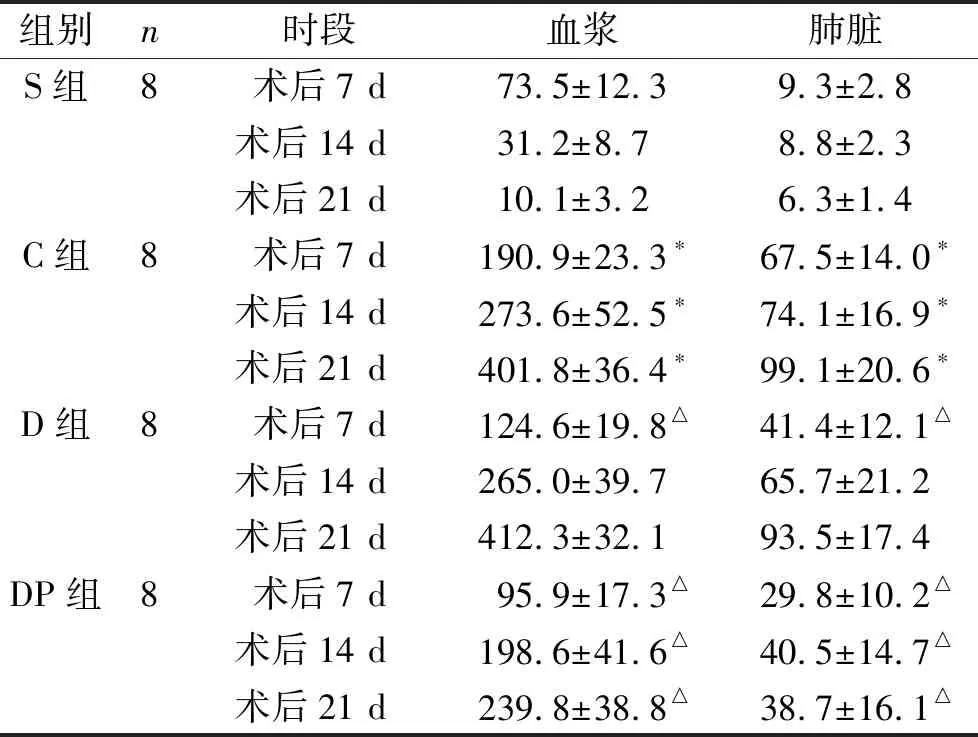
表2 四組各時間點血漿和肺組織SDF-1表達水平 (ng/ml )
注:與S組同時間點比較,*P<0.05;與C組同時間點比較,△P<0.05

表3 四組各時間點血漿和肺組織CX3CL1表達水平 (ng/ml)
注:與S組同時間點比較,*P<0.05;與C組同時間點比較,△P<0.05
2 術后21 d各組血氣分析結果變化 動脈血氣分析結果顯示:C組大鼠動脈血氧分壓(PO2)明顯低于S組大鼠而二氧化碳分壓(PCO2)沒有明顯差異;同時,C組的動靜脈血氧分壓差(AaPO2)與S組相比明顯升高。D組血氣結果各項指標變化不大,與C組相比,差異沒有統計學意義,而DP組的動脈氧分壓(PO2)和動靜脈氧分壓差(AaPO2)指標均明顯好轉。見表4。
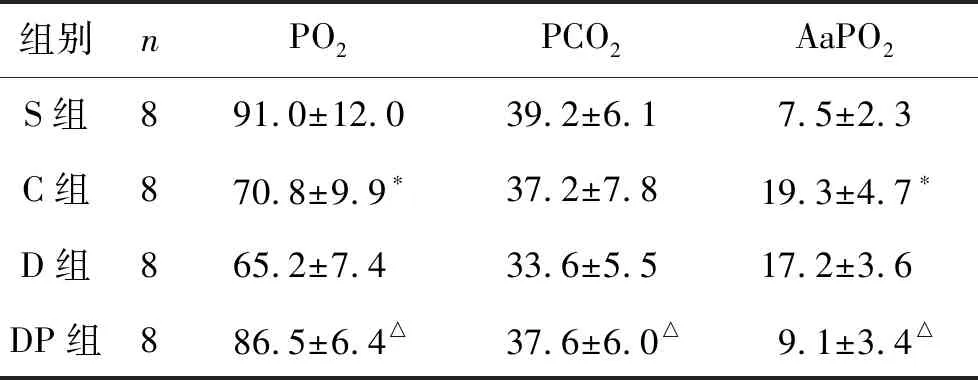
表4 術后21 d各組血氣分析結果變化 (mmHg )
注:與S組比較,*P<0.05;與C組比較,△P<0.05
3 術后21 d各組大鼠肺組織HE染色 肺組織HE染色結果顯示:與S組相比,C組大鼠肺組織炎性細胞浸潤明顯、肺泡結構紊亂、肺間質增厚;同時肺微血管擴張、數量增多。D組與C組相比病理表現沒用明顯改善,而DP組的炎性細胞浸潤與血管增生水平均明顯降低(圖1)。

圖1 各組肺組織HE染色結果 (200×)
討 論
肝肺綜合征是慢性肝病的嚴重肺部并發癥,最近的研究表明,病理性血管新生和增殖性損傷在CBDL大鼠肝損傷和肺損傷中起到關鍵作用,在一定程度上也促進了肝肺綜合征的發生發展[7]。而肺血管新生是一個多細胞參與的復雜過程,主要包括肺微血管內皮細胞(Pulmonary microvascular endothelial cells, PMVECs)的異常增殖、干細胞歸巢嵌入和單核細胞聚集炎性血管新生等[8]。研究發現SDF-1/CXCR4趨化信號軸在介導c-kit+細胞參與HPS肺血管新生中起到重要的作用,該研究顯示SDF-1在HPS大鼠肺組織中的表達明顯增多,并通過激活下游信號促進c-kit+細胞遷移到肺微血管,同時促進其旁分泌VEGF功能增強[2]。同時,Fallon等人的研究團隊發現CX3CL1可趨化單核細胞在肺內聚集,最后通過促進VEGF的表達從而促進HPS動物模型后期肺微血管的炎性增生[9]。以上研究提示VEGF、SDF-1以及CX3CL1均在HPS動物模型肺血管新生中起到重要作用,因此針對這些血管新生因子進行調控可控制HPS血管新生進程從而對HPS起到治療作用。
在我們既往的研究中發現術中持續給予右美托咪定能夠顯著降低肝門阻斷患者圍手術期血漿SDF-1的表達水平[6]。同時,研究發現環氧化酶2抑制劑帕瑞昔布鈉可以有效抑制HPS大鼠肺炎性血管新生[4]。因此在本次研究中,我們通過對比單獨應用右美托咪定和右美托咪定復合帕瑞昔布鈉對HPS大鼠血管新生相關因子的表達以及氧合功能的影響,進而探索針對HPS可能的治療策略。我們的研究結果發現:CBDL組大鼠各時間點血漿和肺組織中SDF-1和CX3CL1的表達水平明顯高于Sham組,而VEGF則僅在術后21 d增高明顯。單獨給予右美托咪啶處理僅對早期SDF-1的表達具有抑制作用,而對CX3CL1以及后期VEGF和SDF-1的表達均無明顯影響;聯合應用右美托咪啶和帕瑞昔布鈉后,CBDL組大鼠不同時間點各細胞因子的表達均明顯下降,提示右美托咪啶和帕瑞昔布鈉通過各自不同的機制對HPS大鼠各階段的血管新生因子的表達產生抑制作用。在CBDL的早期階段,肝臟和遠端器官可能被增多的膽紅素、內毒素和炎癥介質所損傷。而在晚期階段肝臟急性損傷逐漸代償、形成慢性肝硬化的改變,并最終導致肺部病變引起頑固性低氧血癥[10-11]。因此我們推測,早期CBDL大鼠主要是急性損傷引起的趨化因子SDF-1和CX3CL1表達的增高,而在疾病晚期持續性的缺氧和炎癥則成為各趨化因子表達增高的主要原因,并最終通過相關細胞的聚集引起VEGF的表達增高。右美托咪啶可通過激活α2腎上腺素能受體以及增強迷走神經興奮性從而發揮抗炎及抗交感作用[12-13],單獨應用右美托咪啶僅對HPS大鼠早期SFD-1的表達增高具有抑制作用,表明右美托咪啶主要可能通過對HPS大鼠早期急性損傷抗交感作用來抑制SDF-1的表達,該結果也表明早期SDF-1與CX3CL1的表達增多機制不同。當聯合應用右美托咪定和帕瑞昔布鈉后,帕瑞昔布鈉通過抑制環氧化酶2發揮持續性抗炎作用從而抑制疾病后期SDF-1、CX3CL1以及VEGF的表達,從而改善HPS的癥狀。
綜上所述,右美托咪啶復合帕瑞昔布鈉對實驗性HPS大鼠模型血管新生相關因子SDF-1、CX3CL1以及VEGF的表達具有明顯的抑制作用,能有效改善HPS大鼠氧合狀態。而右美托咪啶和帕瑞昔布鈉作為臨床上常用的兩種藥物,具有重要的臨床價值,該結果對進一步臨床探索HPS的治療手段具有參考意義。

