改性氧化石墨烯的制備及藥物控釋性能研究
張偉麗
(商丘職業技術學院, 河南 商丘 476100)
引 言
隨著納米技術與醫藥領域的不斷發展與進步,納米藥物載體系統已廣泛用于各類抗癌藥物的負載與控釋中,它能有效避免藥物直接進入人體時帶來的多藥耐藥性及高劑量給藥的毒性,降低藥物對人體的毒副作用.近年來,納米膠束、無機納米粒子、納米水凝膠等各種形式的納米藥物載體系統都在藥物控釋領域煥發著生機與活力[1].其中,最為矚目的是聚合物/無機粒子復合型納米水凝膠,它同時具備特殊聚合物的環境響應性與無機粒子的高效負載能力.
氧化石墨烯(GO),作為石墨烯的一種衍生物,既具備石墨烯大表面積與強光熱轉換能力的優勢[2],又具備多種親水官能團與pH敏感性.因此,它能同時負載親水與親油性藥物,且能在癌細胞周圍偏酸性的環境中產生響應,實現藥物的靶向釋放.但作為一種無機粒子,GO的膠體穩定性差,在生理環境中極易發生團聚現象[3],許多科研工作者為突破這一瓶頸做出了許多努力.Sabine課題組以聚(乙二醇)二甲基丙烯酸酯為基質,將還原氧化石墨烯(rGO)插層其中,使其能穩定存在,且利用rGO的光熱效應實現藥物的遠程光控釋放[4].Cao課題組則利用Au/SiO2納米粒子包覆rGO層狀物,他們所建立的這一體系不僅使rGO穩定存在,并且有效提高了材料的光熱穩定性與光熱轉化效率[5].盡管GO穩定存在的載藥系統多種多樣,他們也具備各自的環境響應性,但有關全面利用癌細胞自身環境的特殊性而建立的載藥系統則不多見.因此,基于癌細胞周圍環境的高溫(42℃)、弱酸性(pH 5.0)及還原性的特點[6],本文以N-異丙基丙烯酰胺(NIPAM)為溫敏性單體,N,N'-雙(丙烯酰)胱胺(BAC)為還原性交聯劑,采用原位聚合法聚合,使GO包裹于聚合物的網狀結構中,制備出穩定的溫度/pH/還原三重敏感的聚(N-異丙基丙烯酰胺)/氧化石墨烯(PG)納米凝膠,實現藥物的靶向釋放.
1 實驗
1.1 PNIPAM納米凝膠與PG納米凝膠的制備
將3.26 mL氧化石墨烯水溶液(0.5 mg/mL)、單體NIPAM(0.0648 mmol/L)、交聯劑BAC(0.0016 mmol/L)及乳化劑十二烷基硫酸鈉(SDS,0.0073 mmol/L)溶于50 mL超純水中,并置于三口燒瓶中攪拌半小時,同時進行加熱,當升溫至60℃時,向其中通入氮氣,隨后,攪拌中加入引發劑過硫酸鉀(KPS,0.0200 mmol/L)及促進劑NaHSO3(0.0259 mmol/L).再持續攪拌6 h使其充分聚合.隨后采用透析法,將得到的產物在超純水環境中透析3天.最終將得到的PG納米凝膠冷凍干燥,以備后續實驗使用.采用同樣的方法,在不加入GO的情況下,可制備PNIPAM納米凝膠.
1.2 載藥納米凝膠GD、PD與PGD的制備
將50 mg GO、PNIPAM與PG納米凝膠分別溶于5 mL超純水中,在攪拌下,向其中分別加入1 mL 抗癌藥物阿霉素水溶液(DOX,2 mg/mL).隨后,攪拌12 h進行藥物負載.負載后,采用透析法除去游離DOX,并將富含游離DOX的溶液收集起來,進行紫外光譜分析,通過光譜上490 nm處的吸收峰強度計算出游離DOX的含量,從而得到納米凝膠的載藥率(LC %)與包封率(EE %).最后,將透析好的載藥凝膠(GO/DOX (GD)、PNIPAM/DOX (PD)、PG/DOX (PGD))冷凍干燥,以備后續實驗使用.
1.3 藥物釋放行為研究
采用透析法研究藥物釋放行為.將2 mg載藥凝膠溶于1 mL超純水中,并置于透析袋中.將透析袋放入30 mL生理緩沖溶液(PBS)中,使透析在不同酸堿環境(7.4、6.5或5.0)、不同溫度(25、37或42 °C)及不同濃度(0、2或5 mM)的谷胱甘肽(GSH,還原劑)溶液中進行.在不同時間間隔時,取出3 mL透析液,用作紫外光譜分析,同時補充3 mL新鮮的PBS溶液.DOX隨時間的釋放量(Cumulative release (Cr))可通過下列公式計算:
Cr = 100 *Wt/Wtot
其中Wt與Wtot分別表示經過t時間溶液中釋放出的DOX總量與用于釋放研究的載藥凝膠中DOX的負載總量.
1.4 結構與性能分析
通過傅里葉變換紅外光譜儀(FT-IR, Spectrum one, Perkin-Elmer)與X射線衍射儀(Bruker D8, Bruker)對制備的PNIPAM、GO與PG的結構與組成進行表征,用激光粒度分析儀(ZS90, Malvern)對PG與GO的尺寸進行分析,通過粒度分析與拍攝的溶液分散性照片對PG與GO水溶液的穩定性進行分析比較,用紫外-可見光譜儀(UV-Vis, Lambda 35 CA, Perkin-Elmer)分析評價PNIPAM、GO與PG的載藥與釋藥性能.
2 結果與討論
2.1 結構與組成分析
圖1(a)給出了PNIPAM、GO與PG的紅外光圖譜.GO的紅外譜線上顯示出多處GO的特征吸收峰.波長3380 cm-1、1628 cm-1與1728 cm-1處分別為GO的羥基、碳碳雙鍵以及碳氧雙鍵的伸縮振動吸收峰.通過比較PG與GO的紅外譜線可知,PG的紅外譜線較GO的紅外譜線出現了一些新的吸收峰,波長3000 cm-1-2800 cm-1、1546 cm-1與1384 cm-1,1366 cm-1處分別為甲基、氨基與異丙基的伸縮振動吸收峰,這些基團均為PNIPAM的特征基團.圖1(b)給出了PNIPAM、GO與PG的X射線衍射圖譜.GO的X射線衍射譜線上, 2θ=10.73°處為GO的晶體衍射峰[7].在PNIPAM的譜線上則看不到晶體衍射峰,由于PNIPAM為無定型結構,因此譜線上僅出現了兩個寬峰,它們的強度較低.合成后的PG譜線形狀與PNIPAM相似,其譜線上已沒有晶體衍射峰,僅有兩個強度更弱的衍射峰.通過紅外圖譜分析與X射線衍射分析可知,利用原位聚合法,已成功制備PG納米凝膠.
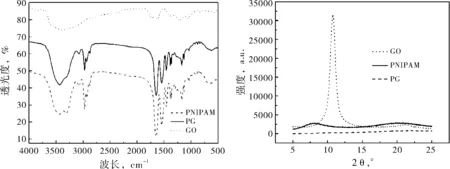
(a) PNIPAM、GO與PG的紅外光譜圖 (b) X射線衍射圖譜
圖1PNIPAM、GO與PG的結構及組成
2.2 穩定性分析
在生理環境中,載體必須穩定存在才能運輸藥物,發揮傳遞藥物的作用.圖2(a)給出了在生理緩沖溶液中,GO與PG的水力半徑隨時間的變化情況.從粒徑圖中可以看到,隨著時間的變化(0-10 h),PG納米粒子的水力半徑非常穩定,始終保持在130 nm左右,說明PG納米粒子能穩定存在于生理環境中.而GO在生理緩沖溶液中則極不穩定,0 h、1 h、5 h及10 h時,其水力半徑分別為8000 nm、6500 nm、3800 nm及4000 nm左右,說明GO在生理環境中無法穩定存在,容易發生聚沉現象.為了更直觀的比較PG與GO的生理穩定性,圖2(b)給出了不同時間下,PG與GO在生理緩沖溶液中的分散性照片.通過圖片對比,可明顯發現0 h時,GO溶液較為均勻,沒有沉降現象,但隨著時間的推移,GO溶液不再穩定,1 h、5 h及10 h時均出現了明顯沉降,且時間愈長,GO溶液的上清液愈澄清,沉降層愈致密.而在PG的分散性照片中,隨著時間的推移,PG納米水凝膠的分散液均呈現均一、穩定的狀態.因此,水力半徑的分析結果與分散性照片的對比情況表現出一致性,說明PG跟不穩定的GO溶液相比更適合作為藥物載體,它良好的生理穩定性有助于其在機體中的代謝與循環.
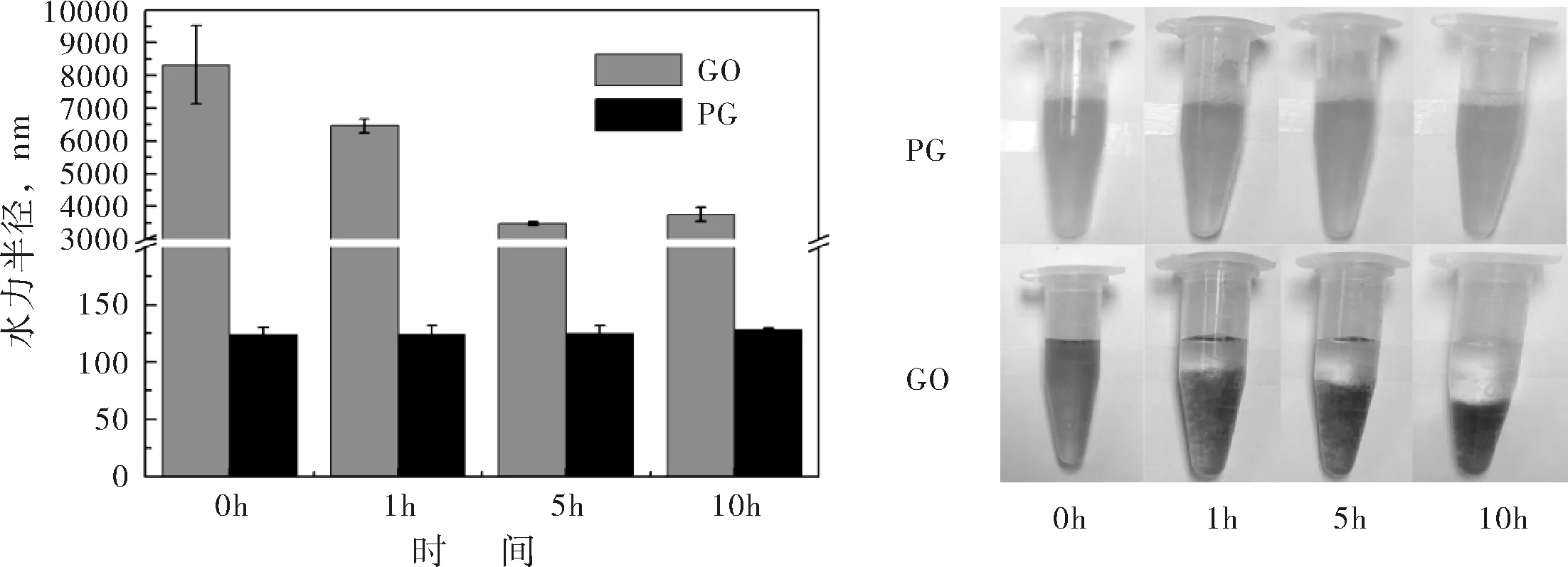
(a) GO與PG(pH 7.4)的水力半徑 (b) GO與PG的分散性照片
圖2GO與PG的穩定性分析
2.3 載藥性能分析
表1列出了載藥前后納米水凝膠的水力半徑與Zeta電位值.載藥前,25 ℃時GO水溶液的水力半徑為368±5 nm,37 ℃時水力半徑為379±4 nm,溫度的升高并未引起GO尺寸的變化,說明GO對溫度無響應性.而PNIPAM與PG粒子的尺寸均隨溫度升高而減小,說明這兩種粒子均能對溫度產生響應.且37℃時PG納米粒子的水力半徑為93±1 nm,尺寸小于100 nm,負載藥物后可通過血管的滲透保留而長期參與血液循環,降低給藥量.載藥后,盡管GO的載藥率(3.3 %)與包封率(85 %)均較高,但GD的尺寸增大到微米級,說明GO在負載DOX的過程中非常不穩定,與DOX作用,發生聚沉現象,不適合作為藥物載體使用.而載藥后的PD與PGD納米粒子的尺寸均保持在納米級,且為100 nm左右,并呈現出良好的溫度響應性.PGD的包封率(63 %)與載藥率(2.5 %)較PD(38%,1.5%)高,說明PGD對藥物的裝載能力強,是一種較理想的藥物載體.
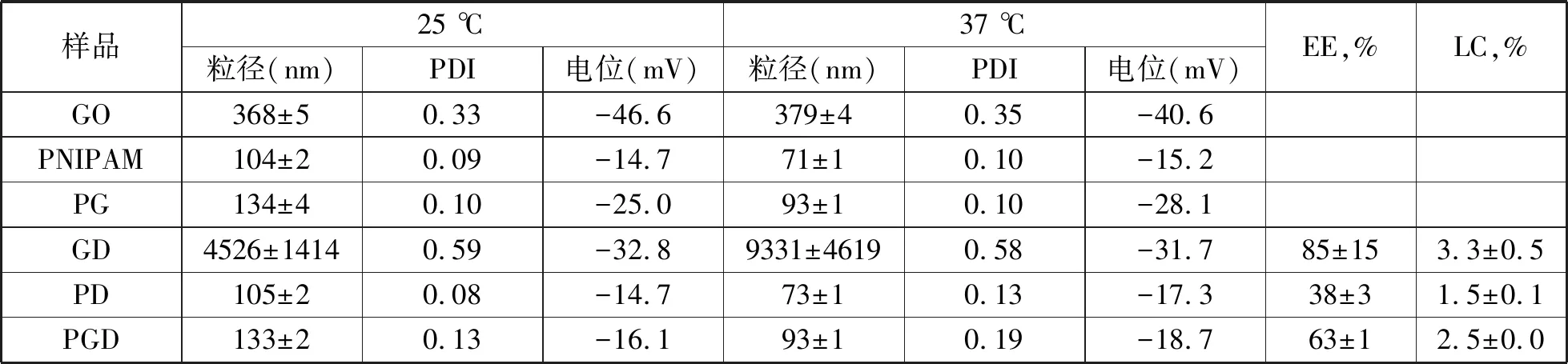
表1 納米水凝膠的尺寸與載藥性能表征
2.4 藥物釋放性能分析
圖3(a)給出了相同環境中PGD、PD、GD及游離DOX的釋放情況.由時間-釋放量曲線可知,GD中DOX的釋放非常緩慢,8 h時其釋放量僅為6.57 %,此結果與載藥性能結果相符,GO負載DOX的過程中極不穩定,易與DOX結合而聚沉,沉降后形成的GD將DOX緊緊包裹于其中,使DOX無法有效釋放出來.與之相對的,未被任何載體負載的游離DOX則釋放很快,4 h時其釋放量便達到99.97 %,近乎完全釋放.因此,不使用任何包覆手段,直接靜脈注射游離藥物來治療癌癥是不可取的,游離藥物會在血液循環的過程中對正常組織細胞產生毒副作用,且無法達到病灶.比較PD與PGD的時間-釋放量曲線可知,PGD對DOX 的釋放較PD更快,且相較游離DOX,PGD具有一定的緩釋能力.8 h時,PGD的釋放量為78.99 %,而PD的釋放量為67.12 %.因此,相較純聚合物載體PNIPAM,無機粒子與聚合物的雜化載體PG更適合進行藥物的遞送,既能保證遞送過程中藥物不會滲漏,又能保證抵達病灶后藥物能快速釋放出來.
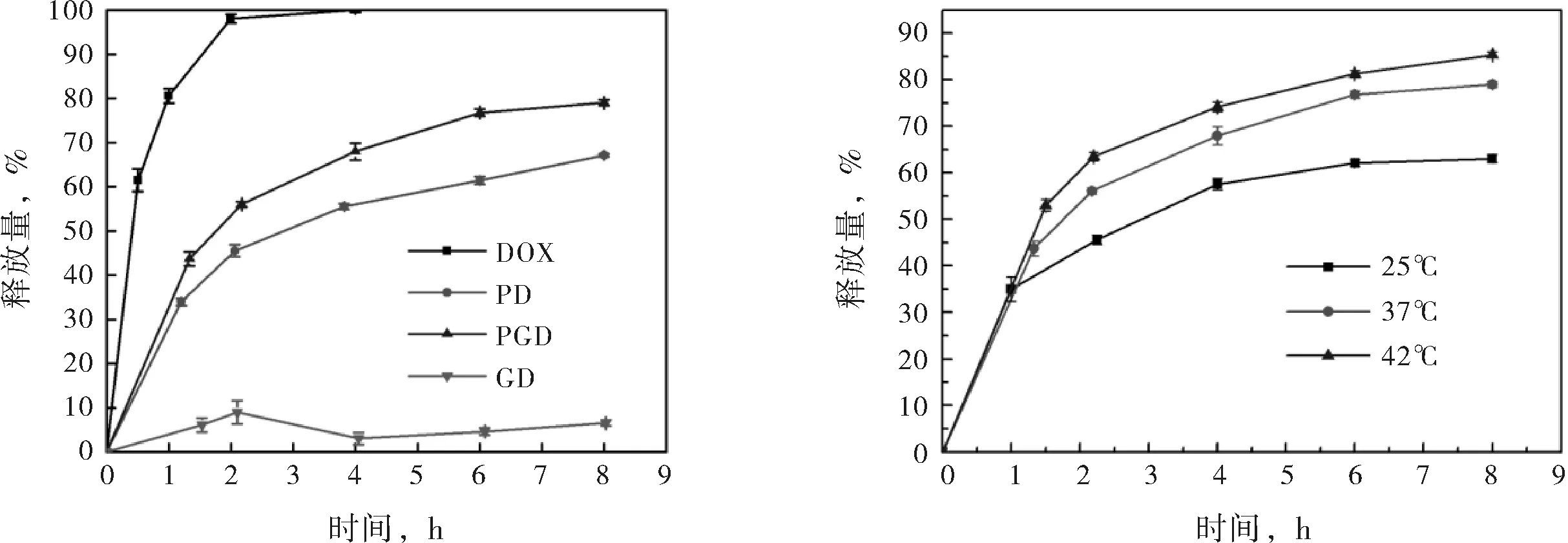
(a) DOX、PD、GD及PGD的時間-釋放量曲線(37 ℃,pH 7.4) (b) PGD的時間-釋放量曲線(25、37或42 ℃)
圖3納米凝膠的對比釋放性能
圖3(b)給出了PGD納米水凝膠在不同溫度下的時間-釋放量曲線.對比不同溫度下的釋放情況可知,隨著環境溫度的升高,PGD粒子對DOX的釋放加快,25 ℃、37 ℃及42 ℃時,PGD的8 h釋放量分別為63.06%、78.99 %及85.36 %.說明溫度升高促進DOX的釋放,此結果與不同溫度下的粒度分析相符.PNIPAM與PG均為溫度敏感性載體,負載藥物后依然能對溫度產生響應,當溫度升高至超過PNIPAM的最低臨界溶解溫度時,納米粒子將收縮,負載于其中的藥物會被擠出,從而釋放出來.PG載體的這種溫敏特性恰好適應于癌細胞的特殊環境,癌細胞增殖快,代謝快,其周圍的溫度(42 ℃)高于正常細胞(37 ℃),因此,使用這種藥物載體可實現藥物的靶向遞送與釋放,可提高藥效,減小副作用.
圖4(a)給出了PGD在不同還原環境中的時間-釋放量曲線.對比不同還原環境中的PGD釋放情況可知,隨著環境中還原性物質濃度的增大,PGD對DOX的釋放速度加快,0、2及5 mM GSH時,PGD的10 h釋放量分別為71.77 %、86.36 %及90.15 %.結果說明PGD具有還原響應性,當環境中還原物質(GSH)的濃度越高時,PGD對DOX的釋放越快.由于聚合過程中使用的交聯劑為BAC,它是一種含S-S鍵的物質,而S-S鍵極易被還原性物質還原而斷裂,形成-S-,因此經S-S鍵交聯的PGD納米粒子在還原環境中將解交聯,粒子形態坍塌,包裹其中的藥物易被釋放出來.癌細胞由于代謝迅速,還原性代謝產物累積在其周圍,導致癌細胞的周圍呈還原性.使用PG作為藥物載體時,它能靶向癌細胞,并且僅在癌細胞周圍迅速釋放藥物,確保藥物不在正常組織處滲漏,減小了毒副作用,同時增大了藥效.
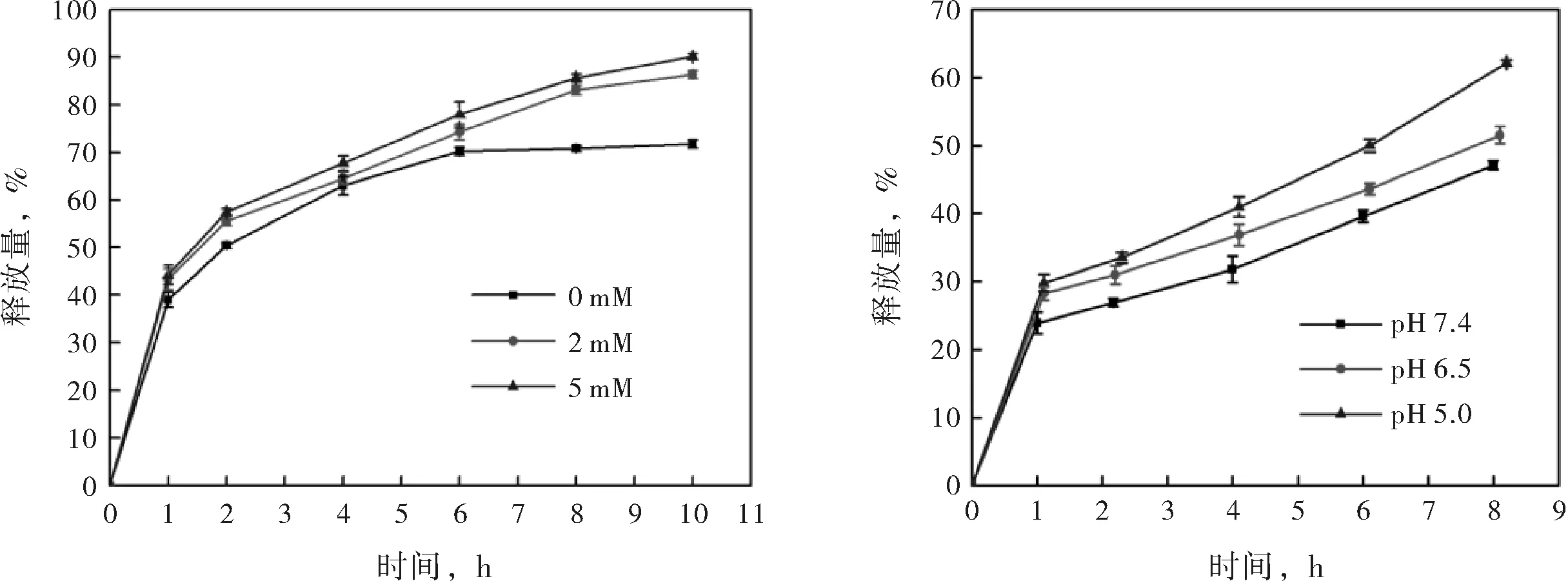
a) PGD的時間-釋放量曲線(0、2或5 mM GSH) b) PGD的時間-釋放量曲線(pH 7.4、pH 6.5或pH 5.0)
圖4PGD敏感釋放性能
圖4(b)給出了PGD在不同pH下的時間-釋放量曲線.對比不同酸堿度環境中的PGD釋放情況可知,隨著環境酸性的增強,PGD對DOX的釋放速度加快,pH 7.4、pH 6.5及pH 5.0時,PGD的8 h釋放量分別為47.09 %、51.54 %及62.14 %.結果說明PGD具有pH響應性,當釋藥環境呈酸性時更有利于藥物的釋放.PG納米粒子帶負電(見表1),DOX帶正電,他們通過靜電相互作用結合,實現藥物的負載,當環境呈微酸性時,PG納米粒子將被質子化,電負性降低,導致PG與DOX間的相互作用力減弱,DOX從PG納米粒子中游離出來,實現釋放.PGD的pH響應行為同樣適合癌細胞的微環境,相較中性的正常環境,癌細胞周圍的環境呈微酸性,因此,使用PG作為藥物載體時,在正常組織中,PGD不易釋放DOX,待遞送至癌細胞處,PGD將對酸性環境產生響應,從而迅速釋放出DOX.
3 結 論
1)采用原位聚合法,將無機粒子GO與溫敏性聚合物PNIPAM結合制備的PG納米水凝膠可穩定存在于生理環境中,實現對藥物的穩定負載.
2)PGD的載藥率(2.5 %)與包封率(63 %)均高于PD(38%,1.5%),因此PG在有效負載藥物方面較PNIPAM更具優勢.
3)PGD在不同環境中的釋放量不同,表現出多重響應性控釋行為:環境溫度升高時(25 ℃-42 ℃),PGD的8 h釋放量由63.06 %增長至85.36 %;環境酸性增強時(pH 7.4-pH 5.0),PGD的8 h釋放量由47.09 %增長至62.14 %;環境中GSH濃度增大時(0-5 mM),PGD的10 h釋放量由71.77 %增長至90.15 %.癌細胞周圍環境呈高溫、微酸性與還原性,因此使用PG作為藥物載體可實現藥物的靶向遞送與釋放.

