表皮生長因子對乳腺癌細胞上皮-間質轉化的影響及鈣蛋白酶的介導作用*
金 愛, 王宏鍵, 王旭東*
(貴州醫科大學 基礎醫學院 生理學教研室, 貴州 貴陽 550025)
乳腺癌是女性最常見的激素依賴性惡性腫瘤,嚴重威脅女性的身心健康[1-2]。表皮生長因子(epidermal growth factor,EGF)是一種由53個氨基酸殘基組成的耐熱單鏈低分子多肽,可與靶細胞上的EGF受體特異性識別,最終促進靶細胞DNA合成及有絲分裂[3-4]。以往研究證明,EGF可誘導乳腺癌MCF-7和MDA-MB-231細胞發生上皮間質轉化(EMT)[5-6],EMT作為一種生物學過程,可使上皮細胞通過特定程序轉化為具有間質表型的細胞[5-6],還可使上皮來源的惡性腫瘤獲得遷移和侵襲能力[7-8],腫瘤細胞的遷移和侵襲能力是增強乳腺癌轉移的必要條件[9],提示有效抑制EMT可能是遏制乳腺癌轉移的關鍵。本課題組前期工作顯示,EGF可通過Calpain誘導乳腺癌MCF-7細胞遷移[10],但Calpain是否參與EGF誘導的EMT還未見文獻報道,本研究主要對此進行探討。
1 材料和方法
1.1 材料
1.1.1實驗材料和試劑 人乳腺癌細胞系MDA-MB-231、MCF-7(中國科學院上海細胞庫),DMEM培養基、RPMI-1640培養基、抗生素(penicillin and streptomycin,美國Hyclone 公司),胎牛血清(杭州四季青公司),EGF(美國Peprotech),Calpeptin(美國sigma公司),抗FN多克隆抗體(美國abcam公司),羊抗小鼠IgG-HRP,羊抗小兔IgG-HRP購自美國Santa Cruz公司,抗E-cadherin多克隆抗體、抗GAPDH多克隆抗體(南京Bioworld公司),蛋白濃度測試試劑盒(上海碧云天公司)。
1.1.2實驗儀器 Model 310恒溫CO2培養箱購自美國Thermo公司,SW-CJ-2FD超凈工作臺購自蘇州凈化,MiniVE電泳設備購自美國GE公司,CKX41倒置顯微鏡購自日本Olympus公司,凝膠成像系統購自美國SynGene公司。
1.2 方法
1.2.1細胞培養 MCF-7細胞培養于10% FBS、1% 抗生素、89% RPMI-1640培養基中,MDA-MB-231乳腺癌細胞培養于10% FBS、1% 抗生素、89% DMEM培養基中。細胞培養于培養箱中,培養條件為37 ℃、5% CO2及飽和濕度。
1.2.2藥物處理 取對數期細胞傳代于6孔板或12孔板中,當細胞密度達到60%~90%時,更換成不含血清的RPMI-1640或DMEM培養基同步化24 h,當細胞生長至所需實驗密度時,加EGF(50 μg/L)處理或加入Calpeptin(10 μmol/L)預處理4 h后用EGF處理。
1.2.3劃痕實驗檢測細胞遷移能力 將生長狀態良好的模型細胞鋪于12孔板中,培養細胞至90%~100%密度后,更換無血清培養基繼續培養細胞24 h,用200 μL槍頭在12孔板皿底作“十字”劃痕,以PBS清洗掉漂浮細胞。加EGF處理或加入Calpeptin預處理4 h后用EGF處理模型細胞。分別在0 h、24 h和48 h時在標記區域進行拍照記錄,統計細胞劃痕區域寬度,計算細胞遷移率,細胞遷移率=[(0 h劃痕寬度-24 h/48 h劃痕寬度)/0 h劃痕寬度]×100%。
1.2.4蛋白印記實驗檢測模型細胞FN和E-cadherin表達變化 消化模型細胞并鋪于6孔板,次日更換無血清培養基同步化24 h,待細胞匯合度達70%,加EGF處理或加入Calpeptin預處理4 h后用EGF處理模型細胞,于處理結束后提取蛋白,配制含1 mmol/L蛋白酶抑制劑的RIPA細胞裂解液并于冰盒中裂解20 min,于4 ℃離心機中以12 000 r/min離心15 min,吸取上清液至標記好的EP管中,立即進行蛋白定量。10% SDS-PAGE凝膠電泳分離蛋白(30 μg/泳道),濕轉法將分離的蛋白轉印至硝酸纖維膜。5%牛血清白蛋白室溫封閉1~2 h,TBST洗膜3次/10 min,然后按要求加入抗FN多克隆抗體(1∶1 000)、抗E-cadherin多克隆抗體 (1∶1 000)室溫孵育2 h。TBST洗膜3次/10 min,加入相應二抗(1∶4 000)室溫孵育1 h,用凝膠成像儀進行成像拍照。
1.3 統計學處理

2 結果
2.1 EGF促進模型細胞遷移
EGF處理24 h和48 h時均能顯著促進模型細胞遷移。與對照組比較,EGF組MCF-7細胞24 h時遷移率增加(149.2±10.1)%,48 h時遷移率增加(246.7±14.6)%,差異有統計學意義(P<0.01);與對照組比較,EGF組MDA-MB-231細胞24 h時遷移增加(55.0±4.3)%,48 h時遷移率增加(90.9±8.5)%,差異有統計學意義(P<0.01),見圖1。
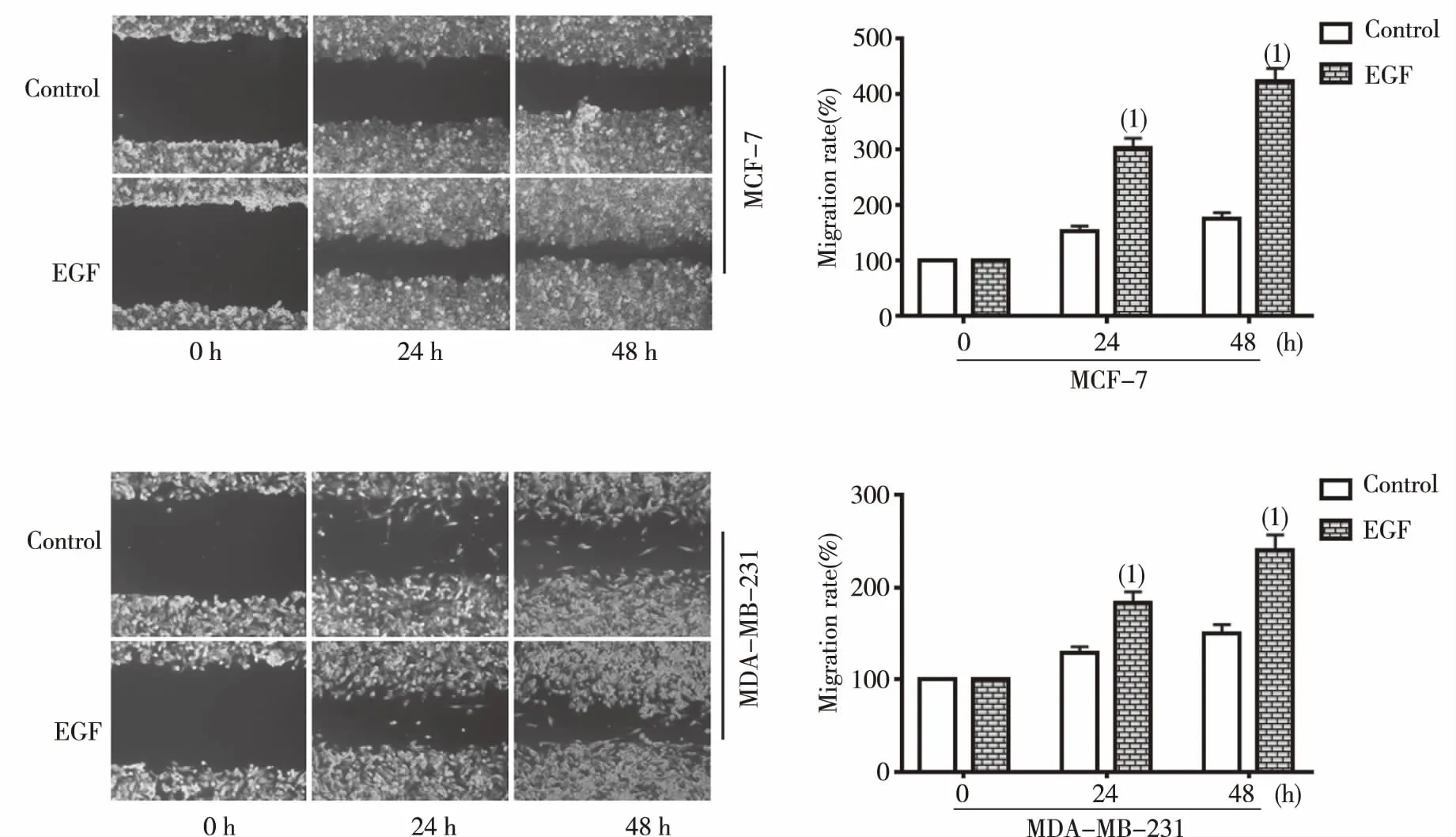
(1)與對照組比較, P<0.01圖1 EGF不同誘導時間兩種乳腺癌模型細胞遷移Fig.1 Migration of two breast cancer models induced by EGF at different time
2.2 EGF誘導模型細胞E-cadherin表達下調和FN表達上調
EGF處理24 h、48h和72 h時均能誘導MCF-7和MDA-MB-231細胞FN表達上調和E-cadherin(E-cad)表達下調,差異有統計學意義(P<0.01),其中在48 h時EGF顯示具有最佳誘導效應,見圖2。
2.3 Calpeptin抑制EGF誘導的模型細胞遷移
Calpeptin(10 μmol/L)預處理能顯著抑制EGF誘導的模型細胞遷移。與EGF組相比,EGF+Calpeptin組MCF-7細胞24 h時遷移降低(88.2±7.6)%,48 h時遷移率降低(68.3±5.2)%,差異有統計學意義(P<0.01);與EGF組比較,EGF+Calpeptin組MDA-MB-231細胞24 h時遷移率降低(29.1±2.5)%,48 h時遷移率增加(39.6±3.5)%,差異有統計學意義(P<0.01),見圖3。
2.4 Calpeptin抑制EGF誘導的模型細胞E-cadherin表達下調和FN表達上調
Calpeptin預處理EGF處理模型細胞48 h時,顯著抑制EGF誘導的MCF-7和MDA-MB-231細胞FN表達上調和E-cad表達下調,有統計學意義(P<0.01),見圖4。
3 討論
眾所周知,乳腺癌患者死亡的主要原因是腫瘤細胞遠位轉移[11]。而腫瘤細胞轉移涉及多個生物學過程,包括原發腫瘤細胞脫落、遷移、侵襲、黏附及血管生成等[12]。已有大量研究報道乳腺癌細胞EMT伴隨遷移和侵襲活動增強[13-14]。臨床研究顯示,EMT標志物E-cadherin和波形蛋白與乳腺癌淋巴轉移存在明顯相關性[15]。提示EMT是引起乳腺癌遷移、侵襲及轉移的關鍵生物學行為之一。本課題組前期工作顯示, EGF可促進ER陽性的MCF-7細胞遷移[10]。而本研究結果發現,EGF不僅能誘導ER陽性的MCF-7細胞遷移,同時在ER陰性的MDA-MB-231細胞中也發揮類似誘導效應。進一步實驗發現,EGF能顯著誘導MCF-7和MDA-MB-231細胞FN蛋白表達上調和E-cadherin蛋白表達下調。而FN表達上調和E-cadherin的減少或丟失被認為是EMT的重要標志[16]。提示EGF可誘導MCF-7和MDA-MB-231細胞EMT。本課題組前期工作報道,Calpain抑制劑預處理可抑制EGF誘導的MCF-7細胞遷移[10]。而本研究在MCF-7和MDA-MB-231細胞中也觀察到了相類似的現象。為觀察Calpain是否參與EGF誘導的模型細胞EMT,本研究進一步觀察了Calpain特異性抑制劑Calpeptin的抑制效應。結果顯示,Calpeptin可顯著抑制EGF誘導的FN蛋白表達上調和E-cadherin蛋白表達下調。提示,抑制Calpain可抑制EGF誘導的MCF-7和MDA-MB-231細胞EMT。

(1)與0 h時比較, P<0.01圖2 EGF不同誘導時間對兩種乳腺癌細胞中FN和E-cad蛋白水平表達的影響Fig.2 Effects of EGF on the expression of FN and E-cad protein levels

(1)與EGF組比較,P<0.01圖3 Calpeptin抑制EGF不同誘導時間的乳腺癌細胞遷移Fig.3 Calpeptin inhibits the migration of breast cancer cells induced by EGF

(1)與EGF組比較, P<0.01圖4 Calpeptin預處理抑制EGF對兩種乳腺癌細胞E-cadherin和FN表達的誘導Fig.4 Calpeptin pretreatment inhibits EGF-induced expression of E-cadherin and FN in model cells
綜上所述,EGF能誘導ER陽性乳腺癌MCF-7和ER陰性乳腺癌MDA-MB-231細胞EMT和遷移,而本研究首次發現上述效應可能與Calpain的介導作用相關。大量證據表明Calpain與包括乳腺癌在內的多種癌癥的發生有關,如參與腫瘤轉移和細胞增殖[17-18]。因此,干預Calpain可能有助于遏制EGF的促癌作用。Calpain包括多種亞型分子,廣泛表達的Calpain分為μ-鈣蛋白酶(Calpain1)和m-鈣蛋白酶(Calpain2)[19]。本研究下一步實驗將會重點探討Calpain1和Calpain2在上述生物學行為中的作用,為臨床乳腺癌治療提供理論依據。

