右美托咪啶對結直腸癌手術麻醉后疲勞程度及恢復質量的影響
王 倩,徐 銳,夏 娟,田澤丹,胡 薇,黃 河,杜 權△
(1.成都市第一人民醫院麻醉科 610041;2.重慶醫科大學附屬第二醫院麻醉科 400010; 3.重慶醫科大學附屬第三醫院麻醉科 401120)
結直腸癌在全球的發病率都較高,2015年中國惡性腫瘤統計數據顯示,結直腸癌發病率、病死率居我國惡性腫瘤前位,其儼然已成為影響國民健康的主要腫瘤之一[1]。目前,結直腸癌治療的方式是腹腔鏡手術切除為主的綜合治療,手術和心理等因素引起神經、代謝、炎癥等應激改變,這些改變的恢復過程即是術后恢復。如何促進結直腸癌患者手術后的恢復,縮短住院時間,減少醫療支出,促進醫療資源分配是當前關注的熱點問題[2-3]。外科微創的手術方式大大加快了患者術后的恢復[4]。與此同時,圍術期不可缺少的麻醉醫生在患者快速康復中也扮演著重要的角色。合理選擇麻醉方式、優化藥物選擇,可以加快結直腸癌患者術后恢復[5]。右美托咪啶(DEX)是高選擇性α2腎上腺素受體激動劑,有鎮靜、鎮痛、抗焦慮、交感抑制等優點,本研究觀察了靜脈輸注DEX的結直腸癌患者術中血流動力學、術后不良反應、術后3 d的15項恢復質量量表(QoR-15量表)、疲勞嚴重度評分(FSS)等,為DEX在結直腸癌手術患者中的合理使用提供參考。
1 資料與方法
1.1一般資料 研究按臨床試驗要求,獲得重慶醫科大學附屬第二醫院倫理委員會批準,取得患者或家屬的同意。選擇2017年4-12月重慶醫科大學附屬第二醫院收治的全身麻醉下行腹腔鏡結直腸癌根治術患者,年齡40~75歲,美國麻醉醫師協會(ASA)Ⅰ~Ⅲ級。排除標準:(1)DEX使用禁忌者;(2)術前感染、患免疫系統疾病者;(3)患內分泌系統疾病者;(4)貧血[血紅蛋白(Hb)<70 g/L]、心力衰竭者;收縮壓過高或過低者(>200 mm Hg或小于90 mm Hg);(5)服用干擾腎上腺功能或抗交感藥物者。剔除標準:(1)術中變換手術方式;(2)術中輸血;(3)術后發生并發癥;(4)術后電解質紊亂;(5)病理結果為良性。計算機產生隨機數字,隨機分為DEX組(D組)和對照組(C組),放進密閉的信封中,手術當天由恢復室護士拆開信封,并根據分組情況配制藥液,不做特殊標記,給予手術室內麻醉醫師。
1.2方法
1.2.1麻醉方法 患者均開放兩條靜脈通道,一條為實施干預專用通道;監測心率(HR)、血壓(BP)、心電圖(ECG)、血氧飽和度(SpO2),局部麻醉下行橈動脈穿刺監測有創動脈壓。麻醉誘導開始前15 min,D組靜脈泵注DEX(0.5 μg/kg);C組靜脈泵注0.5 μg/kg生理鹽水。給氧去氮(100%氧氣),依次靜脈注射咪達唑侖(0.1 mg/kg)、丙泊酚(2 mg/kg)、舒芬太尼(0.4 μg/kg)、順式阿曲庫銨(0.2 mg/kg),3 min后氣管插管,機械通氣模式選擇容量控制,維持呼氣末二氧化碳分壓(PetCO2)在35~45 mm Hg。麻醉維持期間持續靜脈泵注4~6 mg·kg-1·h-1丙泊酚、0.1~0.2 μg·kg-1·min-1瑞芬太尼,間斷予以順式阿曲庫銨維持肌肉松弛。D組持續靜脈泵注0.2 μg·kg-1·min-1DEX,C組予以生理鹽水至開始手術縫皮。若HR小于50次/分鐘,靜脈予以0.5 mg阿托品;若有創動脈壓變化超過基礎值20%,靜脈予以血管活性藥。麻醉蘇醒:術畢患者送至恢復室,合理予以肌松拮抗劑,待肌力、意識達到標準后拔出氣管導管。術后采用靜脈鎮痛(PCIA):舒芬太尼(50 μg)、地佐辛(15 mg)、昂丹司瓊(12 mg),總容量100 mL,背景劑量2 mL/h,單次按壓劑量0.5 mL,鎖時15 min。
1.2.2觀察指標 (1)收集患者一般資料,包括性別、年齡、體質量指數(BMI)、手術時間、出入量。(2)QoR-15量表、FFS、疼痛視覺模擬評分量表(VAS)在術前1 d(Pre)、術后第1天(D1)、術后第2天(D2)、術后第3天(D3)完成。(3)記錄T0(誘導前15 min)、T1(氣管插管完成即刻)、T2(手術切皮時)、T3(二氧化碳氣腹建立時)、T4(氣管導管拔除即刻)、 T5(出手術室時)6個主要時間點的HR和平均動脈壓(MAP)。(4)記錄術后2 d按壓鎮痛泵的次數;術后其他鎮痛藥物的使用和寒戰、惡心嘔吐的發生例數;術后住院時間。

2 結 果
2.1兩組一般資料比較 研究共納入結直腸癌手術患者69例,剔除9例不符合試驗要求,最終D組和C組各30例,見圖1。兩組患者一般資料比較,差異均無統計學意義(P>0.05),見表1。
2.2兩組術中HR與MAP比較 D組術中的HR和MAP均較C組低,同時波動較小,見圖2、3。
2.3兩組QoR-15量表評分比較 兩組組內比較:與D1比較,D2、D3時QoR-15量表評分均升高,且D3高于D2,差異均有統計學意義(P<0.05)。組間比較:Pre時兩組QoR-15量表評分無明顯差異(P=0.06);D1、D2、D3時D組QoR-15量表評分均高于C組,D1、D2、 D3平均差值分別為[5.30,95%CI(7.58~3.02)]、[7.23,95%CI(9.47~5.00)]、[6.20,95%CI(8.29~4.11)],見表2。
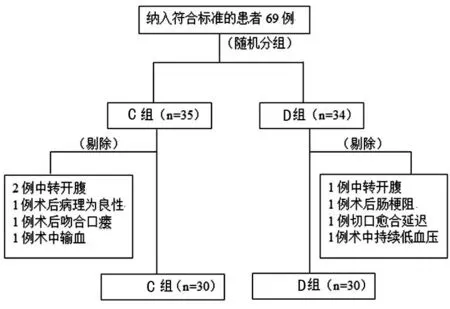
圖1 研究流程圖
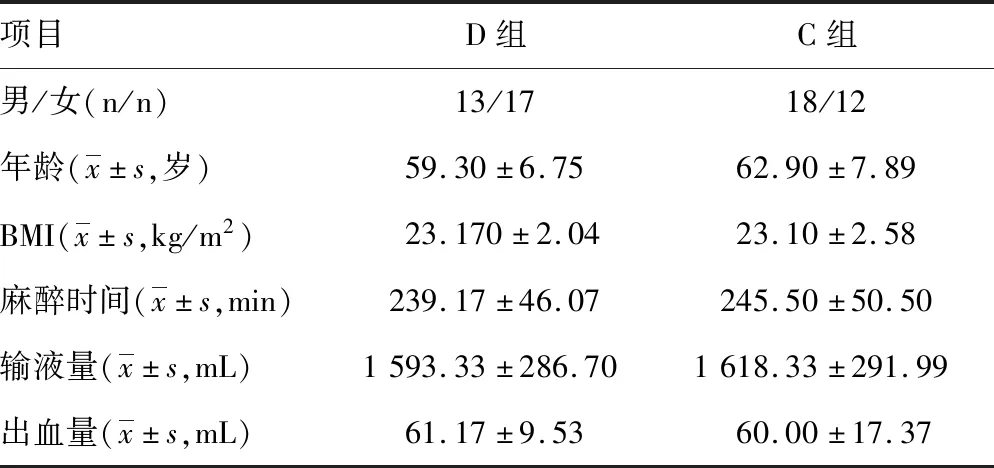
表1 兩組一般資料比較(n=30)
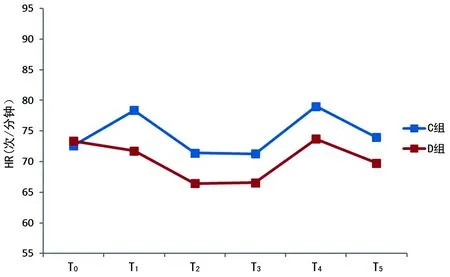
圖2 兩組不同時間點的HR
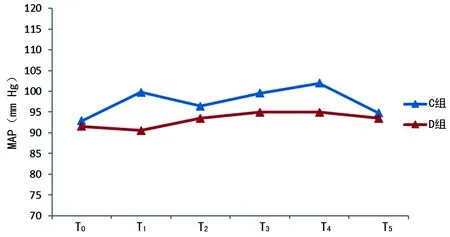
圖3 兩組不同時間點的MAP
表2 兩組術前及術后QoR-15量表評分比較分)
a:P<0.05,與同組Pre時比較;b:P<0.05,與同組D1時比較;c:P<0.05,與同組D2時比較
2.4兩組FSS及VAS評分比較 兩因素重復測量方差分析結果顯示,兩組FSS和VAS評分情況,見表3、4。組間比較,在Pre、D1時點兩組FSS和VAS評分比較,差異均無統計學意義(P>0.05)。D2、D3時D組的FSS和VAS評分均低于C組,差異有統計學意義(P<0.05)。
表3 兩組術前及術后FSS比較分)
a:P<0.05,與同組Pre時比較;b:P<0.05,與同組D1時比較;c:P<0.05,與同組D2時比較
表4 兩組術前及術后VAS評分比較分)
a:P<0.05,與同組Pre時比較;b:P<0.05,與同組D1時比較;c:P<0.05,與同組D2時比較
2.5兩組術后鎮痛、不良反應及住院時間比較 術后24、48 h鎮痛泵按壓次數D組較C組少;術后2 d,D組額外鎮痛藥物使用率低于C組;同時,D組術后寒戰、惡心嘔吐不良反應發生率也較C組低。D組術后平均住院時間較C組縮短,見表5。
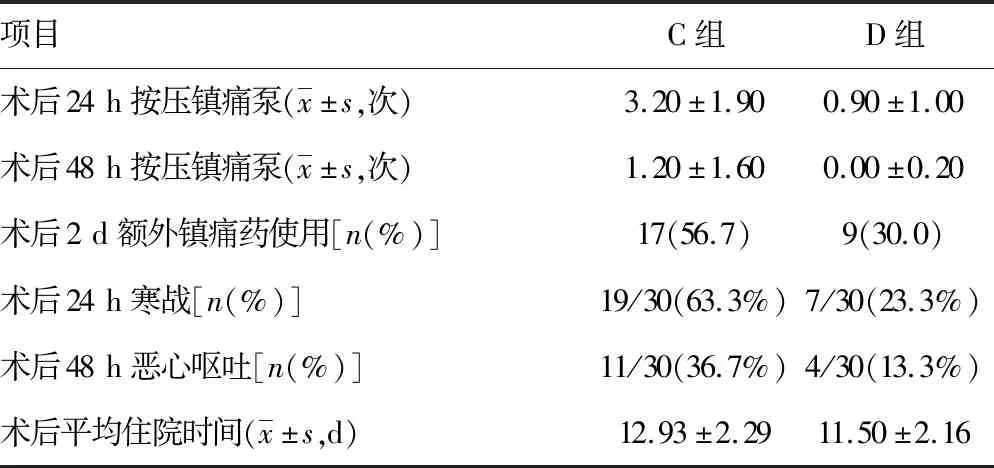
表5 兩組術后鎮痛、不良反應及住院時間比較(n=30)
3 討 論
近年來結直腸癌的發病率逐漸升高,腹腔鏡下手術治療已經成為其手術治療的主要方法。盡管外科技術和設備上的進步使得患者術后并發癥、住院費用等減少。然而,手術引起的組織損傷仍會導致內分泌改變和炎性反應的激活,這些應激改變不利于術后的恢復。加速康復外科(ERAS)理念已經深入人心,麻醉醫生是其中不可或缺的部分。研究表明,DEX作為全身麻醉的輔助藥物,能起到抗炎、抑制應激反應的作用,具有器官保護的作用[6-7],這些優點增加了DEX在圍術期麻醉管理中的應用。結合參考文獻、臨床經驗和手術患者情況,本研究選擇負荷劑量為0.5 μg/kg,維持劑量為0.2 μg·kg-1·min-1開始縫皮。
術后恢復結果不可量化,不能直接被觀察到,是潛在的結果[2]。傳統的術后恢復僅僅關注生理參數,而忽視了心理、精神方面。隨著醫療技術和人們需求層次的提高,逐漸出現了包括生理、心理、精神等多方位的評估工具。它們的適用范圍、評估時間、評估效度不盡相同,也說明術后恢復是一個多維度、復雜的概念。理想的術后評估工具包括兩大特點:(1)能夠用直觀、簡單的方式,如二分類變量來表示結果;(2)同時能在不同的時間點進行評估[8]。術后評估工具QoR-15量表包括5個方面,總分為150分,評價力度高,可重復性好,3 min可以完成量表,能夠有效地反映術后康復,臨床適用性強是其突出的優點[9]。此外,該量表切實關注了患者自身的感受,很好地體現了以患者為中心的醫學形式。本研究顯示,在麻醉期間輔用DEX能促進結直腸癌手術患者術后的早期恢復。這與DEX在圍術期多個環節產生不同的作用息息相關。
穩定的血流動力學是重要臟器功能的保障,有助于手術患者的預后恢復能力。作者觀察到DEX都能夠明顯減少傷害性刺激較大幾個時間點的HR或MAP的升高,同時整個手術過程中,D組MAP波動較小。這說明術中使用DEX能夠提供較好的血流動力學,與其他的研究結果相似[10-11]。
術后寒戰、惡心嘔吐及術后的疼痛,均是影響患者恢復的因素。DEX與α2B受體結合,鉀離子內流增加引起神經細胞發生去極化,體溫中樞敏感性降低及神經沖動傳導減慢,降低術后寒戰的發生[12]。此外DEX抑制了交感興奮,兒茶酚胺分泌減少,這是其減少術后惡心嘔吐發生的重要機制[13]。DEX鎮痛機制復雜,目前認為可能在外周神經、藍斑及脊髓3個水平通過不同的機制產生鎮痛作用:(1)Aδ和C傳入神經纖維被抑制,細胞超極化,阻滯外周疼痛信號的傳遞;(2)藍斑抑制,突觸前膜P物質釋放減少,同時阻斷背角傷害性信息的傳導[14];(3)脊髓突觸前后膜α2A受體與DEX結合,去甲腎上腺素釋放的抑制和膽堿能神經的興奮相協同減少了傷害性刺激[15]。本研究結果表明,DEX能夠降低術后24 h寒戰的發生率,減少術后48 h惡心嘔吐的發生。
除上述因素外,圍術期應激反應和炎性小體介導的炎性反應可引起免疫抑制,影響癌癥患者的術后恢復。JIANG等[16]的Meta分析結果提示,使用DEX能夠有效地降低神經外科手術患者血清白細胞介素(IL)-6、腫瘤壞死因子α(TNF-α)水平,同時對降低超氧化物歧化酶、皮質醇、血糖水平也有明顯效果。肺癌根治術中使用DEX能明顯降低促炎因子(IL-1β、IL-10、TNF-α)和丙二醛水平,同時升高髓過氧化物酶和黃嘌呤氧化酶含量[7]。這些研究指出,DEX還具有抗炎、抗氧化作用,相關機制如下:釋放膽堿能遞質α-7煙堿乙酰膽堿受體,興奮迷走神經,抑制促炎因子IL-6、TNF-α等的釋放[17];TLR4/MyD88/ERK1/2/NF-κB通路被抑制,促炎因子釋放減少[18]。
疲勞是患者的自身感受,影響患者術后生活質量,是術后恢復不容忽視的一個指標,腹部大手術后更明顯,其病因復雜[19]。本研究發現,C組術后第2、3天FSS高于D組,D組患者住院時間較C組縮短。在開腹婦科手術的臨床研究中也觀察到了類似的結果[20]。事實上,最近研究顯示,炎性反應也是導致術后疲勞的關鍵機制[21],尤其是中樞神經炎性介質的活化和氧化應激反應的激活[19]。
麻醉誘導-維持-蘇醒-術后并發癥都影響著術后恢復質量。圍麻醉期間的每個環節都該引起足夠的重視,這樣才能夠保證患者術后的恢復質量。通過試驗,觀察到DEX能夠提供穩定的血流動力學,能夠減輕術后疲勞嚴重程度,減少術后并發癥的發生,能夠輔助術后鎮痛、減少術后鎮痛泵按壓次數,有利于患者的術后恢復。盡管DEX有諸多優點,然而出現心動過緩、低血壓的可能性不容忽略。另外,在臨床使用中也發現部分患者可能出現蘇醒延遲,尤其是同時使用了咪達唑侖。這也提示需要根據患者的具體情況,合理使用DEX。

