生命信息安全控制體系整體結構性構建與分析
諶南輝,宋德平
(江西農業大學 動物科學技術學院,南昌 330045)
作者曾于生命信息安全控制原理探討的基礎上[1],在《生命信息安全控制原理的再探討》一文中將該機制歸納形成了一個生命信息安全控制原理圖[2],接著在生命機體與危險因子間建立了一個生命物質信息對話平臺[3]
1 整體結構性圖形構想表述與解析
由圖1(a)(三視圖為圓臺形)、1(b)(正視圖為梯形)、1(c)(俯視圖為同心圓)可見,生命信息安全控制體系由2大部分構成,即內在部分與外延部分。前者由特異性識別系統(適應性識別方式)、泛特異性識別系統(古老固有識別方式)、皮膚與黏膜(屬純粹組織學性質的連接部)和共生微生物(位于基底層)4個層次(以實線標示)構成;后者即外環境開放接觸面(以虛線標示)。在此需要特別注明的是,內在部分各部間以及與外延部分之間存在物質、能量、信息交流溝通傳遞的空間界面,并以粗實線條標識。3個圖形中共同的存在一個中心軸,以虛線標示,即生命信息安全控制軸。

圖1 生命信息安全控制體系整體結構圖示Fig.1 Sketch map of system structure on the life information security control system
特異性識別系統與泛特異性識別系統,這樣二個層次在本系列圖形中是以抽象而籠統、概括的概念所作的圖形安排(設計),眾所周知,其又是具體而有著極為復雜豐富內容所指的。皮膚與黏膜組織在本系列圖形中是以純粹解剖學性質所作的設計,這里需要說明的是,在皮膚與黏膜中既有泛特異性識別存在,又有特異性識別存在。在圖形設計構思過程中,將特異性識別系統及泛特異性識別系統與共生微生物層次聯系起來,其中安排皮膚與黏膜組織這個層次,這是基于,也是符合宏生物與微生物之間實際存在的客觀事實情況。皮膚與黏膜組織在整個系統中所占分量僅次于共生微生物(體系中份額最大的層次),在功能性質上具有極其重要的生物學地位,不僅是指重要性上,特別其所占份額比例上也是比想象的大。在此必須有上述說明,因為本系列圖形本身就是一個高度抽象觀念的,其意義旨在將體內一個結構極其復雜、內涵超級豐富、不一定連續成一體且廣泛分散分布、遍布機體所有細胞及細胞外環境的功能系統,以較為明了的幾何立體結構圖形呈現系統的實質組成和內容,也很難有一個萬全的形式去表述如此龐大而復雜的體系。
從高層次看,特異性識別系統處在系統的最高位置,其次位是泛特異性識別系統。特異性識別系統是高級表現形式,也是生物進化高級發展的結果,由此很自然,其理所當然會處在體系圖中的最頂端。泛特異性識別系統所處的位置,在此不用多贅言。特異性識別系統從總體上看是依靠著并建立在泛特異性識別系統之上的。從份額比例上看,泛特異性識別系統較之于特異性識別系統要更寬廣。
綜上解析,生命信息安全控制體系整體結構設計成一個圓臺形,是合符各個層次份額比例所決定的,而且層次安排順序也是合理的,這也許就是自然生成邏輯的結果,同時也寓意著整個體系的安全穩定性。
2 泛特異性識別系統與特異性識別系統結構特征以及彼此相關關系
特異性識別系統與泛特異性識別系統是生命信息安全控制的兩個重要平臺(見圖1(b)),也是整個體系的兩個核心要素,在某種意義上可以說,舍此再沒有其他要素可言。
2.1 泛特異性識別系統
所謂泛特異性,與天然免疫、固有免疫是同等的一類概念。泛特異性識別系統包括范圍極其廣泛,其中涉及模式識別受體(Pattern recognition receptor, PRR)、抗微生物肽(Antimi-crobial peptide,AMP)、防御素(Defensin)、補體系統以及其它諸多生物分子。
2.1.1 PRR[3]
所識別的有兩大類,即病原體相關分子模式(Pathogen associated molecule patterns,PAMPs)和損傷相關分子模式(Damage associated molecule patterns,DAMPs)。前者有微生物的保守性結構信息(如細菌甘露糖、脂多糖、肽聚糖、脂磷壁酸、鞭毛蛋白、胞壁酸等各種細菌的細胞壁成分等)、微生物生理產物信息(如病毒dsRNA、病毒ssRNA、病毒和細菌的非甲基化CpG DNA及弓形蟲的穿孔素樣分子等),后者即機體受到損傷后形成的信息物質。另外,NK細胞對由變應因素誘導產生的信息分子進行受體識別。
2.1.2 AMP
AMP據知多達1 500多種,具有廣泛的抗微生物作用,有與TLR共同構成泛特異性識別系統“雙臂”之稱[4]。其中陽離子肽的分布最為廣泛,具有兩親性(Amphipathic)特點。此外,還有陰離子肽、芳香族肽、氧結合蛋白和富含某種氨基酸的肽等。在高等有機體中,AMP主要產生于上皮細胞(存在于黏膜上皮細胞分泌黏液中,構成一種重要的黏膜保護成分)、天然防御性細胞及淋巴細胞系統。AMP對病原因子的作用效應具有快速反應機制(幾分鐘之內發生響應),具有廣譜抗擊作用,其抗擊對象有G+菌、G-菌、真菌、寄生蟲、囊膜病毒及腫瘤細胞。AMP附著在微生物表面,從而使附著的微生物更易被吞噬細胞識別、吞噬。某些AMP能激活宿主細胞產生趨化因子、趨化因子受體、整合素等,因而具有引發炎性應答的作用。來自脊椎動物的AMP除抗菌功能外,還有介導趨化作用、細胞凋亡作用以及血管生成作用。AMP根據結構特征可分為:α螺旋、富含半胱氨酸、β片層、富含常規氨基酸及含少量修飾氨基酸這樣5大類[5]。其中Cathelicidin家族哺乳動物中已發現多種,但人體目前僅發現一種,即LL-37。其對G+菌和G-菌抗菌作用機理:細菌脂多糖或磷壁酸等帶有負電荷,LL-37的陽離子螺旋二級結構帶正電荷,通過電荷吸引,結合到細菌細胞膜表面,隨后LL-37穿過細胞外層膜到達內層細胞膜,并引起細胞膜的破壞,導致細菌死亡。LL-37主要在黏膜表面和皮膚表面起作用[6]。
2.1.3 防御素[7]
防御素是廣泛表達的古老的防御機制,以其陽離子多肽分子與細菌表面帶負電荷部分作用,首先是通過帶正電荷的氨基酸殘基與帶負電荷的細菌細胞膜通過靜電吸附作用結合,然后在已形成的跨膜電動勢趨動下, 以多聚體方式插入細胞膜,細菌細胞膜發生不可逆的損傷, 形成的離子孔道使內含物外泄,而其它物質進入細胞內,破壞了細菌細胞生活的平衡, 導致細胞死亡。
2.1.4 補體系統[8-9]
補體受體3(Complement receptor 3,CR3) 除了可識別內源性配體如C3bi、細胞外基質蛋白、凝聚蛋白、細胞間黏附分子-1、細胞間黏附分子-2等外,還能與許多外源性配體,如多種蛋白和非蛋白性質的微生物及其產物結合,具有廣譜配體識別能力,具有很強的信號轉導能力,通過激酶級聯反應和細胞骨架重排途徑傳導信號,從而激活白細胞的抗微生物功能,能協同激活其它重要的黏附和防御受體或直接與其它受體協同作用。備解素(Properdin)作為一種PRR識別細菌的表面以及凋亡、壞死細胞,與這些靶標結合,能夠啟動C3轉化酶、C5轉化酶的形成,導致吞噬或溶解。其機制直接結合細胞膜表面蛋白聚糖的黏多糖鏈,無需其它補體蛋白的參與即能介導吞噬攝取。補體成分C3b以及甘露糖結合凝集素(MBL)結合細菌成分以激活補體旁路途徑以及MBL途徑發揮溶菌效應。MBL由膠原樣結構域和糖類識別域組成,糖類識別域在Ca2+存在下結合甘露糖和N-乙酰葡萄糖胺。膠原樣結構域結合MBL相關的絲氨酸蛋白酶(MASP)形成復合物。MBL-MASP和微生物表面糖蛋白結合,MASPs獲得蛋白水解活性并分解C4、C2和C3,這種補體激活途徑稱為補體激活的凝集素途徑。
2.1.5 其它
主要有肽聚糖結合蛋白(Peptidoglycan-recognition protein,PGLYRPs)、CD14、清道夫受體(Scavenger receptor,SR)、淋巴細胞活化信號分子(Signaling lyphocyte activation molecule,SLAM)、巨噬細胞甘露糖受體(Macrophage mannose receptor,MMR)、MR、脂多糖識別蛋白[抗菌/通透性增加蛋白(Bactericidal /permeability-increasing protein,BPI)和脂多糖結合蛋白(Lipopolysaccharide-binding protein,LBP)]、凝集殺菌素(Lecticidin)、彈性蛋白酶抑制物、C型凝集素、鐵代謝蛋白、乳鐵蛋白、溶菌酶、纖維膠凝蛋白(Ficolin)及趨化因子等。肽聚糖結合蛋白由多個肽聚糖識別(PGR)基序構成,PGR結構域有酰胺酶活性。結合在細菌的肽聚糖層,通過水解肽聚糖或促進細菌調理化殺菌[4]。CD14作為LPS的受體。CD14不僅是LPS的受體,識別、結合LPS或LPS/LBP復合物,還可作為G+菌和G-菌等其它產物的受體,識別并結合分枝桿菌的脂肪阿拉伯甘露聚糖、 G+菌細胞壁成分——可溶性肽糖和磷壁酸等,激活單核細胞,介導一系列生物學反應[10]。巨噬細胞的SR結合G+菌細胞壁脂磷壁酸成分、G-菌細胞壁脂多糖成分及整個細菌,以此作為吞噬受體清除入侵病原因子[11]。 SLAM為巨噬細胞調控G-菌殺傷的微生物識別分子。其機制與細菌外膜蛋白OmpC和OmpF接觸后,調控NADPH氧化酶NOX2復合物的活性和吞噬小體的成熟[11]。MR是細胞表面的跨膜蛋白、鈣離子依賴的凝集素,屬于多凝集素受體,識別細菌細胞壁上的甘露糖苷成分。其識別機制與MBL類似,并且每個受體分子具有多個識別結構域,其效應于結合配體后引發吞噬作用。此外,通過參與受體介導的內吞作用和吞噬作用、來維持內環境的穩定,在維持內穩態、誘導細胞因子、抗原遞呈等過程中發揮重要作用,由此組成機體的一種防御系統。MR還可以識別細胞壁的多糖成分,如酵母甘露聚糖、細菌莢膜、LPS和脂質阿拉伯甘露聚糖,Mφ可通過MR來吞噬許多非調理素化的微生物, 包括細菌、真菌和原生動物等。Mφ的MR識別病原體后, 可導致細胞活化, 使超氧化陰離子釋放增加, 并誘導細胞因子的合成[12]。BPI由N端、C端和富含脯氨酸的21個氨基酸殘基形成的中間連接單位這三部分組成。N端功能是殺菌、結合/中和LPS,C端具有膜錨定功能,保護BPI不被胞內酶消化降解,調理吞噬及部分中和LPS。BPI為帶正電荷的陽離子蛋白,以靜電作用和吸水作用與LPS結合,導致LPS在菌體上正常排列被破壞,由此細菌體通透性顯著增強以至細菌體裂解,于是造成細菌亞致死(早期,可逆)和致死效應(晚期,不可逆)[13-14]。凝集殺菌素屬于分泌性C型凝集素,含有碳水化合物識別結構(Carbohydrate recognition domain,CRD),與溶菌酶一樣主要作用于肽聚糖,因此優先殺傷G+菌[8]。
2.2 特異性識別系統[3]
主要包括2個方面:即B細胞的BCR以及抗體,即抗原識別系統。另外,T細胞識別系統。基于抗原一詞最初的意義,在此將需要信息承載分子(如MHC、CD1及MR1等)遞呈的抗原物質冠之為抗原樣(Antigen-like),以示明確與抗原一詞最初的意義有所區別,所以T細胞識別系統為抗原樣識別系統。
2.3 相關關系
由圖2所示,整體系統信息、物質、能量的運行始于泛特異性識別系統,其中以PRR對PAMP和DAMP的識別過程;以PGLYRP、CD14、SR、SLAM、MMP、BP1、LBP及Lecticidin等為代表的元件動態過程產生諸多系列效應,其中主要有:識別、殺傷作用、趨化作用、調理作用、抗原遞呈、細胞凋亡、吞噬作用、活化細胞及血管生成等。上述層面運行獲得危險因子信息,以MHC-P、共刺激及細胞因子共同組合的形式向特異性識別系統傳遞危險因子信息,并激活特異性識別系統。 特異性識別系統主要由T細胞系統與B細胞系統兩大組件構成。泛特異性識別系統經MHC-P將信息傳遞給TCR,危險因子以抗原的形式將信息傳遞給BCR。T細胞的活化依賴于B細胞的抗原遞呈和特異性抗體的產生。作為專職抗原遞呈細胞(Antigen presentation cell,APC),B細胞遞呈的抗原是非專職抗原遞呈細胞的103~104倍。B細胞系統以MHC-P、共刺激雙信號遞呈并活化T細胞系統,而T細胞系統反饋B細胞系統,即釋放細胞因子、提供活化信號。
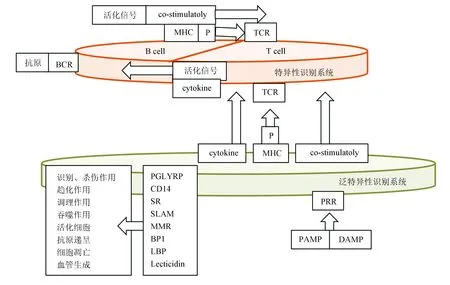
圖2 特異性識別系統與泛特異性識別系統的相關關系Fig. 2 Correlation between specific and pan-specific recognition systems
3 共生微生物層次特征、功能及其在控制體系中的地位
眾所周知,機體是一個共生微生物的載體。人類微生物基因組計劃(Human microbiome project,HMP)的研究進展表明[4],人體微生物的數目10倍于人體細胞的數目,人體微生物基因組的數目則百倍于人體基因組的數目。這其中包括細菌,真菌(酵母)及病毒等。共生微生物分布于機體的皮膚及黏膜(包括口腔,消化道,呼吸道,生殖道等部位)。在腸道中就有近千種微生物寄宿或通過,據估計成人腸道內約有1013~1014個共生菌[15]。腸道為微生物提供最佳的生存環境,機體與這些微生物通過彼此億萬年間協同進化形成互惠互利的共生復合體。
研究表明[16],無菌動物的淋巴組織的情況,由于缺乏生活的微生物所產生的刺激,致使胸腺、法氏囊、腸壁上的淋巴濾泡的發育遲緩;脾臟小,無二級濾泡;淋巴小結內缺乏生發中心。胸腺重量一般明顯低于普通動物。胸腺髓質以小淋巴細胞為主,皮質細胞結構疏松、淋巴細胞少;脾臟組織重量輕,濾泡周邊細胞發育差,生發中心幾乎不可見,紅髓巨噬細胞稀少。周圍淋巴結體積小、重量輕,腸系膜淋巴結尤為明顯,周圍淋巴濾泡界限不明顯,生發中心不發達,巨噬細胞少見,以小淋巴細胞為主。吞噬細胞活性和體內的免疫球蛋白水平相對較低。小腸免疫系統發育成熟依賴于共同進化宿主特定的微生物,T淋巴細胞、B淋巴細胞、單核巨噬細胞、M細胞的激活以及發揮作用的過程均與微生物有關。據此表明,生命信息安全控制體系的發生、發育及成熟是基于共生微生物的存在。也就是說,生命信息安全控制體系的產生是建立在共生微生物層次的基礎上的。因而清楚地表明,共生微生物層次是生命信息安全控制體系一個有著舉足輕重的大組分。可以想象,共生微生物層次的變數將主導生命信息安全控制體系的安危與穩定,這樣共生微生物層次在圖形中位于基底層是科學而合乎實際的設計安排,因為它是整個體系的基座。
4 黏膜與皮膚的特征以及功能作用
4.1 黏膜的特征以及功能作用
黏膜表面面積約有1.5個網球場大小,約為皮膚面積的200倍[17]。黏膜相關淋巴組織(Mucosa-associated lymphoid tissue,MALT)由腸相關淋巴組織、鼻咽相關淋巴組織,支氣管相關淋巴組織以及生殖泌尿道黏膜相關淋巴組織、耳中的黏膜相關淋巴組織、眼內的黏膜相關淋巴組織組成[18]。其功能以持續性防御病原體的攻擊。MALT包括黏膜誘導部位和黏膜效應部位,二者之間通過黏膜網絡相聯系[19]。
在誘導部位初次遭遇抗原后啟動初始免疫應答,這樣黏膜T細胞、B細胞在既定的誘導部位激活后誘生出效應細胞,即被激活的淋巴細胞經淋巴和血流遷移到各黏膜效應區,然后在黏膜效應部位完成向效應Th細胞、CTL細胞和漿細胞的分化。由此,可能來源于一個誘導部位,由于抗原激活淋巴細胞所產生的應答就能夠給多重廣泛的黏膜效應區提供防御效應,形成共同黏膜免疫系統(Common-mucosal immune system,CMIS),即黏膜移行系統(Mucosal migration system,MMS)。該系統中,黏膜B細胞通過共享黏膜歸巢受體的調控,經血液和淋巴系統遷移到效應部位。在歸巢受體介導下,Peyer氏結中致敏的淋巴細胞移行到致敏部位的腸黏膜上皮和固有層,或移行到腸黏膜外效應部位[20]。
腸道黏膜上皮細胞間有規律地分布有M細胞。M細胞具有轉吞作用,即從腸腔攝取分子和顆粒,以囊泡形式轉移到細胞基底面,釋放到細胞外空間。M細胞以巨吞飲、網絡蛋白介導內吞或吞噬內化病原體。M細胞下方集結有巨噬細胞、未成熟樹突狀細胞 (Immature DC,IDC)、初始T細胞和初始B細胞以及Treg細胞、Th3調節性T細胞。腸濾泡生發中心內包含激活的B細胞和濾泡樹突狀細胞(Follicular dendritic cell,FDC)。腸道受感染時,IDC捕獲病原體抗原,然后IDC進行抗原遞呈過程[5]。
腸相關淋巴組織(Gut-associated lymphatic tissue,GALT)中存在不同亞型的樹突狀細胞(DC),腸道炎癥時,于病原體侵襲場所,GALT IDC以PRR識別PAMP,而后IDC轉變為成熟DC,成熟的DC促使黏膜中的初始T細胞特異性的活化。正在成熟的DC也能從Peyer氏結穹頂區遷移至腸的引流腸系膜淋巴結。由于成熟DC的抗原遞呈活化初始T細胞和初始B細胞,而后引起全身應答反應。Peyer氏結內的漿細胞樣DC能通過分泌IFNα或IFNβ參與腸道的防御反應[18]。
由于Peyer氏結IDC的誘導,產生了對共棲菌的特異性分泌型sIgA,形成了阻止共棲菌滲入黏膜的效應。正是由于這種特異性分泌性sIgA產生機制,形成了一個常態效應,即腸腔中潛在的病原體或者共棲菌不會對機體造成危害,侵襲者被sIgA阻止不能穿越上皮組織。大部分機體活化的B細胞能夠轉換為sIgA的多聚sIgA,這種外分泌型Ig是黏液和其它分泌液(如唾液、淚液等)中的重要成分,其功效在黏膜表面發揮針對試圖侵襲或毒害上皮細胞的病原體或毒素的中和作用。另外其還有一些重要性質:sIgA分子中的糖類成分能夠與病原體表面表達的黏附分子相結合,因而成為能捕獲侵襲者的一種方式;基于sIgA不能激活補體系統,因而限制了補體系統級聯反應的損傷性炎癥效應;存在于黏液中的sIgA對蛋白酶類不敏感,因而其表現出常態的穩定性。這樣sIgA——包被機體黏膜抗體的持續產生形成的抵御作用,實現了保護黏膜、維持內環境穩態效應[8,21]。
機體維持腸道常態形成了兩套機制,即sIgA在腸腔中排斥微生物,使之難以接觸或無法侵入腸黏膜。另外,抑制對腸腔無害抗原的過度應答,腸系膜淋巴結在DC提供的抗原刺激下產生大量調節性T細胞,降低對食物抗原和共生菌的應答[8]。
位于機體最前線的黏膜系統,賦有特殊的機制,一方面保障機體的安全防御,另一方面于通常情況下以維持黏膜的正常穩定狀態。腸道黏膜應答系統在對“無害”抗原的包容機制和對“有害”抗原的激活應答中必需處于微妙的平衡,才能維持機體健康。因此準確識別有害、無害抗原以及對有害抗原產生迅速有效的應答反應對機體來說至關重要。
由腸道杯狀細胞分泌的黏液形成物理屏障,所分泌的黏蛋白是腸道固有應答第一防線黏液層的主要組成部分。黏蛋白類對維持腸黏膜動態平衡、調控微生物-宿主應答反應起著重要作用。杯狀細胞數從十二指腸尾端的4%增至末端結腸的16%,這與微生物有機體的數目從近端腸段到結腸逐漸增加的情勢呈正相關。腸道黏液屏障是一個復雜的結構,由腸道杯狀細胞所分泌的黏蛋白與水、無機鹽、抗菌肽等共同組成黏稠的凝膠型網狀結構黏液層,是胃腸道抵抗內外源性刺激及致病菌侵入的第一防線。腸道黏液層有兩層,即外層為疏松黏液層,是共生菌定居的部位;內層為緊密附著黏液層,以“過濾器”的形式阻止微生物滲入。黏蛋白是覆蓋于腸道表面黏液層的主要組成部分,通過隔離腸道微生物與宿主上皮細胞、淋巴細胞的接觸,可有效防止腸道過度炎性反應,對維持黏膜穩態起著重要作用[22]。
柱狀上皮細胞的頂端表面有緊密連接(Tight junction)和黏著連接,這些連接將細胞間隙與腸腔分隔。細胞之間的黏附結構由蛋白復合物組成,其中有封閉蛋白、閉鎖小帶-1和閉鎖小帶-2(Zonula occludens,ZO-1/2)及Claudin封閉蛋白家族。促炎性細胞因子,如IFN-γ下調連接蛋白組分ZO-1的表達。這種上皮細胞中封閉蛋白表達的下調(在腸道炎癥中),增加細胞間的通透性,以利中性粒細胞的滲出[17]。
各種TLR配體中以LPS為代表,這LPS不僅為病原菌體成分,而且也是腸道中大量存在常在共生微生物的菌體成分,所以必須有一個與之相適應的特殊的機制系統,以面對大量存在的常在微生物,需要實現維持黏膜系統通常性正常穩定的狀態。為此上皮細胞方面所呈現的是,顯著降低以LPS等為配體的TLR的表達,從而形成一種包容機制狀態。另一方面,上皮細胞還表達負調控TLR信號分子,如Tollip(Toll-interacting protein),以此抑制腸道應答的過度活化[23]。不僅在上皮細胞,而且腸管存在的DC幾乎不表達TLR4(LPS受體),而代之高表達識別鞭毛的TLR5。這樣可以避免由常在菌所產生的LPS引起的DC的過度活化,同時增強識別具有鞭毛的病原菌的防御機制,以調控維護常規性穩定與機體防御兩者間的平衡。
4.2 皮膚的特征以及功能作用[24]
皮膚是機體與外環境接觸的界面,也是眾多微生物的棲息地。皮膚由表皮層、真皮層及皮下脂肪組織構成。表皮包括基底層、棘層、顆粒層以及最外層的角質層,其中角質層是皮膚至關重要的生理屏障。表皮內還分布有黑素細胞和朗格漢斯細胞(Langerhans cell,LC)。少量的T細胞(主要是CD8+T細胞)存在于基底層和棘層中。真皮由膠原纖維、彈力纖維、網狀纖維、血管、淋巴管和神經組成。真皮內分布有多種淋巴細胞,其中有真皮DC和漿細胞樣DC及CD4+Th1細胞、CD4+Th2細胞、CD4+Th17細胞、γδT細胞和NKT細胞。此外,真皮內還存在巨噬細胞、肥大細胞和纖維母細胞。
角質形成細胞作為皮膚防御系統的第一道屏障能通過產生抗菌肽、細胞因子和趨化因子等機制迅速對有害刺激發生反應并預警皮膚內其它淋巴細胞。角質形成細胞組成性表達TLR,通過TLR和炎癥復合體等預警系統感知危險因素。皮膚DC分為表皮內LC和真皮內DC,均為專職APCs。
5 外環境開放接觸面效應影響
如討論中所述,如果說人體被視為由人類自身細胞與微生物細胞構成的超有機體,其間所呈現的景觀是微生態學性質,那么體系的外延部分,即外環境開放接觸面就是宏觀層面上的生態學性質,這里不僅僅有生物學因素的影響,更有理化因素所產生的效應。由于篇幅所限,在此就不作詳述。
6 討論
1975年,意大利學者Giuseppe Longo在《信息論:新動向和未解決的問題》中論述:在整個人類歷史中,至少在西方的哲學中,一直有這樣一種思想,認為圖形、結構和關系比物質和能量更為本質[25]。學者張長琳在論述《易經》時說[25]:“東方的《易經》是一本科學書,是一本天文和數學書。在這一數學系統中,元素并不重要,重要的是元素的組合關系、關系的變換以及這些關系的諧和。”他進一步認為[25],這本數學書討論的就是整體論的數學變換關系。
今天的科學在許多方面與上述一期史前文明精神相反,所謂實證科學忽視總體、整體,重視細枝末節,認為把握整體的關鍵是分化。實際上,由于分得太細,而無法還原到整體,以至于實證科學發展的結果,已經無法把握整體,其局限性一目了然。
本次正是基于《整體論》的思想,以建構圖形表述和揭示生命信息安全控制的實質內涵,旨在探討出更為簡略而直觀、明了的結構圖形,從而首先是把握體系及系統的整體性觀念,然后以此展延開相關事件的分析思維。
本次構建的圖形中,生命信息安全控制軸,其屬性為不可見,其存在是形而上的。這其中的關系是“致虛極,守靜篤”的關系。這里的“致虛極”是指整體結構性的生命信息安全控制(即觀妙),而“守靜篤”是指各個層次之間彼此保持有序性而不紊亂,營造出動態平衡的景象(即觀徼)。
老子在《道德經》中說:“常無欲以觀其妙,常有欲以觀其徼”。人們在幾何作圖時“致虛極”,是對圖形空間的基點和覆蓋問題,以非直接觀察思維“觀妙”,“守靜篤”則是人的思想狀態與圖形整體運行狀態保持一目了然的覆蓋關系,以直接觀察思維“觀徼”,這樣人的認識會形成更深層的理論關系,即主觀思維邏輯與客觀自然邏輯保持同步和一致[26]。本次對生命信息安全控制體系從其整體性構思建構的空間結構圖形,其中的“生命信息安全控制軸”的勾畫正是“觀妙”后非直接觀察思維的理解,是對無形信息主觀特定設置的承載關系并以符號加以表達。而4個層次構成的內在部分與外延部分的設計正是“守靜篤”直接觀察思維“觀徼”的結果,是對有形信息實物承載所加以的體現。
機體的應答始于生命信息的受理與識別,基于識別方式時間的及時性與精度的專一性,大抵分為特異性識別系統和泛特異性識別系統。該二個系統的相關關系,本次由圖2僅舉一例,簡略地作了勾畫與標識,以展示各生物分子所在的位置以及功效反應、趨向,以反映彼此空間界面中物質、能量、信息交流溝通傳遞情況,其效果在于更為明了而直接觀察理解其中的實質內容與過程、變量。是否可以圖2為范例,成為一個分析模型用,根據具體生物學效應變化過程,在這個模型中勾畫與標識內容、使用用件,以此有助于更清晰直接的分析與理解。
21世紀初人類基因組的研究表明,與人類共生的微生物參與了人類細胞社會的構成及其進化歷程,就此意義,應該將人體視為由人類自身細胞與微生物細胞構成的超有機體(Superorganism)[4]。由此有理由推論,皮膚與黏膜的形成是與共生的微生物共進化形成的一個合理的結局。在組織學層面上,共生微生物直接與機體的皮膚、黏膜聯系著。包括有共生微生物層次在內的生命信息安全控制體系是生物億萬年共進化的自然生成邏輯的結果。《易經》經典之語:一陰一陽之謂道。據此可以換一個角度理解,如果沒有共生微生物這個層次的存在,整個安全控制體系似乎將顯得毫無意義,事實上共生微生物這個層次,其與機體彼此形成完全不可分割的關系,只要討論生命信息安全控制體系,就一定撇不開共生微生物這個層次。

