苦參素預處理對腎缺血再灌注損傷的保護作用及對核轉錄因子-κB表達影響
郝朝輝 張 楠
鄭州人民醫院泌尿外科,河南省鄭州市 450000
腎缺血再灌注(ischemia/reperfusion,I/R)損傷是臨床上腎移植術等過程中不可避免的病理生理現象,嚴重時可引起腎功能衰竭[1]。I/R的發生機制較為復雜,與氧自由基損傷、炎癥反應等因素有關。大量證據顯示,I/R損傷時,腎組織的炎癥反應加劇,多種炎性細胞因子被釋放,同時產生大量活性氧自由基,造成氧化應激損傷[2-3]。此外,有研究表明炎癥、缺氧等刺激會激活核轉錄因子-κB(Nuclear factor-κB, NF-κB),促進炎性細胞因子釋放,加劇炎癥反應,導致缺血再灌注損傷[4]。因此,有效地抑制機體炎癥和氧化應激反應是改善腎缺血再灌注損傷的重要途徑。苦參素(Oxymatrine,OMT)是一種具有抗凋亡、抗炎及抗氧化等藥理作用的生物堿,可減輕腎缺血再灌注損傷,但具體分子機制尚不明確[5]。因此本研究擬通過觀察OMT對大鼠腎缺血再灌注保護作用及NF-κB信號途徑的影響,探討其可能的作用機制。
1 材料與方法
1.1 實驗動物及試劑 SPF級SD大鼠40只,雄性,體重200~220g,由鄭州大學實驗動物中心提供。所有動物實驗均由鄭州人民醫院醫學倫理委員會批準通過。苦參素(200mg/2ml,批準文號:H20044669,生產:云南白藥集團股份有限公司);血清Cr、BUN、IL-1β、IL-6、TNF-α、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-Px)及BCA法總蛋白定量試劑盒均購自北京索萊寶科技有限公司;兔抗大鼠NF-κB p65一抗和β-actin抗體及羊抗兔或羊抗鼠IgG均購自英國Abcam公司。
1.2 實驗方法 將大鼠隨機分為4組:假手術組(S組)、缺血再灌注組(I/R組)、OMT高劑量組(H組)、OMT低劑量組(L組),每組10只。L組和H組于I/R造模前1h分別給予苦參素75mg/kg、150mg/kg腹腔注射,S組和I/R組同時給予同體積0.9%氯化鈉注射液。I/R模型制備[6]:將I/R組和OMT預處理組大鼠進行腹腔注射10%水合氯醛麻醉,俯臥位固定,碘伏消毒,取腹正中切口進入腹腔,游離雙側腎臟并切除右腎,用無損傷動脈夾夾閉左側腎動、靜脈,腎臟從紅色轉成暗紅色視為缺血成功;阻斷45min后取下動脈夾進行再灌注,再灌注時腎臟從暗色轉變成鮮紅色視為再灌注成功。再灌注完成后消毒、縫合,待大鼠完全蘇醒后放回飼養籠中飼養。S組除不進行腎動、靜脈夾閉外,其他操作與I/R組一致。于再灌注24h后收集大鼠下腔靜脈血,然后頸椎脫臼處死大鼠獲取腎臟組織,一部分迅速置于-80℃中保存,另一部分用多聚甲醛固定。
1.3 腎損傷指標的測定 將大鼠血液標本離心,獲取血清,采用全自動生化分析儀測定Cr和BUN的濃度。
1.4 腎臟組織病理學檢查 取多聚甲醛固定的腎臟組織,脫水、透明、浸蠟、包埋、切片、脫蠟, HE染色,在400×光鏡下觀察其病理改變。
1.5 炎性細胞因子的檢測 ELISA試劑盒檢測各組大鼠血清IL-1β、IL-6和TNF-α的水平,嚴格按照試劑盒操作進行。
1.6 氧化應激指標的檢測 取出部分腎組織制成勻漿,而后采用黃嘌呤氧化酶法測定SOD的活性,采用硫代巴比妥酸法測定MDA的含量,同時采用二硫代二硝基甲苯胺法測定GSH-Px活力,嚴格按照試劑盒操作進行。
1.7 Western blot檢測NF-κB表達 使用核蛋白提取試劑盒提取剩余部分腎組織蛋白,采用BCA法測定蛋白濃度。分別取20μg蛋白樣品進行SDS-PAGE電泳,轉膜(PVDF膜)后,采用5%BCA室溫封閉2h,分別加入NF-κB p65一抗和β-actin 抗體(1∶1 000)4℃孵育過夜,然后室溫孵育羊抗兔或羊抗鼠二抗(1∶2 000)1h。化學發光顯影后采用Image J計算目的條帶與內參條帶灰度值的比值,即目的蛋白的相對表達量。
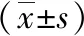
2 結果
2.1 腎臟組織病理形態學變化 各組大鼠腎臟組織病理學觀察結果如圖1, I/R組大鼠腎小管上皮細胞明顯變性壞死,大量炎性細胞浸潤,可見管型;OMT預處理組大鼠僅部分近曲小管細胞輕度水腫、變性、壞死,偶見管型,且H組效果更明顯。

注:A:S組,B:I/R組,C:L組,D:H組。
2.2 腎損傷指標和炎性因子水平比較 各組大鼠腎損傷指標和炎性因子水平比較見表1,I/R組血清Cr、BUN、IL-1β、IL-6及TNF-α水平明顯高于S組 (P<0.05); OMT預處理組血清Cr、BUN、IL-1β、IL-6及TNF-α水平顯低于I/R組(P<0.05),且H組效果更明顯,提示OMT預處理能抑制炎癥反應。
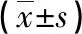
表1 各組血清Cr、BUN、IL-1β、IL-6及TNF-α水平的比較
注:a與S組比較,P<0.05;b與I/R組比較,P<0.05。
2.3 OMT影響I/R大鼠腎臟組織氧化應激指標水平 如表2所示,與S組比較,I/R組大鼠腎臟組織中MDA含量明顯增加,抗氧化酶SOD和GSH-Px的活力明顯下降(P<0.05);與I/R組比較,OMT預處理組大鼠腎臟組織中MDA含量明顯降低,SOD和GSH-Px的活力明顯升高(P<0.05),且H組更明顯,提示OMT預處理能夠提高I/R大鼠腎臟組織的抗氧化能力。
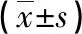
表2 各組腎臟組織MDA、SOD及GSH-Px水平比較
注:a與S組比較,P<0.05;b與I/R組比較,P<0.05。
2.4 苦參素影響I/R大鼠腎臟組織NF-κB p65蛋白表達水平 由圖2可以看出,I/R組腎臟組織NF-κB p65蛋白表達水平明顯高于S組(P<0.05);OMT預處理組腎臟組織NF-κB p65蛋白表達水平明顯低于I/R組(P<0.05),且H組更明顯。

注:* 與S組比較,P<0.05; #與I/R組比較,P<0.05。
3 討論
腎臟是維持機體內環境穩定的最重要的器官之一,腎I/R損傷在臨床工作中較常見[7]。研究表明氧自由基損傷及炎性反應是導致I/R損傷的重要原因之一,但其具體機制尚不明確[8]。I/R發生時,IL-1β、IL-6及TNF-α等炎性細胞因子被釋放,使腎組織的炎癥反應加劇,進而加重I/R的發生[9],同時腎組織會產生大量活性氧自由基,與生物膜上不飽和脂肪酸發生脂質過氧化反應產生大量脂質過氧化物,且抑制SOD、GSH-Px等抗氧化酶的活性,使氧自由基大量累積,最終引起腎細胞損傷、凋亡和壞死[10]。本研究結果發現,與S組相比,I/R組大鼠腎組織損傷嚴重,血清TNF-α、IL-6、IL-1β的水平以及腎組織MDA水平明顯升高,抗氧化酶SOD和GSH-Px的活力明顯降低,說明腎I/R損傷加劇了大鼠體內的炎癥反應,減弱了抗氧化能力,引起腎組織的損傷和壞死。
OMT可通過抗炎、抗凋亡、抗氧化清除自由基等途徑,保護肺、心臟及腦等的I/R損傷[11]。Zhu等[12]研究發現OMT可上調IL-10水平,下調TNF-α、IL-8水平,抑制肺泡細胞凋亡和炎癥反應,緩解肺I/R損傷;Jiang等[13]研究發現OMT預處理可減輕組織學損傷和氧化應激,抑制腎小管細胞凋亡,上調Nrf2/HO-1蛋白的表達,減輕腎I/R損傷;Ozturk等[14]研究發現OMT可能是一種有效的抗氧化藥物,可通過抑制脂質過氧化和增加內源性抗氧化活性保護腎臟免受損傷。本研究結果發現OMT預處理后,大鼠的腎細胞壞死、炎性細胞浸潤比例明顯降低,血清Cr、BUN、IL-1β、IL-6及TNF-α的水平明顯降低,腎組織中MDA含量明顯下降,SOD和GSH-Px的活力明顯升高,且H組效果更明顯,提示OMT能夠降低I/R大鼠的炎癥反應和氧化應激反應,提高機體的抗氧化能力,減少腎I/R損傷,保護腎組織。
NF-κB是一種重要的核轉錄因子,廣泛存在真核生物細胞中,可誘導多種細胞因子、趨化因子、黏附分子表達,在炎癥反應、細胞凋亡及I/R損傷等病理生理改變過程中起著重要的調控作用[15]。已有研究表明炎癥、缺氧等刺激會激活NF-κB,促進IL-1β、IL-6、TNF-α等炎性細胞因子的釋放,誘發炎癥反應,導致I/R損傷[16]。本研究結果顯示,I/R組腎臟組織NF-κB p65蛋白表達水平明顯高于S組,說明活化的NF-κB參與腎I/R損傷的發生。同時本研究還發現OMT預處理組腎臟組織NF-κB p65蛋白表達水平明顯低于I/R組,提示OMT預處理可通過某種機制抑制NF-κB 的活化,下調多種分子表達,減少炎性介質的釋放,從而減輕腎臟缺血再灌注損傷,進而保護腎臟功能。
綜上所述,OMT預處理對腎臟有保護作用,其機制與增強腎臟抗氧化能力,減輕炎癥反應,抑制NF-κB p65表達有關。

