自噬在骨穩態與骨質疏松癥中的作用及機制研究進展
張欣然 林開利,2
骨質疏松癥(osteoporosis,OP)是以骨量減少、骨脆性及骨折傾向增加為特征的漸進性、系統性骨代謝疾病,隨著人口老齡化的加劇,其發病率逐年增高。OP的一個重要臨床特征為病人早期的癥狀和體征缺乏或不明顯,這通常會導致骨質疏松性骨折(osteoporotic fracture,OF)、骨折后病人活動受限及其他復雜并發癥,嚴重影響病患的日常起居、自理能力,使個人與家庭蒙受生理和心理的雙重重擔。基礎研究表明,骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)、成骨細胞(osteoblasts,OB)及破骨細胞(osteoclasts,OC)等共同參與了OP的發生發展。自噬是真核細胞的高度保守行為,其與細胞穩態和應激、損傷修復和增殖、分化等密切相關。近年來研究表明自噬在骨代謝以及BMSCs、OB、OC等的增殖、分化、代謝與生理功能行使中有重要的調控作用,但其具體機制尚未明確。因此,我們擬通過文獻綜述,并從自噬在間充質干細胞(mesenchymal stem cells,MSCs)中的作用,自噬在成骨細胞和骨細胞中的作用,自噬在破骨細胞中的作用等幾個方面去探索自噬與骨代謝的關系及其在OP發病機制中的作用。
一、文獻檢索策略
本文通過中文檢索詞“自噬”、“骨質疏松”、“間充質干細胞”、“成骨細胞”、“破骨細胞”以及英文檢索詞“autophagy”、“osteoporosis”、“mesenchymal stem cells”、“osteoblast”、“osteo?clast”在中國知網、萬方數據庫、維普數據庫、PubMed、Web of Science等平臺進行檢索,篩選發表時間為近十年內,共檢索到文獻723篇。應用EndNote刪除重復及無法獲得全文文獻115篇,最終納入文獻36篇,其中中文文獻為3篇,英文文獻為33篇(圖1)。文獻納入標準為:①已正式發表的期刊文獻;②文獻內容與自噬、骨質疏松、骨穩態維持的相關細胞密切相關;③同類研究中質量、證據等級較高的文獻;④語言為中文及英文的文獻。文獻排除標準為:①文獻質量、證據等級較低的文獻;②學位論文、會議類文獻;③非中文及英文的文獻;④無法獲得全文的文獻。
二、細胞自噬概述
自噬由Ashford等[1]于1962年通過電鏡首次發現。當細胞面臨外界環境壓力(如營養物質缺乏、缺氧等)或者在病理狀態下,細胞通過特殊包膜結構(例如單層膜或者雙層膜)包裹長壽蛋白、有害物質或受損的細胞器等形成自噬體,隨后通過溶酶體依賴途徑進行分解代謝,而降解的產物用以實現胞內成分的循環再利用[2]。目前,根據相關物質從胞質運輸到溶酶體過程中功能和途徑的不同,將自噬分為了以下幾類:巨自噬,小自噬和分子伴侶介導自噬。其中,巨自噬是自噬的主要類型,也是目前研究最多的一種類型,本文以下的自噬指巨自噬[3]。
通過基因篩選的相關研究,學者們發現了30多種自噬相關基因(autophagy?related gene,ATG),在自噬體的形成、調控過程中發揮重要作用[4]。這些基因編碼的自噬相關蛋白在自噬早期募集到起始位點從而組成自噬的重要結構——雙層隔離膜,隨后內質網、線粒體、高爾基復合體等細胞器被隔離膜包裹,在這一過程中,Ⅲ類磷酸肌苷3激酶(classⅢphosphoinositide 3?kinase,classⅢ PI3K)/空泡分揀蛋白(vacu?olar protein sorting,Vps34)復合體被激活,然后與Beclin?1、ATG14、Vps15等蛋白一起形成多蛋白復合體,使雙層膜結構不斷延伸,并進一步招募ATG蛋白[5]。
ATG5、ATG7、ATG10和ATG12在擴展、延伸雙層膜結構以形成完整的自噬體的過程中起重要作用。首先,ATG5和ATG12在ATG7和ATG10的介導下形成ATG5?ATG12復合體,隨后結合ATG16L1,生成 ATG5?ATG12?ATG16L1 復合體[6]。微管相關蛋白輕鏈?3(microtubule?associated protein 1 light chain 3,LC3)前體首先由半胱氨酸蛋白酶ATG4切割,形成LC3?Ⅰ,然后通過ATG7、ATG10和ATG5?ATG12?ATG16L1復合體介導,LC3?Ⅰ與磷脂酰乙醇胺(Phosphatidylethanol?amine,PE)結合,生成LC3?Ⅱ[7]。LC3?Ⅱ是檢測自噬形成的可靠蛋白質標記物,包括了合成過程中的3種重要的形式:未處理形式(the unprocessed form,pro?LC3)、蛋白水解形式(the proteolytically,LC3?Ⅰ)和PE-共軛形式(the PE?conjugat?ed form,LC3?Ⅱ)。最后,在自噬溶酶體形成后,自噬體膜以及包封在自噬體中的物質等被溶酶體內的蛋白酶降解,并釋放至胞漿中以重新利用[8](圖2)。
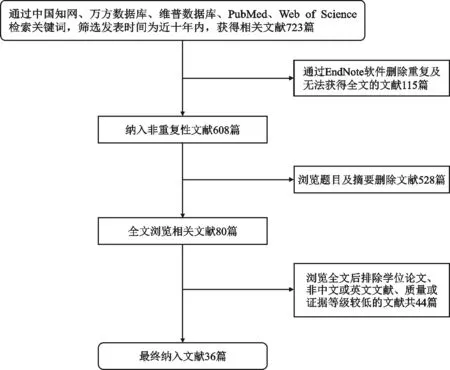
圖1 文獻篩選流程圖
雙層膜介導的胞內溶酶體降解這一過程并不復雜,自噬作為細胞內的“管家”,在維持細胞內環境穩定性和確保細胞正常生理功能方面扮演著不可或缺的角色[9]。然而,在某些病理因素或者疾病發生過程中,自噬的功能可能會發生改變或者被異常激活,甚至發生自噬過度的情況而引起細胞凋亡或者死亡。生理情況下,細胞自噬可以將受損或者衰老的細胞器清除、更新來維持細胞穩態。當細胞處于營養物質缺乏,或者應激狀態(如藥物作用、氧化應激、內質網應激等)下,細胞內自噬水平會升高,各種刺激引起的細胞器損傷及時被消除,細胞的正常新陳代謝和多種生理功能得以維持[10]。然而,自噬的這種代償作用有一定限度,如果外界的刺激或者應激狀態不能及時改善或者去除,一旦自噬的消耗超過了細胞的耐受閾值,可能導致一種不同于凋亡的程序性細胞死亡(Ⅱ型程序性細胞死亡),乃至誘發一些疾病[11]。
三、自噬在骨穩態中的調節作用

圖2 自噬的發生過程(繪圖作者:張欣然)
骨骼能夠為軀體提供支撐和保護作用,但是骨功能作用的發揮需要骨形態、骨量以及骨質等的長期穩定。骨骼處于骨形成以及骨吸收的動態平衡(即骨穩態)中,維持骨骼穩態需要多種類型細胞(OB、OC、骨細胞等)、激素、因子等密切配合。其中,OB是主要發揮合成骨基質作用的細胞,其由MSCs分化而來;OC是具有骨吸收作用的高度分化的多核巨細胞,源自造血干細胞;骨細胞是構成骨質的重要細胞,骨細胞能夠通過感知應力和激素水平等的變化來調節OB及OC,其包封在礦化的骨基質中、由OB終末期分化而來(圖3)。越來越多的研究表明:自噬與骨穩態具有相關性,參與調控MSCs、成骨、破骨以及骨細胞[5]。
(一)自噬在MSCs中的作用
MSCs具有自我更新和多潛能分化能力,可以增殖、分化成多種類型細胞,例如OB、成軟骨細胞和成脂肪細胞,BMSCs是一種存在于骨髓中的MSCs。骨組織發育、骨代謝、骨改建、骨修復和再生過程中所需要的成骨前體細胞,主要來源于 BMSCs[12]。2014年,Song等[13]研究表明H2O2介導的BMSCs的氧化應激能夠造成細胞的大量死亡,此時細胞內自噬水平的提高可以促進BMSCs的成活。Nuschke等[14]觀察到在未分化的BMSCs中有大量未降解的自噬空泡聚集或自噬體聚集;同時在BMSCs早期成骨分化過程中,BMSCs的胞體內也有大量自噬體聚集,這說明自噬體可以作為能量快速產生的來源。自噬還參與維持來源于臍帶血的MSCs干性[15]。Pantovix等[16]研究表明單磷酸腺苷激活蛋白激酶(Ad?enosine 5′?monophosphate?activated protein kinase,AMPK)通路通過早期抑制哺乳動物類雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和晚期激活蛋白激酶B(protein ki?nase B,AKT)/mTOR調節自噬,從而調控MSCs成骨分化。Liu等[17]通過應用自噬抑制劑[如3-甲基腺嘌呤(3?methylade?nine,3?MA)等]進一步研究了自噬在BMSCs中的作用:通過在BMSCs的培養過程中加入自噬抑制劑3-MA及氯喹,可見抑制劑組堿性磷酸酶(alkaline phosphatase,ALP)陽性細胞數量及大小均下降;在加入抑制劑21 d后,茜素紅染色結果顯示細胞礦化能力也下降。這些結果說明自噬抑制劑會影響BM?SCs的成骨分化及礦化能力。關于人牙髓間充質干細胞(hu?man dental pulp mesenchymal stem cells,hDP?MSC)的研究結果也印證了這個結論:自噬抑制劑巴弗洛霉素A1(bafilomy?cin A1,BA1)、氯喹以及氯化銨可以抑制hDP?MSC的分化[16]。
(二)自噬在OB和骨細胞中的作用
OB由MSCs分化而來,是特殊化的MSC細胞,負責骨形成。在骨形成過程中,一些OB陷于骨基質中分化為骨細胞,而基礎研究證實自噬可以促進OB的增殖、分化。Ozeki等[18]的研究表明ATG7和wingless/int1(Wnt)通路參與了骨形態生成蛋白-2(bone morphogenetic Protein?2,BMP?2)誘導的OB早期生成過程,BMP?2促進了ATG7的表達,但對LC3、Be?clin1和ATG5等無作用。通過小干擾RNA沉默ATG7和Wnt16后,顯著抑制了BMP?2介導的人骨骼肌干細胞(hu?man skeletal muscle stem cell,hSMSC)向成骨細胞分化;而自噬激動劑雷帕霉素(rapamycin)提高了hSMSC的成骨分化,這說明自噬參與促進早期成骨細胞分化。這與Nollet等[19]關于OB在骨穩態和骨骼礦化過程中的研究結果一致:大鼠成骨細胞系的礦化能力隨自噬相關基因ATG7和Beclin?1被siRNA技術沉默而顯著下降。此外,Jung等[20]和Zhu等[21]的研究還表明增強自噬可以減輕細胞氧化損傷并抑制細胞凋亡:實驗結果顯示NO和H2O2等會引起OB的凋亡及功能異常,而通過AMPK通路活化自噬可以減輕相應的損傷。進一步,王雅雯等[22]通過CoCl2制備人hFOB1.19成骨細胞系的缺氧模型,結果顯示缺氧環境可激活細胞自噬,并且OB的自噬水平與缺氧作用時間呈正相關,成骨細胞自噬活性的不斷增強,對細胞起到一定的保護作用。
與此同時,也有部分研究表明自噬對OB起到負調控作用。Chen等[23]的研究中,在顱骨來源的OB中敲除Raptor(mTORC1的一個重要組成部分)以降低OB相應的mTORC1功能,提高細胞自噬水平,導致OB的基質合成與礦化能力均下降;相應的體內實驗中,與對照組相比,Raptor敲除小鼠骨質減少。Yeong等[24]研究表明,在微重力引發的骨量喪失或者骨質疏松中,應用褪黑素可以降低MC3T3?E1中的自噬水平、抑制細胞的內質網應激和氧化損傷,從而提高細胞的存活率,其機制與磷酸化ERK/Akt/mTOR通路相關。
(三)自噬在OC中的作用
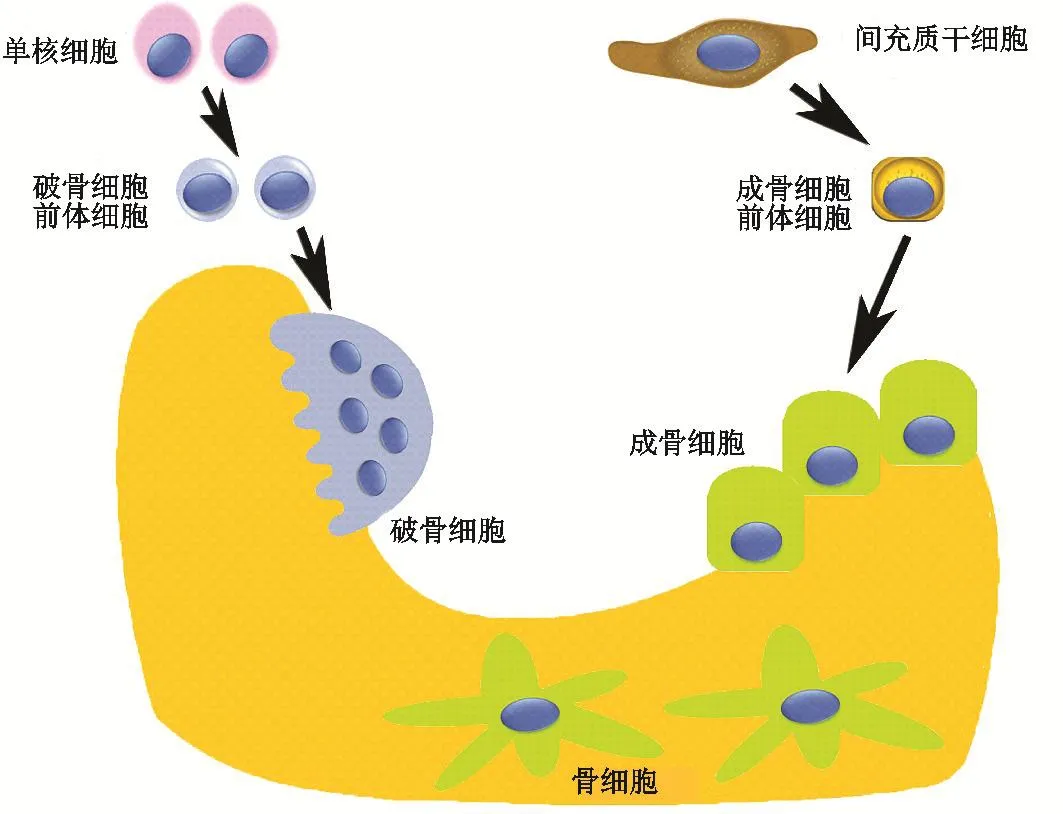
圖3 各種細胞在骨穩態維持中的作用(繪圖作者:張欣然)
OC是一種來源于骨髓的高度分化的多核巨細胞,OC不僅參與骨質的吸收,還是一種重要的免疫細胞。OC與OB的成骨作用相互協調配合,相輔相成,同時也參與免疫應答過程[25]。研究表明OC的形態可能與自噬密切相關,例如ATG5、ATG7、ATG4B、LC3等自噬相關基因的缺陷會引起OC形態變化、功能障礙[26]。Lin等[27]也發現在卵巢切除術或應用糖皮質激素的小鼠中,采取自噬抑制劑氯喹或抑制單核細胞ATG7可以抑制破骨相關基因的表達和OC的分化,從而緩解模型所誘發的骨質流失,印證了細胞自噬可能具有促進OC分化的作用。然而也有一部分研究得出相反的結論,指出細胞自噬可能抑制OC分化,例如在體外實驗中使用自噬激活劑Rapamycin可以減少OC的形成,從而減少骨質流失[28]。
四、自噬與骨質疏松
在正常生理情況下,破骨-成骨的動態平衡使骨代謝保持正常狀態,當這種平衡被打破時,就可能導致骨穩態的異常,最終發生OP。對于老年或絕經后婦女OP病人,往往并發OF等多種并發癥[29]。有研究發現,與正常個體相比,體外培養OP來源的BMSCs,可見OP來源的BMSCs向成骨細胞分化的數目減少,更傾向于向脂肪細胞分化[30]。對OP病人外周血檢測結果顯示,與正常人相比,OP病人ALP、mTOR以及Runx相關轉錄因子2(runt?related transcription factor 2,Runx?2)的表達量均降低,相關性分析結果顯示Runx?2與mTOR的表達呈正相關,并且骨密度與Runx?2的表達也存在正相關,提示OP病人骨密度的下降可能與自噬相關基因mTOR存在著一定關聯性[31]。
關于細胞自噬和OP的相關性研究,目前已經在細胞和動物實驗中廣泛開展。研究發現老年大鼠的骨細胞自噬關鍵因子LC3?Ⅱ和Beclin?1表達降低、細胞自噬水平降低,而sequestosome?1(p62/SQSTM1)和骨細胞凋亡水平升高[32]。由于OP表現出一定的年齡相關性,因此我們推測不僅自噬與OP可能存在相互調控的關系,年齡因素、自噬與OP三者的相互關系同樣不容忽視。除了年齡相關性骨質疏松癥,自噬在遺傳性骨質疏松癥中同樣有著重要的作用。常染色體隱形遺傳性骨質疏松癥(autosomal recessive osteopetrosis,ARO)是一種惡性的先天性骨質疏松癥,研究表明在ARO模型小鼠中,調控細胞自噬早期階段的V?ATP酶的編碼基因發生突變,導致p62表達降低、LC3?Ⅱ水平升高,使自噬水平異常,從而影響了OC的發育成熟[33]。此外,OP也與雌激素水平密切相關,研究發現在小鼠卵巢切除模型中,雌激素水平的降低提高了自噬活性,小鼠脛骨近端骨礦物質密度下降;然而雌激素的應用能夠促進自噬水平恢復正常,并抑制了骨的流失[34]。但是通過建立雙側卵巢切除大鼠骨質疏松模型,Flor?enci等[35]提出了相反的觀點:雌激素缺乏可以導致自噬水平降低、細胞凋亡增多,而雌激素替代治療可以逆轉這一趨勢。綜上,近年來相關研究表明雌激素可以抑制骨細胞凋亡,自噬可能參與了這個過程,但是具體的正負調控作用仍不明確。此外,骨質疏松大鼠接受藥物干預后,大鼠成骨標志物BMP?2、Runx?2和自噬標志物 Beclin?1、ATG5和LC3的表達均顯著增加,微計算機斷層掃描(micro computed tomog?raphy,micro?CT)檢測發現大鼠脊椎骨的骨密度、骨量、骨小梁的數量及厚度均顯著增加,這表明骨質疏松的改善與自噬水平的增加有關[36](圖3)。
迄今,關于自噬與OP的關系的研究多聚焦于動物模型與離體實驗,臨床研究所提供的信息較少。Zhang等[37]的一項基于984位白人研究對象的人類基因研究表明,自噬通路調控基因是唯一與橈骨遠端骨密度變化直接相關的基因,這為自噬在OP發生發展中的作用提供了直接的人體試驗證據。
五、展望
細胞自噬在骨穩態的維持中起著重要的作用,骨穩態平衡的打破會導致OP的發生,然而自噬與骨穩態的調控及OP的發生、發展究竟為正相關還是負相關,是自噬在骨代謝領域中的研究焦點之一。一些研究提示提高細胞自噬水平可以促進破骨作用和骨吸收,自噬與OP呈正相關,因而采取抑制細胞自噬可能成為治療或預防OP的新方法。然而,亦有一部分研究得出了相反的結論,指出自噬與OP呈負相關,對OP的發生發展有抑制作用,因此自噬水平的降低可能導致OP的發生。我們推測,過度或低下的自噬水平均可能不利于骨代謝和骨穩態,調控自噬水平使之保持在適度范圍內可能成為治療OP的新靶點,而這需要在進一步研究中加以闡釋。此外,對于OP的全身性治療中,近年來基礎研究表明一些中藥及其主要成分在治療OP中具有一定的作用和價值,而自噬在中藥干預OP中的作用和機制尚不明確,因此明確自噬與中藥的關系能夠為OP的治療提供新靶點,為發揮中醫藥的特色診療提供新方法;由于OP發病率高,影響人群較大,對于OP病人局部骨缺損的修復也值得進一步研究,自噬是細胞成骨分化不可缺少的一個過程,骨缺損修復材料的改性是否會誘發成骨相關細胞自噬的改變從而來影響OP病人局部骨缺損修復的效果,也值得進行深入研究從而為指導骨修復材料的改性提供理論支持。
綜上所述,通過深入研究細胞自噬在OP中的作用及機制,并通過調控自噬促進骨代謝的穩態平衡,可以為全身性延緩或控制OP的發生與發展以及局部促進OP病人骨缺損的修復提供新的思路。