術前18F-FDG PET/CT縱隔淋巴結SUVmax在ⅢA(N2)期非小細胞肺癌手術患者預后評估中的價值
韓飛,戴天陽,曾培元,蒲江濤,何開明,宋琦,胡智,吳云飛,李淵,徐濤
(西南醫科大學附屬醫院,四川瀘州 646000)
肺癌發病率及病死率位居惡性腫瘤之首[1],其中約80%為非小細胞肺癌(NSCLC)[2],而在NSCLC中N2約占20%[3]。準確的術前分期是制定個體化治療方案和精準評估預后的基礎,尤其是對ⅢA(N2)期NSCLC患者,術前縱隔淋巴結的準確分期顯得格外重要。正電子發射計算機斷層顯像(PET/CT)對縱隔淋巴結的雙定量分析,明顯提高了對NSCLC術前N分期的準確性,已廣泛應用于肺惡性腫瘤的術前TNM分期[4,5]。PET/CT主要是運用示蹤劑18F-FDG注入機體內,以標準化攝取值(SUV)來反映原發病灶及縱隔淋巴結糖代謝狀態。影響NSCLC術后預后的因素有很多,有年齡、性別、病理類型、TNM分期、輔助治療等,但都缺乏特異性;另外,有研究顯示,NSCLC原發病灶SUVmax與患者術后預后呈正相關[6,7]。但是,對于ⅢA(N2)期NSCLC患者,縱隔淋巴結SUVmax與患者術后預后關系的研究甚少。鑒于此,本研究對術后病理證實為ⅢA(N2)期NSCLC患者的術前PET/CT縱隔淋巴結SUVmax與預后進行分析,探究兩者的關系,以便為ⅢA(N2)期NSCLC患者制定腫瘤個體化治療方案及更準確地評估術后預后。
1 資料與方法
1.1 臨床資料 回顧性分析2010年1月~2015年12月西南醫科大學附屬醫院手術治療的1 626例NSCLC患者。納入標準:①PET/CT檢查后1周內行手術治療,且有FDG攝取;②手術方式為肺葉或葉以上切除+系統性縱隔淋巴結清掃;③按國際肺癌研究協會(IASLC)第七版TNM分期標準,術后病理分期為ⅢA(N2)期NSCLC患者;④R0切除;⑤患者一般情況良好,無手術禁忌證;⑥病例資料完整,且能提供術后隨訪資料。排除標準:①術前接受新輔助治療;②圍術期發生嚴重并發癥;③既往惡性腫瘤史。按上述標準,本研究共納入104例患者。其中男56例、女48例;年齡39~70歲,中位年齡55歲;吸煙指數≥400者63例,吸煙指數<400者41例;原發病灶位于右肺上葉27例,右肺中葉2例,右肺下葉32例,左肺上葉40例,左肺下葉3例;肺腺癌48例,肺鱗癌56例;T1有36例,T2有64例,T3有4例;開放手術28例,胸腔鏡中轉開胸手術12例,胸腔鏡手術64;肺葉切除患者92例,聯合肺葉切除患者8例,全肺切除患者4例。右側縱隔淋巴結常規清掃2R、3A、4R、7、8R、9R、10R、11R、12-13R(與病灶肺葉一同送檢);左側縱隔淋巴結常規清掃4L、5、6、7、8L、9L、10L、11L、12-13L(與病灶肺葉一同送檢)。術后行輔助治療80例[75例化療(含鉑類)、4例放化療、1例靶向治療],未行輔助治療24例。所有患者電話隨訪至2018年1月1日。
1.218F-FDG PET/CT縱隔淋巴結SUVmax計算方法 顯像儀器為荷蘭Philips公司Gemini TF 16PET/CT儀;18F-FDG由德國Siemens公司EclipseRD回旋加速器和北京派特生物技術有限公司的正電子藥物化學合成模塊生產,放化純>95%。受檢者禁食4~6 h,空腹血糖控制在3.9~6.8 mmoL/L。安靜、避光、平臥休息15 min 后,按3.7 MBq/kg手臂靜脈注射18F-FDG;注射后靜臥休息40~60 min,排盡尿液后行PET/CT顯像。患者仰臥位,雙手抱頭,平靜呼吸;掃描范圍從顱頂到大腿上1/3;先行CT掃描:電壓120 kV,電流100 mA,螺距0.813,矩陣512×512,層厚2.5 mm。PET采集:1.5 min/床位,共10~11個床位。數據經迭代重建后分別獲得冠狀面、矢狀面、橫斷面PET、CT及PET/CT融合圖像。所有患者PET/CT圖像由兩名經驗豐富的核醫學科醫生共同閱片,由同一位操作者在CT縱隔窗測量淋巴結大小、視覺分析淋巴結密度,在PET圖像上測量相應淋巴結的SUV,比較得出在清掃范圍內縱隔淋巴結SUVmax。以本組患者縱隔淋巴結SUVmax的均數作為分界點,分為<均數者與≥均數者。
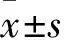
2 結果
18F-FDG PET/CT縱隔淋巴結單站陽性36例,多站陽性68例;肺原發病灶SUVmax為11.21±5.39,縱隔淋巴結SUVmax為4.73±2.08,肺原發病灶與縱隔淋巴結SUVmax差值為7.33±5.30。其中,縱隔淋巴結SUVmax<4.73者60例,≥4.73者44例。18F-FDG PET/CT縱隔淋巴結SUVmax與與ⅢA(N2)期NSCLC患者預后的關系單因素生存分析結果見表1。將單因素生存分析結果中P<0.1的變量進行多因素Cox回歸分析,結果表明縱隔淋巴結SUVmax、肺原病發灶SUVmax、縱隔淋巴結陽性站數、T分期、術后是否行輔助治療是影響本組ⅢA期(N2)NSCLC患者術后遠期生存的獨立因素(表2)。

表1 ⅢA期(N2)NSCLC手術患者預后影響因素的單因素分析結果

表2 ⅢA期(N2)NSCLC手術患者預后影響因素的多因素Cox回歸分析結果
3 討論
ⅢA(N2)期NSCLC主要特點是異質性[8],其最佳治療方案目前仍存在爭議。有研究將ⅢA(N2)期NSCLC分為4類[9]:①術前或術中未發現,術后病理偶然發現的N2;②術中發現的單站N2;③術前分期(PET/CT或淋巴結活檢)發現的單站或多站N2;④巨塊或固定的多站N2。N2分類的不同,不僅影響患者治療方案的選擇,同時也影響患者的預后。對于巨塊或多站N2,雖然有研究報道巨塊單站N2(短徑>2 cm)行手術治療的5年生存率獲益[10],但大部分學者認為此類N2的治療方式應同N3,以同步放化療為主[11];Lee等[12]回顧性分析358例術后病理分期為ⅢA(N2)或ⅢB期的NSCLC患者,單站N2的5年生存率為33.8%,多站N2的5年生存率為20.4%,單站N2與多站N2的中位生存期為26.4月比18.2月(P=0.016);多站N2的5年生存率(20.4%)與ⅢB期5年生存率(15.5%)的差異無統計學意義(P=0.585)。Thomas等[13]發現3 271例ⅢA(N2)期NSCLC患者術后偶然N2的5年生存率(33.5%)與術前N2的5年生存率(31.4%)無統計學差異(P=0.173),在偶然N2組中,術后輔助化療或放化療的5年生存率(39.2%、41.5%)高于單獨行手術治療的5年生存率(20.2%)(P<0.001)。Funakoshi等[14]發現141例術后病理分期為ⅢA(N2)期NSCLC(103例腺癌、38例鱗癌),術后病理N2、術前發現N2(P=0.003)、非完全性切除(P=0.02)、多站N2(P=0.03)是影響腺癌預后的不利因素,非完全性切除(P=0.002)是影響鱗癌預后的不利因素;腺癌中術前未發現N2的5年生存率為43.2%,術前發現N2的5年生存率為15%,單站N2與多站N2的5年生存率分別為62.8%、14.7%。Garrido等[15]研究發現完全性切除是NSCLC術后預后的關鍵因素,62例完全性切除的患者中位生存期為48.5月,13例非完全性切除患者中位生存期為12.9月,15例未切除患者中位生存期為16.8月(P=0.005);3年和5年生存率三組分別為60.1%、40.4%,23.1%、11.5%,31.1%、0。Van Meerbeeck等[16]發現579例ⅢA(N2)期NSCLC總中位生存期為15.4月,誘導化療+手術治療組的中位生存期及5年生存率分別為16.4月、15.7%,誘導化療+放療組的中位生存期及5年生存率分別為17.5月、14%(HR=1.06,95%CI=0.84~1.35);然而,亞組分析可以發現行完全手術切除組、非完全切除組的5年生存率分別為27%、7%(P<0.001)。Counago等[17]研究選擇247例可手術切除的ⅢA(N2)期NSCLC,發現新輔助化療或放化療+手術治療(R0切除)組中行肺葉切除的中位生存期及3年無病生存率要優于行同步放化療組,然而行全肺切除的中位生存期及3年無病生存率與同步放化療組比較無明顯統計學差異。因此,術前進行精準的縱隔分期,篩選出手術獲益群體(完全切除、非全肺切除者),能在一定程度上提高ⅢA(N2)期NSCLC術后生存率。對于NSCLC,雖然縱隔鏡、纖維支氣管鏡超聲引導下經支氣管針吸活檢(EBUS-TBNA)等縱隔淋巴結活檢術是術前縱隔分期的金標準[18],但由于縱隔鏡、EBUS-TBNA潛在的并發癥和較高費用以及技術要求高等原因,限制了其在我國的普及。由此,本研究回顧性分析104例術后病理證實為ⅢA(N2)期NSCLC患者術前PET/CT縱隔淋巴結SUVmax與術后預后的關系,探討用縱隔淋巴結SUVmax評估ⅢA(N2)期NSCLC術后預后的價值,將其更好的用于術前分期,幫助臨床醫生為患者制定個體化的治療方案。
影響ⅢA(N2)期NSCLC術后預后的因素有很多。Oskarsdottir等[19]研究發現,高齡(>75歲)是影響NSCLC術后預后的不良因素(HR=1.03,95%CI:1.02~1.04,P<0.000 1)。Urvay等[20]認為,年齡是影響Ⅲ期NSCLC預后的獨立因素。Jeremic等[21]Meta分析顯示,年齡、性別、病理類型等變量常用來評估ⅢA(N2)期NSCLC術后預后。Pinto等[22]Meta分析表明,性別、吸煙狀況、病理類型等是影響NSCLC術后預后的變量。但本研究生存分析顯示,年齡、性別、病理類型、吸煙指數等變量并非是影響術后預后的獨立因素,分析原因一方面可能是樣本量較少,另一方面本組研究對象是ⅢA(N2)期NSCLC,組間無分期差異,且以手術切除+系統性縱隔淋巴結清掃為一線治療。關于腫瘤部位與術后預后的關系,Kamel等[23]分析誘導治療后行手術的203例臨床分期為ⅢA(N2)期NSCLC的患者,單因素及多因素生存分析表明位于上葉或中葉的腫瘤是出現持續性N2的獨立預測因素,與患者的低生存率相關。由于病例數有限且本組患者術前均未行誘導治療,并未發現腫瘤部位的不同對術后預后有影響。Kim等[24]研究發現,T分期、術后輔助化療是ⅢA(N2)期NSCLC術后長期生存的獨立預后因素。本組研究生存分析表明,T分期、術后輔助治療(以化療為主)等變量對術后預后的影響有統計學差異。研究表明,多站N2的預后較單站N2差,本組研究得到同樣的結果(P=0.008)。目前較多研究表明,肺原發病灶SUVmax是NSCLC術后預后的獨立預測因素[25,26],但大部分研究對象是Ⅰ、Ⅱ期NSCLC,對于Ⅲ期NSCLC的研究較少。Yilmaz等[27]研究79例同步放化療治療的Ⅲ期NSCLC,發現原發灶SUVmax≤15與SUVmax>15者的中位生存期分別為11、13月(P=0.826),認為肺原發灶SUVmax對Ⅲ期NSCLC預后無預測作用。本組研究單因素和多因素生存分析顯示肺原發病灶SUVmax(<11.21,≥11.21)是影響術后預后的獨立因素(P=0.006),分析原因可能是主要治療方法不同,本組選擇的是行根治性手術(R0切除)+術后輔助治療。
與之前研究不同的是,本組研究選取術后病理分期為ⅢA(N2)期NSCLC患者,探討術前PET/CT縱隔淋巴結SUVmax與術后預后的關系;結果顯示,縱隔淋巴結SUVmax是影響本組NSCLC術后預后的獨立因素。對于NSCLC,縱隔淋巴結SUVmax與術后預后關系的研究已較多。An等[28]認為,在有炎癥性肺病與肺癌共存時,縱隔淋巴結SUVmax是惟一具有預測NSCLC患者術后預后的變量。Mallorie等[29]研究61例NSCLC患者的221個縱隔淋巴結,ROC曲線分析顯示縱隔淋巴結SUVmax>6.4特異性高達95.5%,然而敏感性只有48%;當SUVmax>3.3時,其特異性為79.1%,敏感性為80%;縱隔淋巴結是否轉移在淋巴結活性大于縱隔血池時最敏感(92.9%),SUVmax大于原發病灶SUVmax/2最有特異性(88.9%)。因此將縱隔淋巴結SUVmax與原發病灶SUVmax/2以及縱隔血池SUVmax結合起來預測NSCLC術后預后,敏感性更高,特異性更強。本研究選取在縱隔血池中活性最高的淋巴結,測出其SUVmax。由于本組病例縱隔淋巴結SUVmax分布不均,若以中位數為臨界點,會將大部分數值相近的分到同組,可能對結果產生影響;再者原發病灶均數SUVmax/2=5.6,因此選擇均數4.73為臨界點既得到更準確的結果,又保證了PET/CT的敏感性及特異性。Sharma等[30]前瞻性評估各種PET/CT參數在預測接受化療(含鉑類)的60例NSCLC患者總生存期中的價值,發現SUVmax、平均SUV等全身PET/CT參數對這部分患者預后無預測價值。Cremonesi等[31]系統評價結果表明,18F-FDG PET/CT在預測接受化療或放療的NSCLC患者預后缺乏統一標準,但仍是一種最具潛力的預測因素。Tachi等[32]對92例術后病理分期為ⅢA(N2)期的NSCLC分析發現,無FDG攝取且術前未被懷疑N2的5年生存率高于被懷疑N2的5年生存率(P=0.005 1),有FDG攝取但未被懷疑N2與被懷疑N2的5年生存率的差異無統計學意義。本組患者以手術切除(R0切除)+縱隔淋巴結清掃為一線治療,術后80例患者接受輔助治療,以手術為基礎的綜合治療方式,體現出縱隔淋巴結SUVmax在ⅢA(N2)期NSCLC術后預后評估中的價值。另外,本組探討了肺原發病灶與縱隔淋巴結SUVmax差值與預后的關系,進一步分析SUVmax差值各組數據,發現大部分肺原發病灶SUVmax-縱隔淋巴結SUVmax所得值仍處于肺原發灶SUVmax原組范圍,實際上反映了肺原發病灶與預后的關系,因此在多因素Cox回歸分析時不是影響預后的獨立因素。
本研究得出縱隔淋巴結SUVmax、肺原發病灶SUVmax、縱隔淋巴結陽性站數、T分期、術后是否行輔助治療是影響ⅢA(N2)期NSCLC患者術后遠期生存的獨立因素,將五者結合起來,將有助于臨床醫生作出更準確的術前分期,為患者制定出個體化的治療方案,從而獲得較理想的遠期生存。由于本組研究未納入術前PET/CT無FDG攝取但術后病理為N2的這部分患者,如何將PET/CT對術后預后預測的優勢運用于這部分N2,還有待后續的研究;本組未納入術前行新輔助治療的患者,研究結果是否對這部分患者也適用還有待多中心、大樣本、前瞻性的研究來進一步證實。

