神經肽Y雙側室旁核顯微注射在瘦素調節2型糖尿病大鼠交感神經活性和壓力反射功能中的作用
李寶新,郭淑芹,董越華,辛歡歡,常文龍,王翯,李娜,田茜,張云良
(1保定市第一中心醫院,河北保定 071000;2河北醫科大學)
糖尿病與交感神經活性(SNA)增強均影響著高血壓的發生和發展[1,2]。瘦素(LPN)是由白色脂肪分泌的一種神經內分泌因子,與肥胖、能量代謝等密切相關,能激活交感神經系統,使壓力敏感性降低[3],與糖尿病和高血壓的發生、發展密切相關。神經肽Y(NPY)為與動物攝食、能量平衡及肥胖等相關的神經遞質,LPN參與機體能量的調節可能是通過下丘腦NPY實現的。LPN可與NPY神經元上的LPN受體結合,抑制NPY合成與分泌,腦室內輸入LPN可抑制NPY的表達[4,5]。有研究報道,在側腦室輸注NPY可降低血壓、心率及SNA[6]。因此,NPY可能參與LPN對糖尿病與高血壓的調節機制,但其具體作用部位尚未明確,且對壓力感受性反射功能影響尚不清楚。2016年4月~2017年10月,本研究探討了NPY調節LPN對2型糖尿病大鼠SNA和壓力感受性反射功能的影響。
1 材料與方法
1.1 實驗動物、試劑及儀器 雄性SD大鼠20只,體質量220~250 g,購自北京維通利華實驗動物技術有限公司,飼養于河北大學醫學部實驗動物中心SPF級動物室,室內通風良好,室溫保持在18~20 ℃。基礎飼料喂養,自由飲食飲水。適應性喂養1周后開始實驗。Biopac MP100數據獲得和分析系統(美國Biopac Systems公司),α-氯醛糖(美國Sigma公司),異氟醚(美國Sigma公司),瘦素(美國R&D Systems公司),NPYx(英國Tocris Bioscience公司)。
1.2 2型糖尿病模型的制備 實驗期間給予20只SD大鼠高糖高脂飼料(常規飼料中加入20%蔗糖、15%熟豬油、2.5%膽固醇)喂養8周,禁食12 h后左下腹腔給予鏈脲佐菌素(0.1 mmol/L,檸檬酸鈉配制,pH 4.2)30 mg/kg注射。于實驗第9周末選取尾靜脈空腹血糖≥7.8 mmol/L且伴有胰島素抵抗者作為2型糖尿病動物模型[7],2只大鼠血糖未達標予以淘汰。
1.3 實驗分組 將18只2型糖尿病大鼠依據室旁核顯微注射人工腦脊液(aCSF)和NPY受體激動劑NPYx隨機分為PVN-aCSF組和PVN-NPYx組,每組9只。
1.4 SNA和壓力感受性反射功能觀察 兩組均予5%異氟醚誘導麻醉,氧氣吸入后逐漸減為2%異氟醚維持。使用直腸熱敏電阻監測,體溫保持在(37±1)℃。氣管插管保持人工通氣,然后股動脈(1支)和股靜脈(3支)導管植入用于監測動脈壓和藥物輸注。在下腹部取正中切口,找到腰椎神經,應用輕量級有機硅材、雙極不銹鋼電極定位和液體膠定位和固定神經,以電腦顯示出現神經傳導信號為準,然后應用立體定位儀定位側腦室和室旁核注射部位,大鼠需穩定60 min以上開始進行下述實驗。①兩組基礎SNA、平均動脈壓(MAP)、心率(HR)應用Biopac MP100數據獲得和分析系統記錄,2 000 Hz進行采樣。SNA經帶通濾過和放大,數據采集后SNA信號整合成1 s,以%表示。壓力感受性反射曲線是靜脈微量注射泵注射硝普鈉使血壓快速下降至50 mmHg,而后應用鹽酸苯腎上腺素使血壓緩慢上升,3~5 min升至175 mmHg,觀察由血壓、HR變化而形成的擬合S曲線。根據基礎數值(SNA、MAP、HR),繪制基礎壓力感受性反射曲線。MAP、HR、SNA在反射曲線中的關系是應用Boltzmann方程進行比較的:HR或SNA=(P1-P2)/[1+exp(MAP-P3)/P4]+P2。P1是HR或SNA最大值(Max),P2是HR或SNA最小值(Min),P3是MAP在HR或SNA取中值時的血壓(BP50),P4是寬度。baroreflex最大值、最小值和中點均在曲線圖中標出。壓力感受性反射功能變化由SNA壓力反射曲線中的Max、Min和BP50來反映和表示[8]。②應用立體定位儀定位大鼠頭部,使其暴露出扁平的頭骨,使用前囟和硬膜的背表面為基準(計為零),帶有細小管尖的單筒玻璃移液管用于側腦室輸注LPN(5 μg/h)。套管定位坐標如下(毫米前囟):尾1.0 mm,側1.4 mm,背4.2 mm。輸注1 h后(T1),繪制壓力感受性反射曲線。實驗結束后將2.5%阿利新藍溶解在醋酸鈉中注入100 nL,去除腦后發現腦室有染料存在,證實輸注部位正確。③兩組繼續輸注LPN的同時,使用微量玻璃移液管(管尖周徑20~40 μm)在顯微鏡下進行室旁核藥物注射,仍使用前囟和硬膜的背表面為基準(計為零),微量移液管進行坐標定位:尾側1.8~2.0 mm,外側0.5 mm,腹側7.4 mm。雙側室旁核應用壓射系統進行顯微注射NPYx(0.5 mmol/L,60 nL)或aCSF(配制:氯化鈉氯化鉀2.6 mmol/L、氯化鈣1.3 mmol/L、氯化鎂0.9 mmol/L、碳酸氫鈉20 mmol/L、磷酸氫二鈉1.3 mmol/L、葡萄糖2.0 mmol/L,pH為7.4)注射60 nL。注射10 min后(T2),繪制壓力感受性反射曲線。實驗結束后同樣應用2.5%阿利新藍60 nL進行注射,取組織制成冷凍切片。應用標準解剖圖譜確認部位正確。
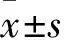
2 結果
2.1 兩組SNA、MAP、HR比較 見表1。
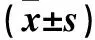
表1 兩組大鼠SNA、MAP、HR比較
注:與本組基礎時比較,*P<0.05;與本組T1時比較,△P<0.05;與PVN-aCSF組同期比較,#P<0.05。
2.2 兩組壓力反射功能參數SNA的Max、Min及BP50比較 見表2、圖1。
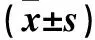
表2 兩組交感神經壓力反射功能參數SNA的Max、Min及BP50比較
注:與本組基礎時比較,*P<0.05;與本組T1時比較,△P<0.05;與PVN-aCSF組同期比較,#P<0.05。
3 討論
糖尿病與高血壓的發病率逐年上升,二者相互影響[9]。LPN和NPY都與能量代謝、肥胖有關。有研究認為,NPY可能與高血壓有關[10,11],而且,LPN對高血壓和糖尿病均有影響[12],因此推測,二者可能共同參與影響高血壓。SNA增加又是高血壓發病的重要機制之一[13],所以它們可能對交感神經均有影響,但具體通過何種途徑影響尚不清楚。本研究通過對2型糖尿病大鼠輸注LPN觀察SNA、HR、MAP等的變化,同時室旁核顯微注射NPY激動劑NPYx,觀察由LPN引起的交感神經的變化是否受NPYx的影響,探討NPY在LPN調控SNA機制中的作用。
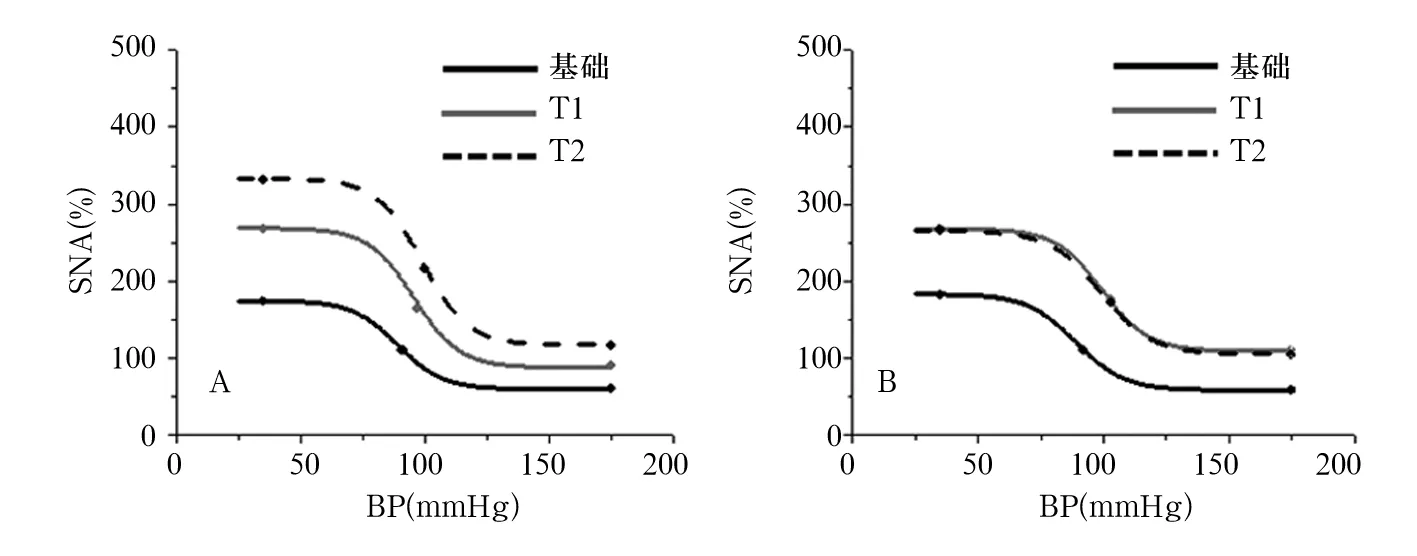
注:A為PVN-aCSF組;B為PVN-NPYx組。
圖1兩組SNA壓力感受性反射曲線圖
LPN由肥胖基因編碼,脂肪細胞分泌,是一種由67個氨基酸組成的、相對分子質量約為16 kD的蛋白質類激素[14],它可以通過作用于中樞神經系統,激活交感神經系統、損害孤束核壓力反射中樞而影響高血壓的發生、發展[15];同時,它可通過中樞神經系統下行通路,抑制肝糖原異生,促進骨骼肌對外周組織攝取和利用血糖,降低升血糖的激素,改善胰島素抵抗,從而降低血糖[16]。NPY是一種由交感神經節后神經元合成和分泌的含有36個氨基酸殘基的多肽,它具有比去甲腎上腺素更強更持久的縮血管作用,并能增強血管對縮血管物質的反應,減弱血管對舒血管物質的反應,在高血壓的發生發展中起重要作用[17];研究[18]發現無論高血壓患者或是自發性高血壓大鼠,其血漿中NPY的水平均明顯升高。目前多個下丘腦核團已被確定為靶點可誘導LPN啟動SNA增加,包括腹內側下丘腦、弓狀核、背內側核和下丘腦外側區,LPN也被證實在室旁核能使血壓增加[19],但是否增加SNA及壓力感受性反射功能尚未觀察到。雖然LPN在許多腦區啟動交感興奮性效應,但這些效應均需與神經介導的LPN受體結合并可能投射至室旁核后方起作用。另有報道認為,室旁核可通過許多部位從而增加SNA,NPY受體亞型(Y1-R)在中樞系統廣泛表達,室旁核也可表達Y1-R[20,21]。有研究報道,2型糖尿病大鼠下丘腦神經水平與LPN呈正相關性,LPN可與NPY神經元上的LPN受體結合,抑制NPY分泌,二者形成LPN—下丘腦NPY軸,參與攝食,影響糖脂代謝[22],這表明LPN可能參與調節下丘腦NPY水平,故本研究通過動物實驗來探究NPY調節LPN對2型糖尿病大鼠SNA和壓力感受性反射功能的影響。本研究結果顯示:兩組在基礎及T1時輸注LPN后SNA、MAP、HR值無明顯統計學差異。在PVN-aCSF組中,與基礎時相比,T1、T2時的SNA、MAP、HR值明顯升高,以T2時最高。在PVN-NPYx組中,與基礎時相比,T1、T2時SNA值明顯升高,以T1時最高。提示LPN可使2型糖尿病大鼠的SNA、MAP、HR值升高。本研究結果還發現,PVN-NPYx組室旁核顯微注射NPYx后的SNA、MAP、HR值較同時間段的PVN-aCSF組明顯降低。說明室旁核注射NPYx后抑制了LPN對2型糖尿病大鼠的作用,由壓力反射曲線可知室旁核注射NPYx后的曲線與1 h輸注LPN后的曲線并未完全重合,推測NPY可能部分參與了LPN對2型糖尿病大鼠SNA的影響,且作用部位為下丘腦的室旁核。有研究報道,2型糖尿病大鼠下丘腦NPY與LPN受體水平呈負相關性[23],故我們推測可能NPY激動劑使NPY的活性大大增加,食欲增加,通過LPN—下丘腦NPY軸的負反饋調節作用,LPN分泌減少,同時LPN的受體水平下降,導致LPN無法與受體結合發揮作用,導致了LPN抵抗,進而部分抑制了LPN對2型糖尿病大鼠SNA的作用。
壓力感受性反射功能對維持正常交感輸出具有關鍵作用,反射功能低下可導致交感活動反射性抑制功能缺乏,從而導致交感輸出的增加,即外周交感神經活動亢進[24]。高血壓患者的壓力反射感受功能均有一定程度的受損[25]。糖尿病早期已經發生了自主神經小纖維的神經病變,由于慢性血糖升高導致的自主神經功能和結構受損,胰島素抵抗進一步加重了自主神經的損傷,導致糖尿病患者的壓力反射感受功能比正常人降低。有研究表明,LPN可作用于中樞,增加SNA,進而降低壓力感受性反射功能[26];亦有研究發現,隨著血壓分級的增高,2型糖尿病患者血清NPY水平逐漸增加,NPY水平升高可加重肥胖、胰島素抵抗,同時對糖尿病患者的自主神經病變也有影響[27,28]。但NPY如何參與到LPN對2型糖尿病大鼠壓力感受性反射功能的影響中尚不清楚。本研究根據Boltzmann方程中的各數值關系,選擇交感神經壓力反射功能參數Max、Min、BP50值的大小來反映壓力感受性反射功能的變化。本研究結果顯示,在PVN-aCSF組中,與基礎時相比,T1、T2時Max、Min、BP50值明顯升高;在PVN-NPYx組中,與基礎時相比,T1、T2時Max值明顯升高,PVN-NPYx組室旁核顯微NPYx后的Max、Min值較同時間段PVN-aCSF組大鼠明顯降低。表明NPY減弱了LPN增強2型糖尿病大鼠的壓力感受性反射功能的作用。結合壓力感受性反射曲線,1 h輸注LPN后、室旁核顯微注射NPYx后Max、Min、BP50值較基礎時升高,但未降至基礎時水平,進一步證實了NPY可能部分參與調控了LPN影響交感神經系統的途徑。
綜上所述,NPY雙側室旁核顯微注射可逆轉LPN增加2型糖尿病大鼠SNA的作用,減弱LPN增強2型糖尿病大鼠壓力感受性反射功能的作用。

