不同液體復蘇方式未改善膿毒癥大鼠心肌線粒體功能
丁 丁,胡 艷,張 敏,劉 念
(1安徽醫學高等專科學校基礎部;2安徽醫科大學第一附屬醫院重癥醫學科,安徽合肥 230022)
心肌功能障礙是膿毒癥患者常見的并發癥,死亡率高達40%[1],心肌線粒體是重要的損傷目標[2],在膿毒癥中心肌線粒體功能障礙可導致心肌受損,進而導致心力衰竭[3]。但是由于導致心肌線粒體功能障礙的機制復雜,目前缺乏有效的靶向治療。液體復蘇廣泛用于膿毒癥患者的早期干預,主要復蘇液體包括乳酸林格氏液(RL)、生理鹽水(NS)和白蛋白(ALB)。然而,選擇何種液體進行液體復蘇仍存在爭議[4-8]。本文研究了不同復蘇液進行液體復蘇時膿毒癥大鼠的心肌損傷的保護作用和心肌線粒體功能的動態變化,并研究了不同復蘇液對心肌線粒體功能的影響。
1 方 法
1.1 實驗大鼠
清潔級雄性成年Sprague-Dawley(SD)大鼠180只,體重(213.58±20.74)g,由安徽醫科大學實驗動物中心提供,動物質量許可證號:SCXK(皖)2015-02。
1.2 膿毒癥大鼠模型的制備及分組
180 只SD 大鼠隨機分為組(每組12 只)。使用10%水合氯醛(10 mg/kg)通過腹腔注射將實驗大鼠完全麻醉。對照組只接受開腹和關腹治療。實驗組用盲腸結扎法制備膿毒癥大鼠模型,盲腸結扎法致病菌具有多樣性,包括兼性厭氧菌、革蘭陽性菌、酵母菌、腸厭氧微生物等,與人類膿毒癥致病菌類似,能夠較好的反映膿毒癥的病理生理過程。試驗組隨機分為膿毒癥組(無復蘇液體)、乳酸林格復蘇組(RL組)、生理鹽水復蘇組(NS 組)和白蛋白復蘇組(ALB組)。使用微型泵通過右股靜脈插管在復蘇組中制備膿毒癥模型后1 h 開始進行液體復蘇。對照組和試驗組隨后根據時間以12 h、24 h 和48 h 為節點進行研究。12 h RL 組、NS 組和ALB 組的大鼠分別接受10 mL/kg/h RL、10 mL/kg/h NS 和3 mL/kg/h ALB(5%),進行連續12 h 液體復蘇。24 h RL 組、NS 組和ALB 組大鼠在術后分別接受10 mL/kg/h RL、10 mL/kg/h NS 和3 mL/kg/h ALB,進行連續24 h 液體復蘇,48 h RL 組、NS 組和ALB 組大鼠在術后分別接受15 mL/kg/h RL、15 mL/kg/h NS和5 mL/kg/h ALB,進行連續48 h液體復蘇。
1.3 標本收獲
對照組和試驗組大鼠在相應的時間點(12、24和48 h)被處死后,從大鼠左心室采集心肌組織。
1.4 實驗方法
一般觀察:三名對不知道特定分組情況的研究人員觀察所有大鼠的一般狀況,并測量大鼠的心率和體溫。另一名研究人員負責分析數據并觀察實驗大鼠出現精神萎靡、全身顫抖、行走不穩、腹脹腹瀉等癥狀,為膿毒癥造模成功。心肌被固定在10%多聚甲醛中,脫水,并包埋在石蠟中,切割厚度為5 μm的石蠟切片,放在載玻片上,用蘇木精伊紅(HE)染色以進行光學顯微鏡觀察。凋亡的心肌細胞被觀察到是整個心肌區域的空泡化區域。組織病理學變化按0~4的等級評分如下:0=正常;1=最小損壞;2=輕微損壞;3=中度損壞;4=嚴重損壞。三名從事組織病理學工作超過10 年的病理醫師被要求同時進行組織病理學檢查并給出相應的分數,平均值被計算為最終的病理分數。
心肌線粒體功能的測量:用4 ℃生理鹽水不間斷沖洗掉心臟各腔室及大血管的血液,用濾紙反復吸干心臟上的水分后在天枰上稱重。在左心室取約250 mg心肌組織。心肌組織切碎后在4 ℃介質(0.25 mol/L蔗糖、10 mmol/L Tris-HCl,pH7.4,0~4 ℃)中制備心肌組織勻漿。勻漿經750 g、離心10 min后留上清,以9 000 g 離心20 min 后留沉淀,重新懸浮后以9 000 g再離心20 min,棄上清得線粒體,全部操作于4 ℃進行。心肌線粒體懸浮液的純度為17~20 mg/mL。用流式細胞術(FCM)測量線粒體膜電位,并用FL-1通道的熒光強度/FL-2通道的熒光強度進行評估[9]。激發波長設置為488 nm,FL-1 通道的最大發射波長為580/590 nm,FL-2 通道的最大發射波長為510/527 nm,并使用Cell Quest 軟件分析圖像。ATP可以分解成ADP 和無機磷,因此,并用分光光度法測定無機磷含量評價線粒體Ca2+-Mg2+-ATPase 活性。線粒體呼吸鏈復合體I 和II 的活性用比色定量法[10]測量。線粒體呼吸鏈復合體I 活性隨著氧化后NADH峰值水平的降低而被評估。線粒體呼吸鏈復合物II 活性在還原后隨著二氯酚-吲哚酚峰值水平的降低而被評估。
1.5 統計分析
2 結果
2.1 一般情況
所有的實驗大鼠在實驗過程中均未死亡。實驗組大鼠術后12 h 出現膿毒癥癥狀,例如心率和呼吸頻率加快、體溫升高、精神反應不良、食欲不振和體重減輕,超過一半出現出血傾向和腹瀉癥狀。這些結果表明,實驗組成功建立了膿毒癥模型。對照組大鼠則未出現心率和呼吸頻率沒有加快,體溫上升,精神反應不良,食欲不振和體重減輕癥狀。在相應的時間點,每個研究分組中復蘇液的平均量見表1。

表1 不同組復蘇液的平均量
2.2 心肌組織病理學觀察
蘇木精伊紅(HE)染色法對照組心肌纖維條紋清晰,無明顯變性和壞死,心肌間質無明顯改變(圖1A)。膿毒癥組和復蘇組心肌組織發生炎癥反應,部分心肌細胞發生變性和局灶性壞死,尤其是24和48 h(圖1B、1C和1D)。組織病理學評分顯示48 h膿毒癥組>24 h 膿毒癥組>12 h 膿毒癥組>對照組[(3.19±0.21)vs(2.04±0.17)vs(0.96±0.13)vs(0.11±0.07),均P<0.05]。
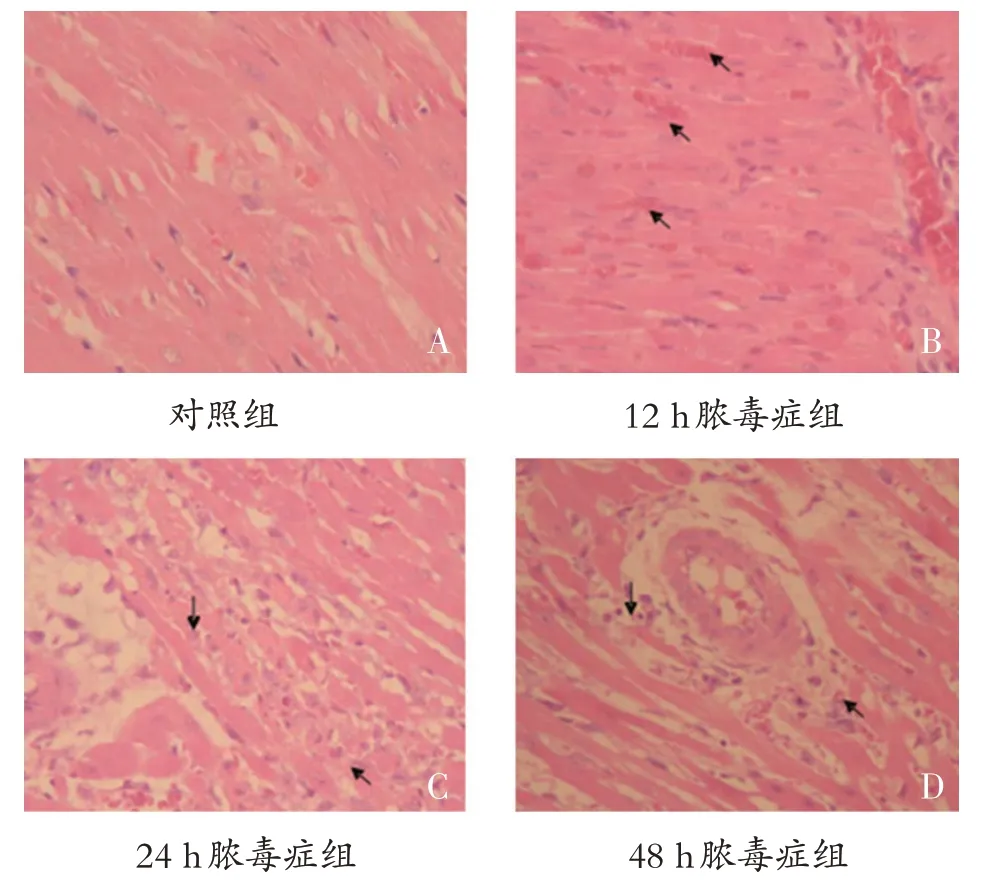
圖1 大鼠心肌組織病理切片箭頭所示為心肌細胞變性和局灶性壞死
2.3 心肌線粒體功能
表2 各組大鼠心肌線粒體膜電位比較(±s)

表2 各組大鼠心肌線粒體膜電位比較(±s)
注:a 與對照組比較,P<0.01;b 與12 h 膿毒癥組比較,P<0.05
與對照組相比,膿毒癥大鼠24 h 和48 h 的心肌線粒體膜電位降低(P<0.01),24 h和48 h非復蘇組的膜電位低于12 h非復蘇組(P<0.01),48小時非復蘇組的膜電位低于24 h 非復蘇組(P<0.05)(見表2,圖2)。
表3 各組大鼠心肌線粒體Ca2+-Mg2+-ATP酶活性比較(±s)
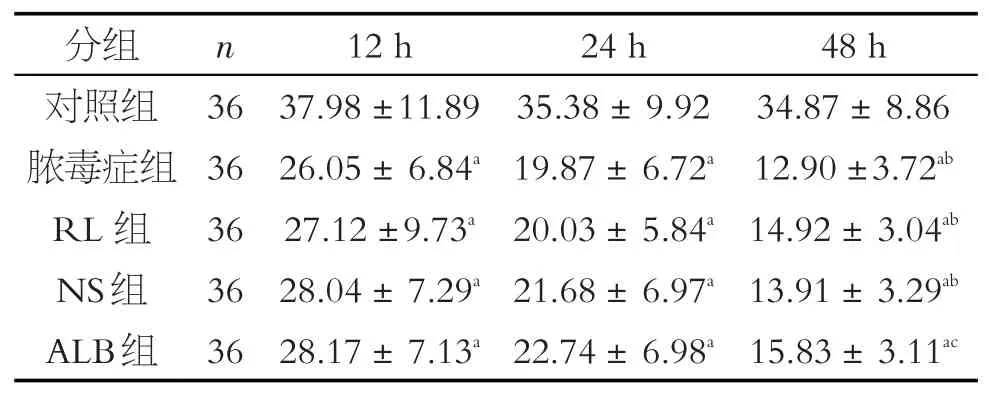
表3 各組大鼠心肌線粒體Ca2+-Mg2+-ATP酶活性比較(±s)
注:a 與對照組比較,P<0.05;b 與12 h 膿毒癥組比較,P<0.05;c 與12 hRL 組比較,P<0.05;d 與12 NS 組比較,P<0.05;e與12 hALB組比較,P<0.05
與對照組相比,膿毒癥大鼠12 h、24 h和48 h的Ca2+-Mg2+-ATPase 活性降低(P<0.01),24 h 和48 h非復蘇組的Ca2+-Mg2+-ATPase活性低于12 h非復蘇組(P<0.05),48 h非復蘇組的Ca2+-Mg2+-ATPase活性低于12 h和24 h非復蘇組(P<0.05)(見表3,圖3)。
表4 各組大鼠心肌線粒體呼吸鏈復合物I活性的比較(±s)
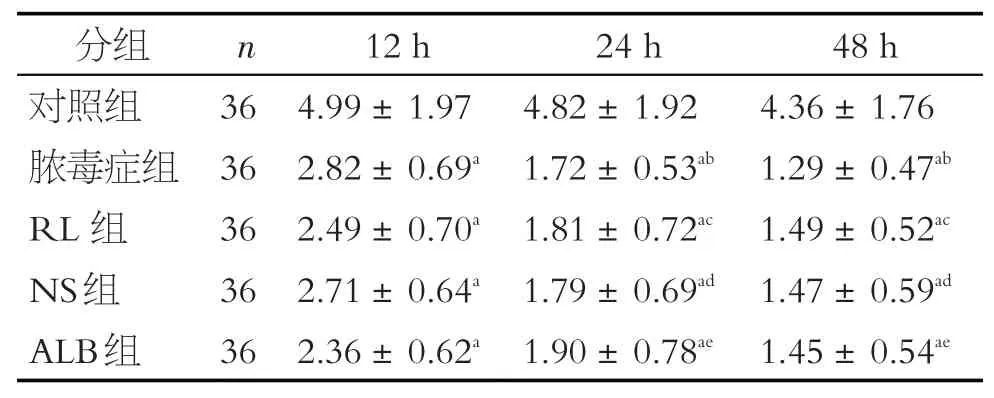
表4 各組大鼠心肌線粒體呼吸鏈復合物I活性的比較(±s)
注:a 與對照組比較,P<0.01;b 與12 h 膿毒癥組比較,P<0.05;c與12 hRL組比較,P<0.05;d與12 h NS組比較,P<0.05;e與12 hALB組比較,P<0.05
與對照組相比,膿毒癥大鼠在12 h、24 h 和48 h的復合物I活性降低(P<0.01),24 h和48 h非復蘇組的復合I 活性低于12 h 非復蘇組(P<0.05)(見表4,圖4)。
表5 各組大鼠心肌線粒體呼吸鏈復合物II活性的比較(±s)
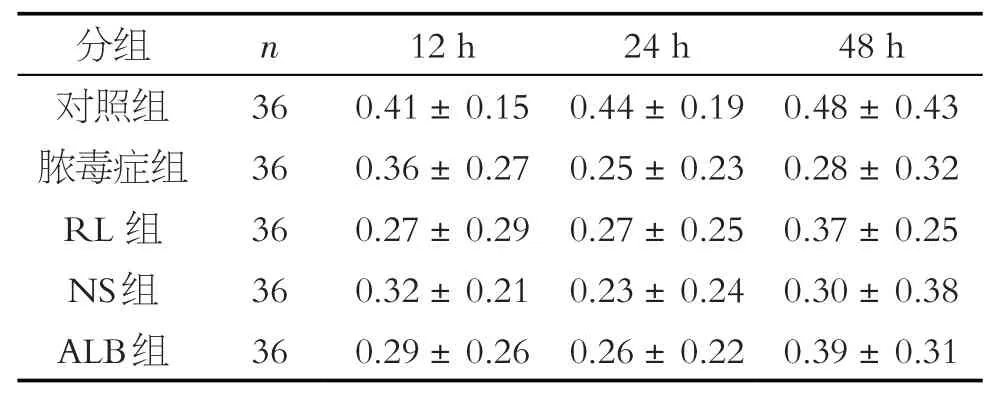
表5 各組大鼠心肌線粒體呼吸鏈復合物II活性的比較(±s)
注:各組均無顯著差異
與對照組相比,膿毒癥大鼠的復合物II 活性沒有降低(P>0.05)(見表5、圖5)。同一時間點,非復蘇組和復蘇組的心肌線粒體膜電位和Ca2+-Mg2+-ATPase、復合物I 和II 的活性沒有統計學差異(P>0.05)(見圖2~5),這表明用乳酸林格氏液、生理鹽水和白蛋白復蘇不會恢復心肌線粒體膜電位和Ca2+-Mg2+-ATPase和復合物I和II的活性。
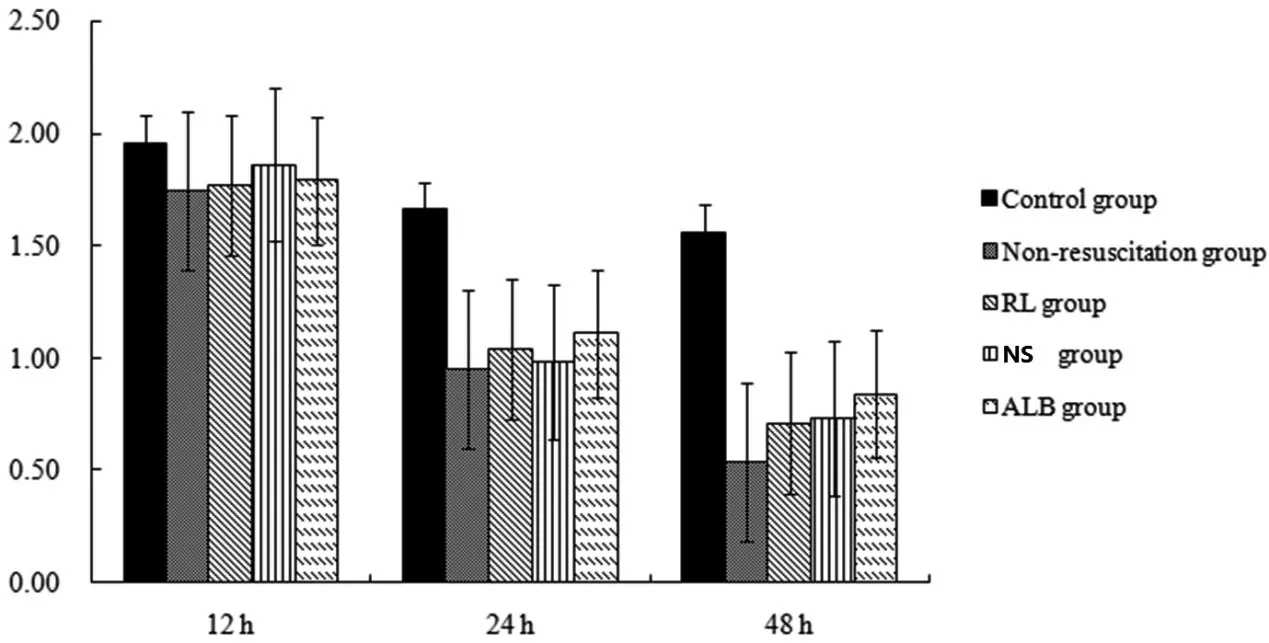
圖2 心肌線粒體膜電位
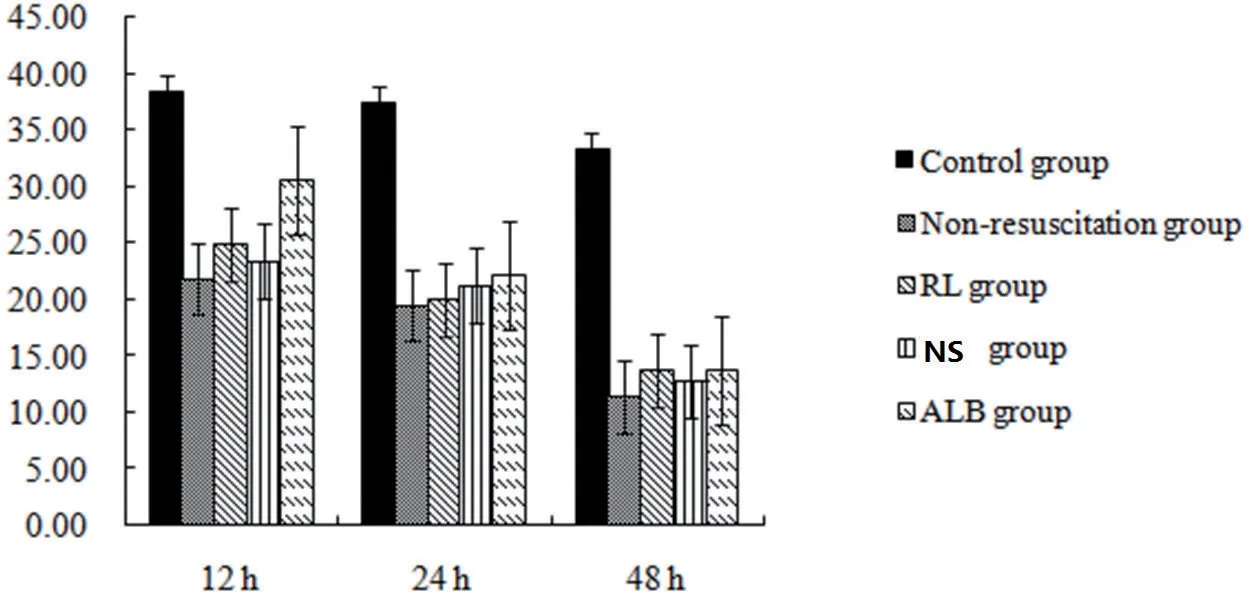
圖3 Ca2+-Mg2+-ATPase活性(g/L)
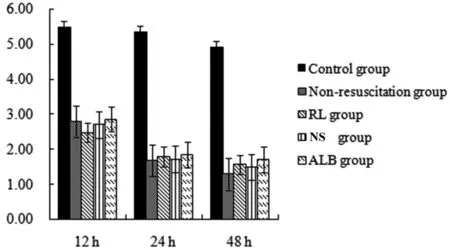
圖4 線粒體呼吸鏈復合體I活性(U/mg)
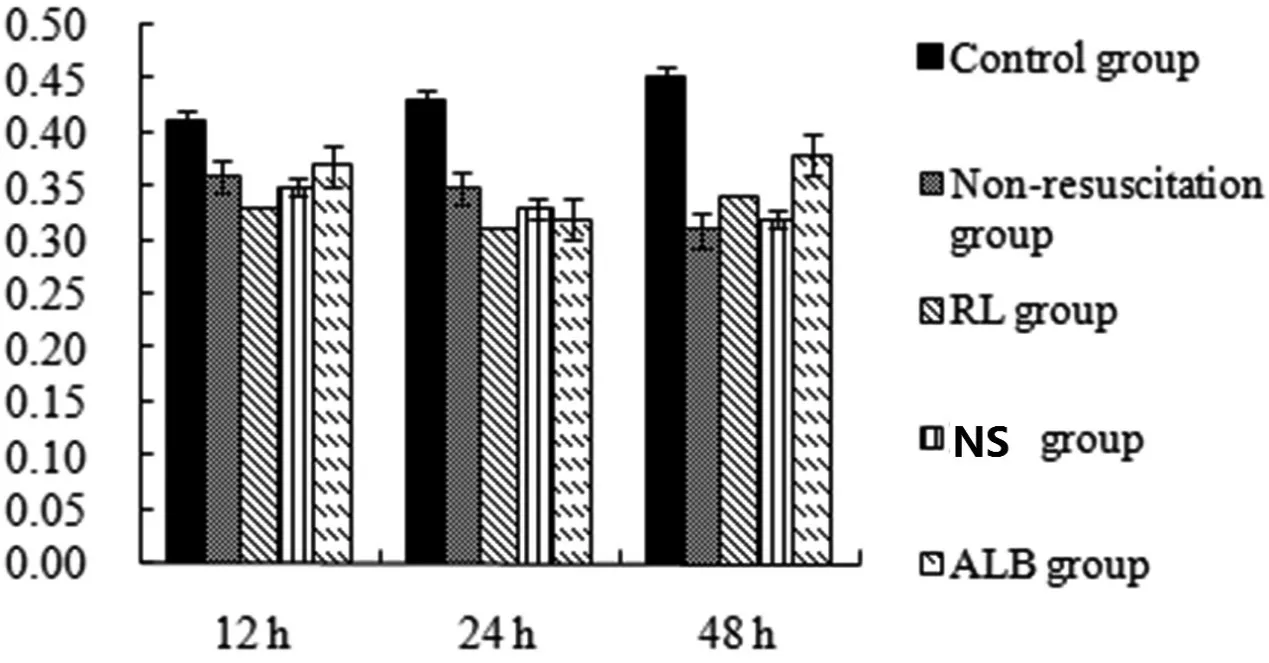
圖5 線粒體呼吸鏈復合物II(U/mg)
3 討論
液體復蘇是膿毒癥“Buddle化”治療的重要組成部分,在臨床工作中有著重要的地位。研究表明,膿毒癥發生6 h內進行液體復蘇治療的效果最好,且在24 h內如能進行及時的液體復蘇可以顯著降低膿毒癥的死亡率。膿毒癥發生24 h內進行液體復蘇可以改善嚴重膿毒癥患者的微循環,但膿毒癥持續48 h后再進行液體復蘇不能改善微循環[9]。因此,在本文中選擇膿毒癥模型建立后的12 h、24 h 和48 h 作為觀察時間點[10]。
對膿毒癥患者而言,早期液體復蘇是關鍵的干預措施。在復蘇液體的選擇上,晶體液具有價廉、保質期長并且能夠較好的達到復蘇目的等優勢,一般作為復蘇液體的首選,滲透性和電解質組成的不同晶體液會對肌體的內環境造成不同影響,相比較而言,因為生理鹽水本身的“非生理性離子配比”,故而乳酸林格液更有優勢[11]。乳酸林格液作為性質上最相似的細胞外液,廣泛用于液體復蘇。乳酸有L型和D型兩種異構體。D型乳酸會引起中性粒細胞(PMN)的活化,這可能導致組織損傷。L型乳酸能降低PMN的活化,因此具有免疫保護作用。白蛋白作為膠體液的代表性藥物之一,其能夠迅速的恢復血容量,改善微循環灌注,但并不能降低膿毒癥患者的病死率,目前的研究認為沒有一種液體是最理想的復蘇液體[12]。
一般認為在發生嚴重膿毒癥時心肌細胞線粒體膜電位會明顯降低,是由于此時過氧化物和一氧化氮(NO)等抑制電子傳遞鏈復合物活性和誘導解耦聯蛋白的活性增強,從而使質子泵出減少和加劇線粒體質子泄漏,最終使線粒體膜電位下降、ATP生成減少;而線粒體膜電位降低與線粒體膜通透性改變密切相關。一般認為液體復蘇能夠起到改善微循環、減輕血管內皮細胞損傷、改善血管通透性等一系列積極的作用,液體復蘇是膿毒癥和膿毒癥休克的基礎組成部分。我們的結果證實了持續的液體復蘇能夠維持膿毒癥大鼠的平均動脈壓,保證體循環的穩定,但在持續復蘇的過程中心肌線粒體功能仍呈現出了時間依賴性的損害,而且采用不同時長和復蘇液進行不同方式的液體復蘇均未沒有起到保護膿毒癥大鼠心肌線粒體功能、改善膿毒癥大鼠的心肌線粒體功能障礙的目的,提示導致線粒體功能損害的微循環障礙和平均動脈壓所代表的體循環之間還存在著諸多的差異。
4 結論
液體復蘇能夠維持膿毒癥大鼠的平均動脈壓,但是通過延長復蘇時間和使用包括乳酸林格氏液、生理鹽水和白蛋白在內的常用晶體或膠體液進行液體復蘇并不能取得預期的膿毒癥大鼠心肌保護作用,膿毒癥大鼠的心肌線粒體功能仍呈現時間依賴性損害。雖然膿毒癥液體復蘇在膿毒癥治療中仍然有著重要的價值,但不具備保護心肌線粒體功能的作用,因此還需要我們從其他的方面著手進行心肌線粒體的保護工作。

