金線蓮辣椒紅素/玉紅素合成酶基因CCS的克隆及表達模式分析
劉柄良,楊 琳,,付鳳玲,李晚忱,張君誠,于好強*
(1.四川農業大學玉米研究所/農業部西南玉米生物學與遺傳育種重點實驗室,成都611130;2.三明學院,福建 三明365000)
金線蓮(Anoectochilus)屬于蘭科開唇蘭屬,是多年生草本植物,俗稱金線蘭、金錢草或金草等,主要分布在福建、臺灣、廣東等亞熱帶及熱帶地區。從亞洲熱帶地區至大洋洲大約分布有40余種,我國有20個種,2個變種[1],其中福建金線蓮(Anoectochilus roxburghii)和臺灣金線蓮(Anoectochilus formasanus)是我國最具藥用價值的2個近緣種[2],其主要藥用功效是涼血祛風,除濕解毒。由于金線蓮具有株型小巧,葉型優美,墨綠色葉面鑲嵌的金色葉脈呈網狀排列等優美外觀,所以近年來被作為觀賞植物加以開發利用。由于金線蓮自然繁殖率極低,加上人工盲目采挖,已造成野生金線蓮瀕臨滅絕,福建金線蓮已于1990年納入《瀕危野生動植物物種國際貿易公約》(CITES 2003)和《中國物種紅色名錄》(CSRL2004)[3]。金線蓮不同品種存在明顯表型差異,例如,福建金線蓮葉脈呈金色[4],臺灣金線蓮葉脈呈白色,也被叫作銀線蓮[5]。隨著研究的深入,金線蓮的藥用價值和觀賞價值日漸提升,成為一方經濟的主要產業之一。
金線蓮的藥用和保健成分除了黃酮類和多糖類外,辣椒紅素/玉紅素也是其中之一。辣椒紅素/玉紅素是一種四萜類天然色素,屬于類胡蘿卜素,不僅影響金線蓮的觀賞價值,也具有較好的保健和生物藥效[6],比番茄紅素更利于人體吸收利用[7],是清除自由基的一種重要抗氧化物質。研究表明,辣椒紅素/玉紅素合酶(capsanthin/capsorubin synthase,CCS)在辣椒紅素合成的最后階段催化辣椒紅素-5,6-環氧化物轉化為辣椒紅素/玉紅素,是辣椒紅素/玉紅素合成的限速酶之一[8-9]。
J.Deruere等[10]在1994年首次從辣椒中克隆到CCS基因,并證明是其為單拷貝。隨后,Z.Jekni等[11]在2012年從百合屬的植物中也克隆到CCS基因,并證明其在改變植物顏色方面起著重要作用。S.H.Ha等[12]從辣椒中克隆到CCS基因啟動子,發現其是一個組成型啟動子。M.H.Kumagai等[13]將CCS基因轉入煙草,發現轉基因煙草葉片中的辣椒紅素含量占類胡蘿卜素總量的36%。而后,Lang Y.Q.等[14]將橙色辣椒與紅色辣椒雜交,對分離群體的CCS擴增檢測,發現CCS下游區域是保守的,橙色辣椒成熟期不能轉紅的原因是由于CCS基因上游區缺失造成的。S.Jeknic等[15]將百合的CCS基因轉入番茄中,發現CCS基因的超表達可以使番茄果實顏色發生較大的改變。此外,CCS基因的表達顯著受到不同光質和鹽脅迫誘導[16-18];這些結果均表明CCS在調控植物顏色方面起關鍵作用。
本研究通過克隆福建金線蓮和臺灣金線蓮的CCS基因,并對其序列進行生物信息學分析,用熒光定量PCR技術研究其在金線蓮不同組織,及鹽脅迫、紫外和紅光誘導下的相對表達水平。以明確福建金線蓮和臺灣金線蓮CCS基因的序列特征和表達特性,為進一步研究CCS基因功能提供參考。
1 材料和方法
1.1 試驗材料
福建金線蓮和臺灣金線蓮,均購于葉之典金線蓮生物科技有限公司。
1.2 總RNA提取與cDNA合成
將金線蓮組培苗移植在裝有營養土的花盆里,放置在25℃(晝)/20℃(夜)、相對濕度60%~70%和光照200μmol/(m2·s)(14 h)/黑暗(10 h)的光照培養室培養,生長18 w后,取長勢一致的幼苗取根、莖、葉,液氮速凍并于-70℃保存。將其余幼苗隨機分為3組,第1組轉移至帶孔的塑料泡沫板上,用Hoagland營養液培養5 d后進行鹽脅迫(100 mmol/L NaCl)處理;第2組進行紫外光照射處理(波長253.7 nm);第3組進行紅光照射處理(波長650 nm)。分別于處理前(0 h,空白對照)及處理后0.5、1、2、4、8、12和24 h,取葉片,液氮速凍-70℃保存,設置3個生物學重復,每個時間點設置3次技術重復。以Trizol法提取各樣品總RNA,再用First Strand cDNA Synthesis Kit試劑盒(TakaRa,大連)反轉錄合成cDNA。
1.3 辣椒紅素合成酶基因(CCS)開放閱讀框的克隆
根據臺灣金線蓮的轉錄組測序數據,篩選獲得CCS基因的編碼序列,采用Premier 5.0軟件設計CCS基因開放閱讀框(open reading frame,ORF)的擴增引物,上游引物為:5′-ATGAGCTCCTCCACGATCCT-3′,下游引物為:5′-TCAGGCGTGCTGCTGGTAG-3′。以空白對照的cDNA作模板,用高保真酶Prime STAR HS DNA polymerase(TakaRa,大連)進行PCR擴增。擴增總體系25μL:cDNA 1μL,5×Buffer 5μL,dNTP mix 2μL,PrimeSTAR高保真酶0.3μL,上下游引物(10μmol/L)各0.5μL,ddH2O 15.7μL反應程序為:95℃預變性3 min;之后按95℃變性30 s,61.5℃退火30 s,72℃延伸1.5 min擴增38個循環。擴增結束后,以1.5%瓊脂糖凝膠在120 V電壓下,電泳30 min。通過凝膠成像檢測目標條帶,并利用膠回收試劑盒回收純化目的條帶,并進行3′端加腺嘌呤反應,連接至pMD19-T載體。挑取陽性單克隆,菌液檢測后的陽性克隆并送上海生物工程公司測序。
1.4 CCS基因的生物信息學分析
用EXPASY在線數據(http://web.expasy.org/protparam/)對CCS基因的理化性質進行分析,使用GOR IV(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)對CCS基因的二級結構進行預測[19];通過SWISS-MODEL(https://swissmodel.expasy.org/)對CCS基因編碼蛋白進行三級結構預測;使用WoLF PSORT(http://www.genscript.com/wolfpsort.html)對CCS基因編碼蛋白進行亞細胞定位預測。下載已知植物的CCS氨基酸序列,利用Clustal W軟件進行CCS氨基酸序列的多序列比對,通過MEGA7.0工具構建系統進化樹[20]。
1.5 金線蓮CCS基因表達分析
以Primer5.0設計CCS基因的定量PCR檢測引物(表1),各樣品cDNA作為模板,參考Zhang G.等[21]的研究,以持家基因Actin作內參。用SYBR Green法在Bio-Rad CFX96型熒光定量PCR儀上進行實時熒光定量PCR(quantitative real time PCR,qRT-PCR)檢測CCS基因的表達量;反應總體系為10μL:cDNA 1μL,SYBR Green I染料(TakaRa,大連)5μL,上下游引物(10μmol/L)各0.4μL,ddH2O 3.2μL;反應程序:95℃預變性10 s,然后按95℃變性10 s,55℃退火20 s,72℃延伸20 s,延伸結束收集熒光,46個循環;之后從50℃開始,以每步0.5℃的速度升高至95℃,每個溫度保持5 s。最后用2-△△Ct法計算各樣品中CCS基因的相對表達量,并進行顯著性分析。

表1 熒光定量PCR設計和使用的引物Table 1 The primers of qRT-PCR
2 結果與分析
2.1 CCS基因的ORF序列
以空白對照的cDNA為模板,用方法2.3中設計的ORF擴增引物擴增CCS的ORF。測序及分析結果表明,福建金線蓮CCS基因的ORF全長1 461 bp,編碼486個氨基酸;臺灣金線蓮CCS基因的ORF全長1 458 bp,編碼485個氨基酸(圖1),分別命名為ArCCS和AfCCS。氨基酸序列比對發現,ArCCS與AfCCS編碼的氨基酸序列相似度高達97%,二者共有14個氨基酸位點不同,序列長度上僅相差一個氨基酸(圖2)。
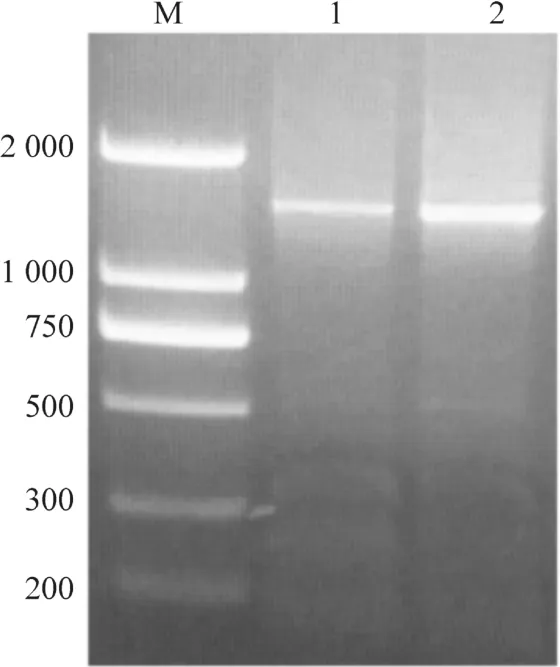
圖1 CCS基因ORF擴增片段Figure 1 The ORF fragments of CCS gene
2.2 CCS蛋白序列特征
利用ExPASy在線數據庫對CCS基因編碼蛋白的理化性質進行分析。結果表明,ArCCS蛋白質分子式為C2381H3707N667O672S33,相對分子質量為53 kD,等電點pI7.57,不穩定系數為56.88(>40),親水系數為-0.061(<0)。AfCCS蛋白的分子式為C2382H3713N671O670S32,相對分子質量為53 kD,等電點pI 8.34,不穩定系數為55.06(>40),親水系數為-0.080(<0)。說明兩種金線蓮CCS蛋白理化性質相似,均為不穩定的親水蛋白。二級結構預測結果表明,ArCCS蛋白的氨基酸序列中α-螺旋占37.86%,伸展鏈占15.43%,無規則卷曲占46.71%。AfCCS蛋白的氨基酸序列中α-螺旋占39.38%,伸展鏈占16.08%,無規則卷曲占44.54%。二者的三級結構模型也高度相似,且二者均定位于葉綠體。進化分析結果表明,ArCCS與AfCCS蛋白與百合屬的CCS蛋白相似性最高且進化關系更近,與蘋果、梨CCS蛋白的相似度及進化關系較遠(圖3),表明我們克隆到的基因序列的確是金線蓮的CCS基因。
2.3 CCS基因表達特性
qRT-PCR結果表明,ArCCS基因的表達無組織特異性,在根、莖、葉中的表達無顯著差異。然而,AfCCS基因的表達存在顯著的組織差異性,其在根中表達最低,莖中表達最高,與葉中的表達相比,差異達到極顯著水平(圖4)。

圖2 氨基酸序列比對結果Figure 2 The results of amino acid sequence alignment
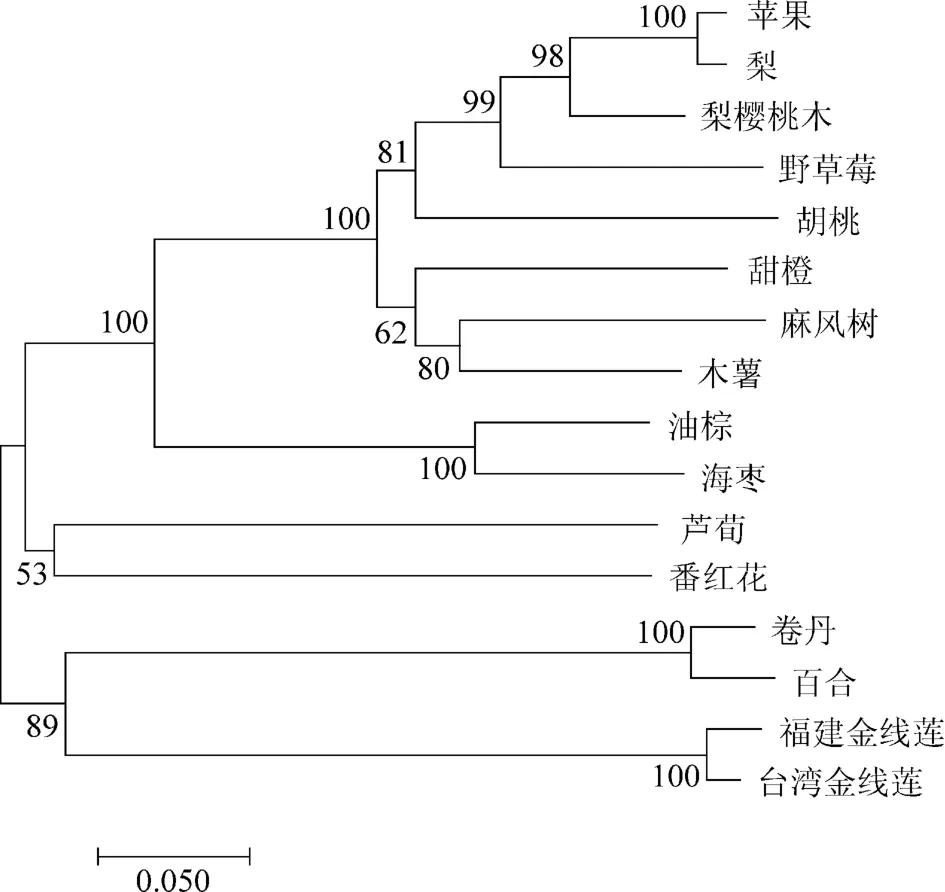
圖3 不同物種CCS蛋白的系統進化樹Figure 3 The phylogenetic tree of the CCS proteins from different species
對處理后的樣品進行qRT-PCR檢測表明,ArCCS基因的表達在鹽脅迫后表達量先升高,在1 h達到最高,隨后被抑制表達,在24 h其表達量達到最低。AfCCS基因表達受鹽脅迫誘導上調表達,處理后其相對表達量極顯著高于對照,處理后12 h其表達量達到最高(圖5)。但是,紫外處理后二者的表達模式與鹽脅迫處理后的表達模式相反,ArCCS基因表達受到紫外的誘導極顯著高表達,而AfCCS基因被紫外抑制下調表達(圖6)。在650 nm紅光處理0.5 h,ArCCS基因表達量達到峰值且極顯著高于對照(圖7),說明ArCCS基因比AfCCS基因對遠紅光的響應更迅速。
3 討論與結論
福建金線蓮和臺灣金線蓮的CCS基因序列相似度高達97%,二者長度上僅相差1個甘氨酸(圖2),我們推測這正是2個蛋白具有相似理化性質和空間折疊模型的原因。但研究結果顯示二者在不同組織器官的表達特性以及對環境脅迫的響應存在顯著差異;AfCCS基因主要在莖中表達,在根中幾乎不表達;ArCCS基因在根、莖、葉中的表達無顯著差異,無組織特異性;ArCCS基因和AfCCS基因的表達均受到鹽脅和不同光質的誘導或抑制,且差異達到顯著或極顯著水平;說明ArCCS與AfCCS基因表達受不同順式作用元件調控,推測二者的啟動子區域可能存在顯著差異。已有研究表明,CCS基因在百合、辣椒、紐荷爾臍橙等物種中表達特性也存在顯著的時空差異性或受環境因素的顯著影響[11,18,22-23]。CCS基因編碼辣椒素合成酶,催化合成辣椒紅素且與植物顏色緊密相關,CCS基因表達量越高,則辣椒紅素積累越多,植株顏色越紅[11,22-23]。福建金線蓮葉脈表現金色、莖桿淡綠,而臺灣金線蓮葉脈呈現銀色、莖桿紅色,推測ArCCS基因和AfCCS基因的組織差異表達可能是造成其表型顏色差異的因素之一;但是,福建金線蓮和臺灣金線蓮的根部顏色無明顯差異,主要是因為根部長期缺光,導致辣椒紅素無法合成。田士林[18]對辣椒CCS基因的研究表明,CCS基因受光誘導調控,既可在紅色辣椒中表達也可在淺黃色辣椒表達;但大棚栽培和套袋遮光均會降低CCS基因表達,進而減少辣椒紅素積累,影響果實顏色[24]。
綜上,本研究成功克隆到福建金線蓮和臺灣金線蓮的CCS基因,發現二者序列及其編碼蛋白具有高度的相似性,但二者的表達特性存在顯著差異并受到環境因素的顯著誘導,為一進步研究其功能提供借鑒。

圖4 ArCCS基因與AfCCS基因在根、莖、葉中的表達Figure 4 The expression of the ArCCS and AfCCS gene in the root,stem and leaf

圖5 ArCCS基因與AfCCS基因在鹽脅迫下的表達Figure 5 The expression of the ArCCS and AfCCS gene under the salt stress
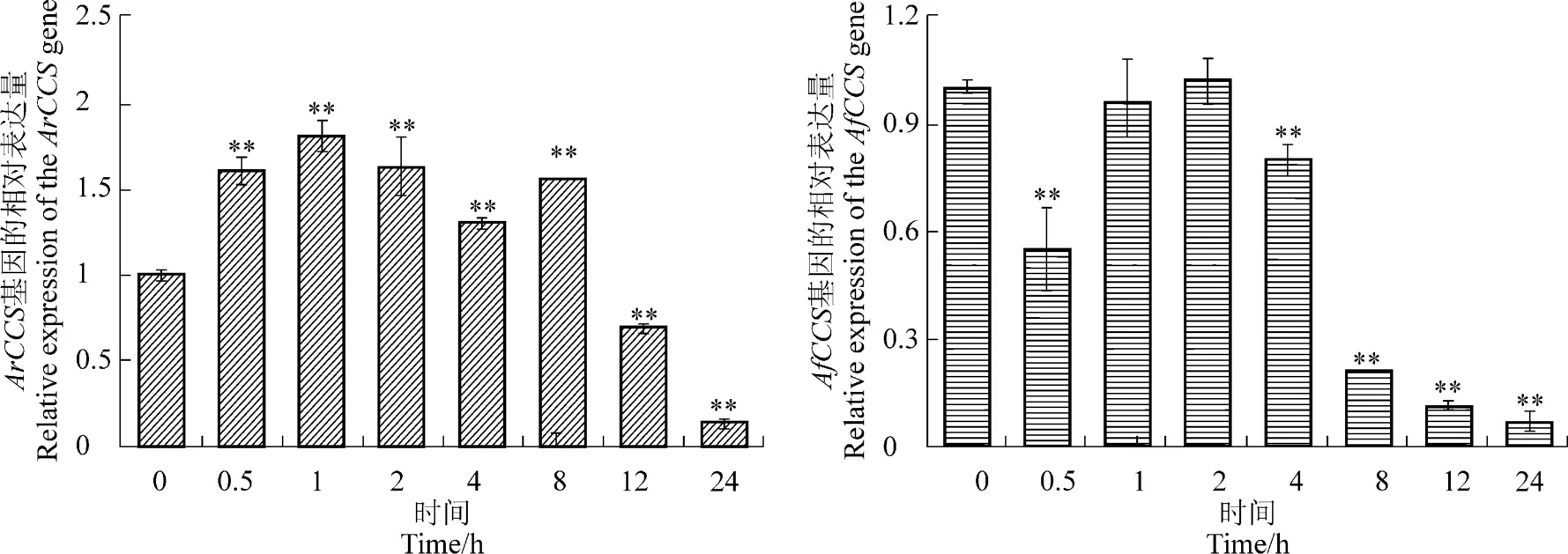
圖6 ArCCS基因與AfCCS基因在紫外光誘導下的表達Figure 6 The expression of the ArCCS and AfCCS gene under the UV stress
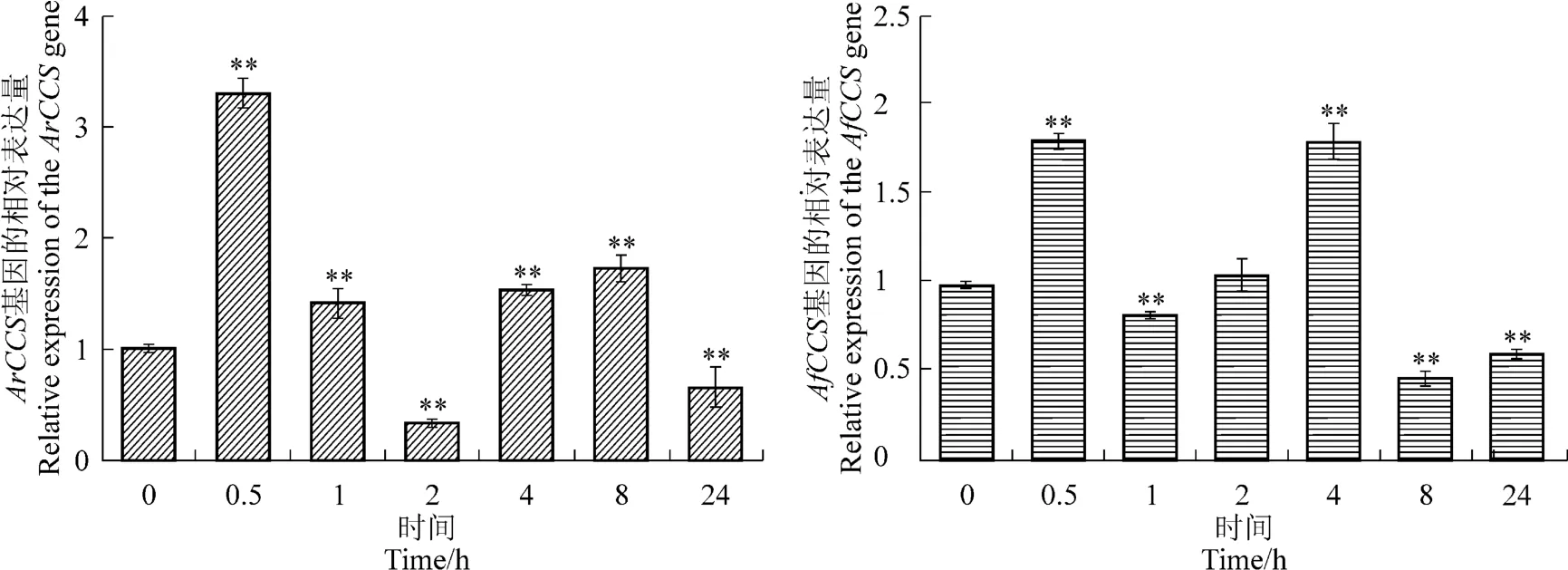
圖7 ArCCS基因與AfCCS基因在紅光誘導下的表達Figure 7 The expression of the ArCCS and AfCCS gene under the red light stress

