睡美人轉座酶對小鼠肝內膽管癌動物模型成瘤率的影響
周萬飛,黃銀久,秦中強,談 燚△
(1.蚌埠醫學院第一附屬醫院肝膽外科,安徽蚌埠 233000;2.蚌埠醫學院生物科學系,安徽蚌埠 233000)
肝內膽管癌(intrahepatic cholangiocarcinoma,ICC)是一種膽管上皮源性的、高度惡性的腫瘤[1]。在世界范圍內ICC作為肝膽系統第2常見的原發性惡性腫瘤,其發病率與病死率在我國持續增高[2]。到目前為止,根治性手術切除是ICC惟一有效的方法。
研究ICC的發病機制及病理改變的前提是建立ICC的動物模型。迄今為止,構建ICC動物模型的方法為化學方法或通過肝內直接注射腫瘤細胞的方法,如以氨基比林和亞硝酸鈉溶液作為敘利亞地鼠的飲用水,每周飲用6 d,連續飲用24周,可誘發ICC,成癌率50%[3]。ZENDER等[4]研究發現利用含有致癌基因的慢病毒感染肝祖細胞,之后注射進小鼠肝臟內,8周后誘發ICC,成癌率70%。但是以上兩種方法用時長,成癌率低。BIAO等[5]研究表明,應用水流動力學質粒轉染方法將兩種質粒NICD1和myr-AKT通過尾靜脈注射到體內可誘導ICC的發生,但是此方法無法穩定高效地建立起ICC模型。有文獻報道睡美人(sleeping beauty,SB) 轉座酶結合水流動力學轉染方法可以使靶基因在肝臟中長期穩定表達[6-7]。本研究應用水流動力學方法并結合SB100或SB13將NICD1和myr-AKT質粒注射到小鼠體內,誘導ICC形成,進而比較兩種轉座酶對成瘤率的影響,為研究ICC做好前期實驗基礎,現報道如下。
1 材料與方法
1.1實驗動物 健康昆明小鼠80只,6~8周齡,體質量20~24 g,采購自蚌埠醫學院實驗動物中心[動物許可證號:SCXK(蘇)2017-0001;合格證編號:NO.201723468]。
1.2試劑 無內毒素質粒大提試劑盒購自天根生化科技(北京)有限公司(Lot:Q5331),Anti-HA tag山羊單克隆抗體(Lot:CR138965-1)及Anti-Cytokeratin19 兔單克隆抗體(Lot:GR1234768-1)購自英國abcam公司;驢抗山羊IgG Alexa Fluor 488?Polyclonal(Lot:211346)及驢抗兔IgG Alexa Fluor 594?Polyclonal(Lot:134523)購自美國Jackson公司。誘癌質粒:pT3-EF1a-NICD1,pT3-myr-AKT-HA(human AKT1),C-luc-SB13,pCMV(CAT)T7-SB100由英國addgene公司饋贈。
1.3方法
1.3.1ICC模型的構建 將實驗小鼠分為4組,每組20只。A組小鼠通過尾靜脈注射pT3-mry-AKT-HA和pT3-EF1a-NICD1質粒聯合SB100。B組小鼠通過尾靜脈注射pT3-mry-AKT-HA和pT3-EF1a-NICD1質粒聯合SB13。C組小鼠通過尾靜脈注射pT3-mry-AKT-HA和pT3-EF1a-NICD1質粒。D組小鼠通過尾靜脈注射生理鹽水。用無內毒素質粒大提試劑盒提取pT3-EF1a-NICD1、pT3-myr-AKT-HA、SB100、SB13 4種質粒。在A組中3種質粒分別取25 μg與2 mL的0.9% NaCl溶液充分混合,通過尾靜脈在7 s內將含有此3種質粒的0.9% NaCl溶液注射入小鼠體內;B組和C組用上述同種方法將含有質粒的溶液注射入小鼠體內;D組用上述同種方法將等量0.9% NaCl注射入小鼠體內。在實驗期間,小鼠正常投喂飼料,隨意飲水。觀察4組小鼠生長情況,體質量變化,精神食欲等變化。4周后小鼠全部處死。
1.3.2組織病理學檢測ICC 將實驗組中ICC組織和對照組中正常肝組織取出,用4%多聚甲醛固定,常規石蠟包埋,之后用病理組織切片機制成10 μm的連續石蠟切片。然后將切片用蘇木素-伊紅(HE)染色,在光鏡下觀察。
1.3.3采用免疫組織化學SP法檢測ICC 將石蠟組織塊切成5 μm厚切片,于二甲苯中脫蠟2次,水化,自來水沖洗。檸檬酸緩沖液93 ℃抗原修復30 min后,室溫下驢血清封閉30 min后磷酸鹽緩沖溶液(PBS)洗3次。除去PBS后,滴加一抗(1∶200稀釋),孵化4 ℃過夜,PBS沖洗3次,每次5 min。滴加反應增強液,室溫下孵育30 min,PBS沖洗3次,每次5 min。滴加抗兔/山羊IgG聚合物,室溫下孵育30 min,PBS沖洗3次,每次5 min。滴加新鮮配制的3,3-二氨基聯苯胺(DAB)顯色試劑顯色。自來水充分沖洗,蘇木素復染,PBS返藍,乙醇脫水,二甲苯透明,中性樹膠封固。以細胞質和(或) 細胞膜上見到棕黃色顆粒分布為陽性。采用半定量方法進行判斷:無著色細胞為陰性,著色細胞小于30%為“+”(陽性),著色細胞30%~60%為“++”(中等陽性),著色細胞大于60%為“+++”(強陽性)。選擇 5個400倍視野,計數每個視野100個瘤細胞中CK19或者HA陽性細胞數。
1.4統計學處理 采用SPSS20.0 軟件進行數據分析,計數資料以頻數或百分率表示,比較采用Fisher精確概率法,以P<0.05為差異有統計學意義。
2 結 果
2.1誘癌質粒提取結果 使用酶標儀測4種質粒濃度均在1 μg/μL以上,A260/A280在1.8~2.0。分別取1 μL誘癌質粒上樣1%凝膠電泳,見圖1。
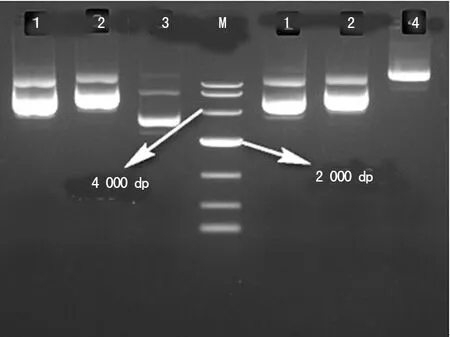
M:takara DL10000 DNA Marker;1:pT3-myr-AKT-HA;2:pT3-EF1a-NICD1;3:pCMV(CAT)T7-SB100;4:C-luc-SB13
圖1 4種誘癌質粒的DNA凝膠電泳
2.2小鼠ICC發生情況 A、B組小鼠在實驗期間均未發生死亡,隨著實驗時間的延長,實驗組小鼠逐漸出現精神萎靡,食欲減退,體質量減輕,毛發失去光澤,部分呈現出嗜睡狀態。A組中有7只腹水明顯,B組中有4只腹水明顯,而對照組精神食欲正常,體質量無明顯變化。4周后處死全部小鼠,對照組肝臟無
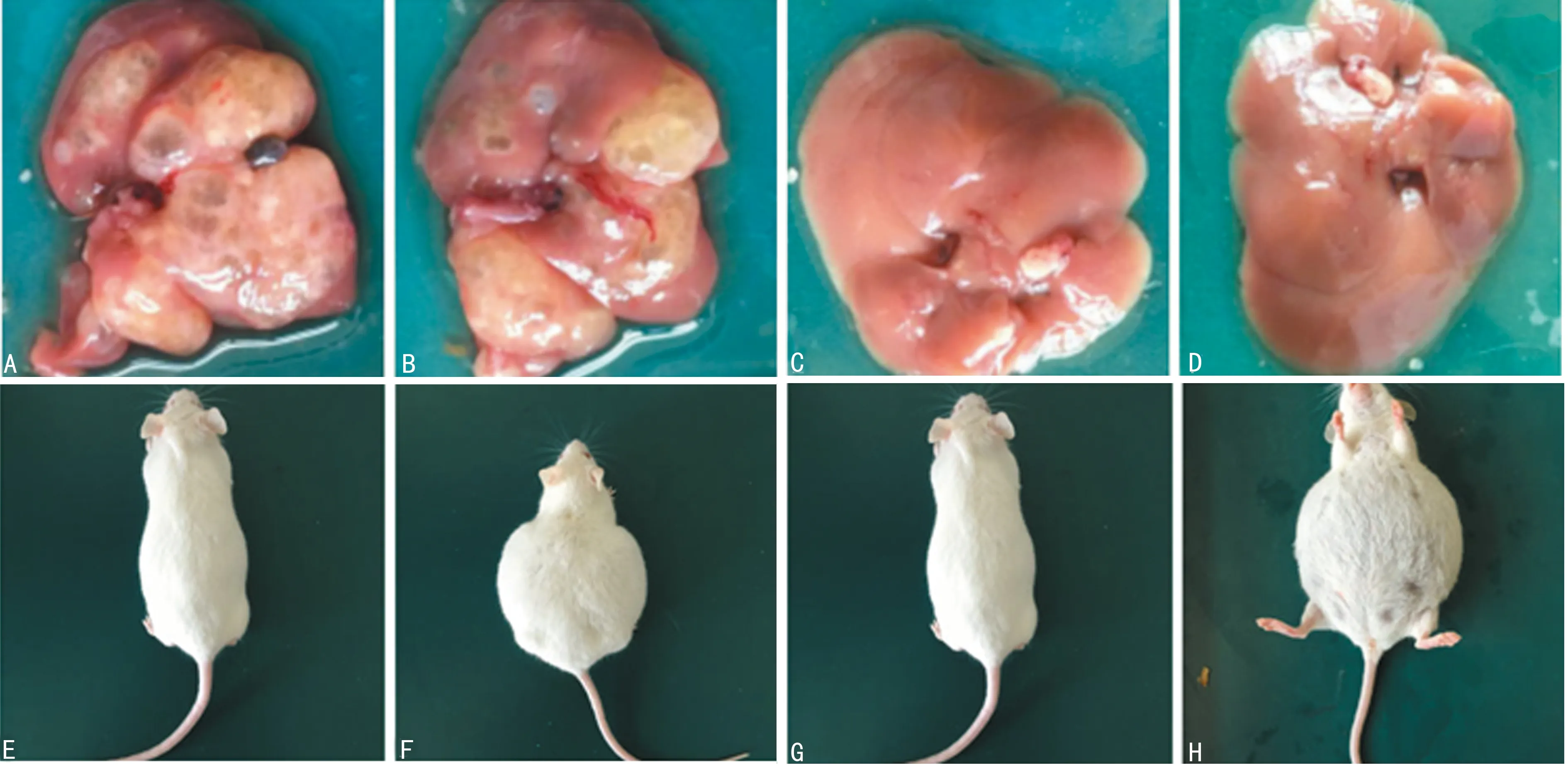
A:A組小鼠腫瘤生長情況;B:B組小鼠腫瘤生長情況;C:C組小鼠腫瘤生長情況;D:D組小鼠腫瘤生長情;E:C組小鼠腹水情況;F:A組小鼠腹水情況;G:D組小鼠腹水情況;H:B組小鼠腹水情況
圖2 ICC病理及小鼠腹水情況
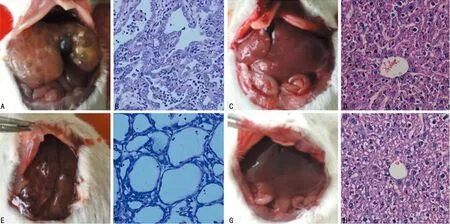
A:A組肝臟組織呈多灶囊泡狀改變;B:A組肝臟組織鏡下形態;C:C組肝臟組織表面光滑未見異常改變;D:C組肝臟組織鏡下形態;E:B組肝臟組織呈多灶囊泡狀改變;F:B組肝臟組織鏡下形態;G:D組肝臟組織表面光滑未見異常改變;H:D組肝臟組織鏡下形態
圖3小鼠ICC腫瘤組織標本及石蠟切片(HE,×400)
明顯變化。A組小鼠全部成癌,成癌率100%,B組小鼠中14只成癌,成癌率70%,兩組成癌率比較,差異有統計學意義(P<0.05)。肝臟表面可見多結節狀腫塊,切面灰白質脆,呈魚肉狀,伴多囊形成,囊徑0.4~1.0 cm,內含清亮液體,見圖2。
2.3組織病理學變化 經HE染色鏡下實驗組腫瘤組織呈彌漫性生長,部分呈小片狀分布,累犯周邊肝小葉。腫瘤組織中可見形狀不規則的腺管樣結構,部分呈乳頭狀生長。瘤細胞形狀不一,大小不等,多呈低柱狀或立方狀單層排列,部分細胞呈復層排列。細胞核大,深染,部分可見核分裂。胞質少,染色深。局部瘤細胞間質血管豐富,腫瘤間質及腺管樣結構內可見炎性細胞浸潤。腫瘤周圍部分血管充血淤血明顯。胃、胰腺、腎等器官未見腫瘤轉移。對照組細胞結構完整,核型一致,見圖3。
2.4免疫組織化學結果 CK19免疫組織化學定位于細胞質,A組中ICC瘤細胞45%(9/20)中等陽性表達,55%(11/20)強陽性表達;B組中ICC瘤細胞40%(8/20)中等陽性表達,60%(12/20)強陽性表達;C組、D組無陽性表達。AKT-HA定位于細胞質及細胞膜,A組中ICC瘤細胞60%(12/20)強陽性表達,40%(8/20)中等強陽性表達;B組中ICC瘤細胞35%(7/20)中等陽性表達,65%(13/20)強陽性表達;C組、D組中無陽性表達,見圖4。
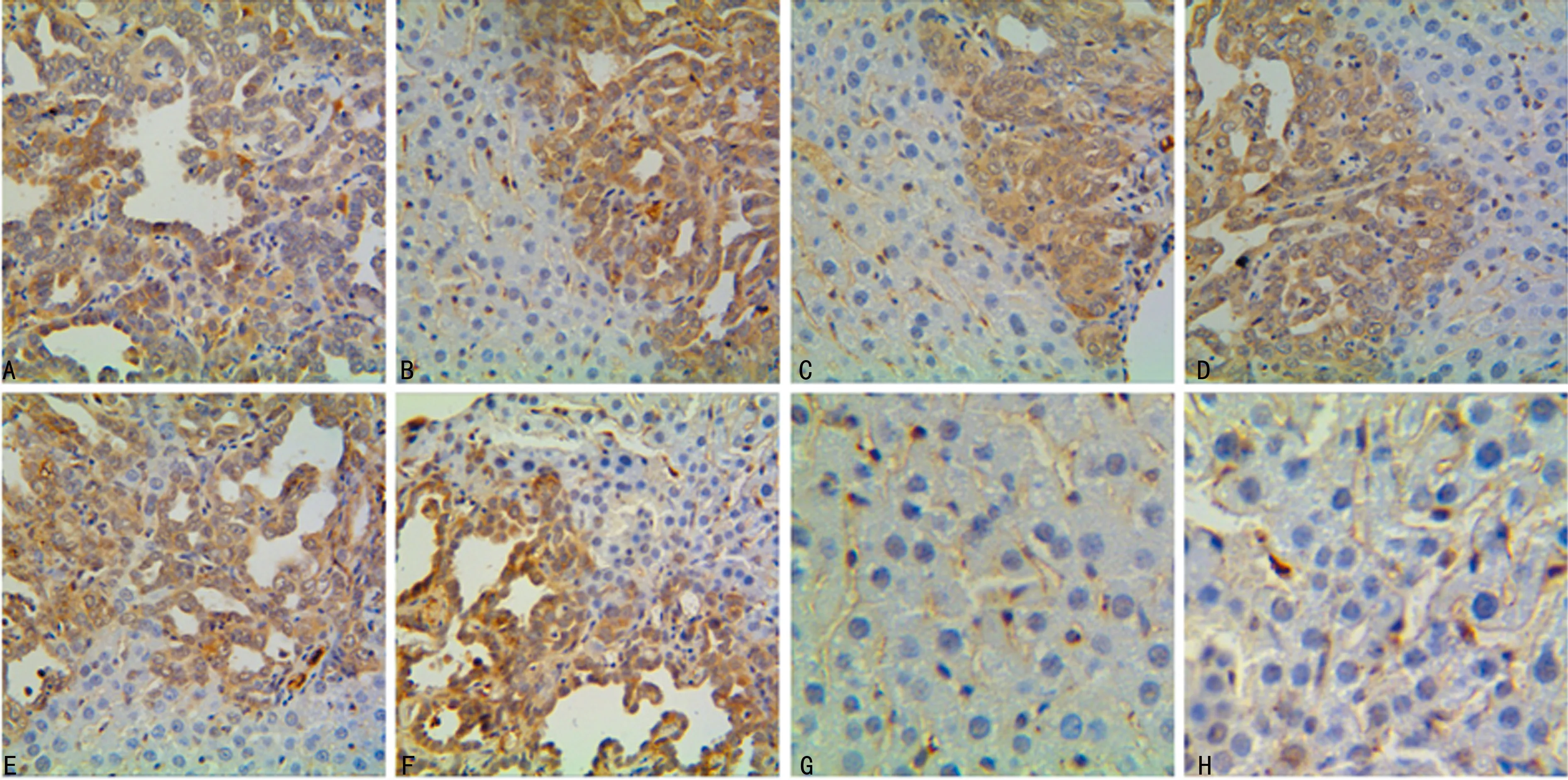
A:A組 ICC肝臟組織CK19蛋白表達于腫瘤細胞細胞質中顯示是膽管細胞分化;B:A組 ICC肝臟組織中HA蛋白表達于腫瘤細胞細胞膜、細胞質;C:B組肝臟組織中CK19蛋白表達于腫瘤細胞細胞質中顯示是膽管細胞分化;D:B組肝臟組織中HA蛋白表達于腫瘤細胞細胞膜、細胞質;E:C組肝臟組織中CK19免疫組織化學表達陰性;F:C組肝臟組織中HA免疫組織化學表達陰性;G:D組肝臟組織中CK19免疫組織化學表達陰性;H:D組肝臟組織中HA免疫組織化學表達陰性
圖4小鼠ICC實驗組及對照組免疫組織化學結果(×400)
3 討 論
EVERT等[8]研究發現單獨激活Notch信號通路雖然可以單獨促進ICC的發展,但周期較長,一般為20~25周。ZENDER等[9]發現Notch信號通路和AKT信號通路在ICC形成和發展中具有重要作用,二者結合可以加速ICC發展。水流動力學質粒轉染方法是一種全新的體內基因轉移技術。ZHANG等[10]認為,水流動力學注射是一個物理過程,肝內皮細胞窗在高壓情況下增大,導致肝細胞膜產生了孔隙,從而質粒DNA可通過孔隙進入肝細胞。BIAO等[5]利用表達NICD1的轉座子誘導小鼠ICC的形成,其周期為5個月。AMMRA等[11]發現SB轉座酶是第1個可以在脊椎動物細胞中進行基因轉移的轉座子,并且支持脊椎動物全面遺傳工程,包括轉基因、插入突變和治療性體細胞基因。HUDECEK等[6]發現SB轉座酶結合水流動力學轉染方法可以使靶基因在肝臟中長期穩定表達。因此本研究利用水流動力學質粒轉染方法,將誘癌質粒pT3-myr-AKT-HA (humanAKT1)、pT3-EF1a-NICD1,分別與SB100和SB13混合后通過尾靜脈快速注射入小鼠體內,建立ICC模型。以此來觀察結合兩種轉座酶后對ICC模型成瘤率的影響。實驗發現結合SB100的成瘤率高于SB13。對于未結合SB轉座酶的C組,與文獻報道一致[9],D組無明顯異常改變。
綜上所述,利用水流動力學質粒轉染法并結合SB轉座酶構建小鼠ICC動物模型具有以下優點:(1)操作簡單,成瘤概率高,可以大量制備ICC動物模型。(2)癌變過程與人類ICC發生相似,可以用于ICC發病機制,病因和治療的研究。(3)由于是無創操作,實驗動物耐受性好,病死率低,實用性強。本實驗充分比較了兩種SB轉座酶對于構建ICC模型的影響,結果表明SB100在成瘤率上顯著優于SB13。

