長鏈非編碼RNA DLX6-AS1在非小細胞肺癌中的表達及其作用研究
朱多杰,王 成,李 斌,蔣 鵬,楊建寶,宋鐵牛,魏小平,孟于琪
(蘭州大學第二醫院胸外科,蘭州 730000)
近年來,肺癌發病率和病死率持續增長,已成為全世界范圍內發病率和病死率最高的癌癥之一。在所有的肺癌中,非小細胞肺癌(NSCLC)占75%~80%。由于缺乏典型臨床表現,NSCLC的早期篩查較為困難,大部分患者在首次就診時已為晚期。此外,預后差也是目前治療面臨的嚴峻問題[1]。因此,尋找NSCLC有效的早期診斷及預后標志物具有重要的科學意義和臨床價值。目前,腫瘤的基因治療逐漸成為研究的熱點,探尋與NSCLC相關的原癌基因和抑癌基因也為診斷和治療乳腺癌提供了新的研究方向[2]。長鏈非編碼RNA(lncRNA)是長度大于200 nt的非編碼RNA,lncRNA通過調節癌細胞的增殖和凋亡發揮抑癌或促癌作用[3]。新近研究發現,NSCLC中多種lncRNA表達異常,且參與其病理發生、發展過程,如lncRNA 肺腺癌相關轉錄本1(MALAT1)[4]、生長停滯特異性RNA5(GAS5)[5]、HOX轉錄反義RNA(HOTAIR)[6]、BRAF激活的長鏈非編碼RNA(BANCR)[7]等。隨著研究的深入,新的NSCLC相關lncRNA不斷被發現。已有文獻報道,lncRNA生長停滯特異性蛋白6-反義RNA1(GAS6-AS1)在NSCLC患者的癌組織中表達上調,與肺癌組織分化程度和TNM分期呈明顯正相關[8],提示DLX6-AS1可能參與NSCLC的發生、發展。為了驗證這一推測,本研究開展了以下兩個方面的研究:(1)確證DLX6-AS1在NSCLC患者癌組織與癌旁正常組織的差異表達,并分析DLX6-AS1與NSCLC患者臨床病理參數相關性;(2)通過體外細胞實驗,運用分子生物學手段揭示DLX6-AS1對NSCLC細胞增殖和凋亡的調控。
1 資料與方法
1.1一般資料 選擇2011-2016年于本院胸外科行手術治療的23例NSCLC患者,取其癌組織及距腫瘤 2 cm外的癌旁組織,術后均經病理檢查明確。患者年齡21~68歲,其中男13例,女10例。所有患者術前均未行放化療,未服用過靶向治療藥物,并簽署知情同意書。將收集的癌組織和癌旁正常組織凍于-80 ℃保存。患者臨床病理參數如下:淋巴結轉移15例,無淋巴結轉移8例;Ⅰ~Ⅱ期12例,Ⅲ~Ⅳ期11例。
1.2方法
1.2.1細胞培養 人支氣管上皮細胞(16HBE)、NSCLC細胞系(腺癌:A549、SPC-A1,鱗癌:SK-MES-1)均購自美國ATCC公司,運用10%胎牛血清DMEM培基在37 ℃、5%CO2的恒溫培養箱中培養。
1.2.2實時定量聚合酶鏈式反應(qRT-PCR)法檢測lncRNA DLX6-AS1表達 16HBE細胞、NSCLC細胞、癌組織或癌旁組織加入適量Trizol裂解,并加入氯仿萃取并渦旋,高速離心(12 000 r/min,15 min),吸取上清液,加入異丙醇加速RNA沉淀,高速離心(12 000 r/min,10 min),傾倒上清液,加入無水乙醇洗滌沉淀,離心收集沉淀,加入焦碳酸二乙酯(DEPC)水溶解沉淀,測定RNA 濃度。取1 μg總RNA逆轉錄得到cDNA。將擴增體系(8 μL)和cDNA(2 μL)加入八聯管中。設置程序:95 ℃預變性 30 s,95 ℃變性5 s,60 ℃退火延伸31 s,共40個循環,運行程序;7300 System SDS Software分析數據,根據Ct值計算RQ值(計算公式:RQ=2-△△Ct),RQ值反映被檢測基因相對表達量。引物序列:DLX6-AS1 Forward 5′-AGTTTCTCTCTAGATTGCCTT-3′,DLX6-AS1 Reverse 5′-ATTGACATGTTAGTGCCCTT-3′;GAPDH Forward 5′-AGAGGCAGGGATGATGTTCTG-3′,GAPDH Reverse 5′-GACTCATGACCACAGTCCATGC-3′。
1.2.3細胞實驗分組 篩選siRAN活性片段分為:空白組、DLX6-AS1 干擾片段組(干擾片段 1、2、3組)和無關序列組(NC組)。檢測DLX6-AS1 siRNA對細胞增殖凋亡影響的實驗分組:空白組、DLX6-AS1 siRNA組和無關序列組。
1.2.4細胞轉染 由廣州銳博生物科技有限公司設計合成3個 DLX6-AS1 siRNA片段(片段 1、2、3)和無關序列片段。A549細胞經消化后接種于12孔培養板,待細胞匯合密度至70%左右時,將轉染試劑LipofectamineTM2000與DLX6-AS1siRNA片段37 ℃共孵20 min(包裝siRNA),將包裝好的siRNA加入細胞培基中繼續培養細胞24 h(轉染siRNA至細胞內干擾DLX6-AS1表達)。qRT-PCR檢測lncRNA DLX6-AS1 siRNA的表達,考察siRNA是否干擾成功。
1.2.5Western blot檢測蛋白表達檢測 收集A549細胞,加入蛋白裂解液[WIP裂解液:苯甲基磺酰氟(PMSF)=100∶1],裂解1 h后離心,吸取上清液,加入上樣緩沖液變性(99 ℃,7 min),運用二喹啉甲酸 (BCA)蛋白測定試劑盒檢測蛋白濃度。具體操作參照試劑說明書進行。制備10%的分離膠和濃縮膠,根據上述測定的蛋白濃度計算上樣體積(20 μg上樣量),控制電壓和時間(80 V,30 min;120 V,1 h)跑膠,濕轉法轉膜,聚偏二氟乙烯(PVDF)膜孵育一抗[B細胞淋巴瘤-2(Bcl-2)和Bcl-2相關X蛋白(Bax),均用一抗稀釋液稀釋1 000倍]4 ℃過夜,Tris緩沖生理鹽水吐溫(TBST)洗涮,二抗室溫孵育1 h,TBST洗涮,置于自動顯影儀(ChemiDocXRS成像系統)顯影,計算灰度值。
1.2.6細胞增殖檢測 采用四甲基偶氮唑藍比色(MTT)法檢測細胞活力。具體步驟如下:A549細胞接種于96孔板中,加入siRNA干擾DLX6-AS1表達后,每孔加入10 μL MTT溶液,在細胞培養箱內繼續孵育1 h。每孔加入100 μL Formanzan溶解液,在細胞培養箱內再繼續孵育4 h。放置紫外分光光度計于570 nm處測定光密度(OD)值,空白組0 h數值標化為1,所得數值計算出相對值進行比較。
1.2.7細胞凋亡檢測 細胞凋亡情況通過檢測重組人半胱天冬酶-3(caspase-3)活力和凋亡相關蛋白(Bcl-2和Bax)反映。Bcl-2和Bax蛋白表達檢測方法參照方法1.2.4進行。運用caspase-3活性檢測試劑盒檢測caspase-3活力,大致方法如下:裂解液裂解細胞,釋放出caspase-3,加入已配置好的檢測caspase-3活力的反應體系,caspase-3催化反應體系中產生pNA,置于紫外分光光度計于405 nm處測定OD值,通過pNA標準曲線計算出樣本OD值。具體實驗操作參照試劑盒說明書完成。

A:DLX6-AS1在癌組織和對應癌旁組織中的表達;B:DLX6-AS1在T1~T2和T3~T4期患者癌組織中的表達;C:DLX6-AS1在發生淋巴轉移患者和未發生淋巴轉移患者癌組織中的表達
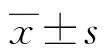
2 結 果
2.1lncRNA DLX6-AS1在NSCLC癌組織中的表達 23例NSCLC患者的癌組織和癌旁組織經qRT-PCR檢測lncRNA DLX6-AS1發現,相對癌旁正常組織、肝癌組織中lncRNA DLX6-AS1表達明顯上調(P<0.01),見圖1A。分析DLX6-AS1與患者臨床病理參數相關性,發現相比低分期患者(T1~T2)和無淋巴轉移患者,DLX6-AS1在高分期患者(T3~T4)和淋巴轉移患者癌組織中的表達更高(P<0.01),見圖1B、C。
2.2lncRNA DLX6-AS1在NSCLC細胞中表達水平 相比16HBE,NSCLC腺癌細胞系A549、SPC-A1和鱗癌細胞系SK-MES-1中lncRNA DLX6-AS1表達均上調(P<0.05),且A549增加最明顯(P<0.01),故選用A549用于后續實驗,見圖2。

圖2 lncRNA DLX6-AS1在肝癌細胞中的表達水平

A:轉染3個siRNA片段后lncRNA DLX6-AS1的表達;B:A549細胞增殖水平

A:caspase-3活力;B:促凋亡蛋白Bax水平;C:抑凋亡蛋白Bcl-2水平
2.3siRNA干擾lncRNA DLX6-AS1表達對A549細胞增殖的影響 A549細胞轉染DLX6-AS1 siRNA片段24 h后,qRT-PCR檢測lncRNA DLX6-AS1表達量。結果顯示:相比無關序列片段(NC組),3個片段均能有效干擾DLX6-AS1的表達,其中片段2的干擾效率最高(圖3A),用于后續細胞功能實驗。A549細胞經siRNA干擾DLX6-AS1表達后,分別于0、12、24、48 h運用MTT法檢測細胞活力發現,干擾DLX6-AS1可抑制A549細胞增殖(P<0.05),見圖3B。
2.4lncRNA DLX6-AS1 siRNA對A549細胞凋亡的影響 lncRNA DLX6-AS1 siRNA可增強caspase-3活力,并上調Bax表達和下調Bcl-2表達(P<0.05),見圖4。
3 討 論
非編碼RNA(ncRNA)根據長度又可分為短鏈ncRNA(≤200 nt)和長鏈ncRNA(>200 nt)。 既往lncRNA一直被認為是轉錄過程中產生的“垃圾”, 是RNA聚合酶在轉錄過程中低保真性的表現[9]。近年來,lncRNA作為原癌基因或抑癌基因受到廣泛關注,lncRNA的功能失調與包括NSCLC在內的多種腫瘤的發生密切相關[10]。MALAT1是第1個在肺癌中被研究的lncRNA。SHEN等[11]對78例NSCLC患者進行5年隨訪,發現MALAT1表達水平與患者生存期密切相關,MALAT1高表達組和低表達組患者中位生存時間分別為52和60個月。提示MALAT1與NSCLC患者預后有關,是反映預后的一個獨立因素,MALAT1高表達提示患者預后較差。GAS6-AS1是由HAN等[12]發現的一種新型lncRNA,其位于GAS6基因的下游,并以反義方向轉錄所得。相比NSCLC癌旁正常組織,GAS6-AS1在癌組織中表達下調,且與TNM分期呈負相關。GAS6-AS1的宿主基因GAS6在NSCLC癌細胞增殖、遷移、黏附和浸潤中起重要的促進作用。進一步研究發現,在NSCLC癌組織和細胞中GAS6-AS1與GAS6呈負相關,表明GAS6-AS1可能通過調控GAS6的表達參與NSCLC的發生、發展。
本研究發現,與正常組織相比,在NSCLC組織中DLX6-AS1的表達均顯著上調,提示DLX6-AS1基因可能發揮了促癌基因的作用。進一步觀察DLX6-AS1與NSCLC患者臨床病理參數(淋巴結轉移和臨床分期)呈明顯正相關,提示DLX6-AS1可能參與NSCLC的惡性增殖過程。體外細胞實驗發現,相比正常肝細胞,DLX6-AS1在肝癌細胞中表達增加,且A549細胞增加最顯著。為進一步證實DLX6-AS1是否參與調節A549的增殖和凋亡過程,本研究運用siRNA干擾DLX6-AS1表達,可抑制A549的細胞活力,增加caspase-3的活力,表明DLX6-AS1可促進A549的增殖并抑制其凋亡。
lncRNA DLX6-AS1為DLX6基因反義方向轉錄產物,DLX6基因的生物學功能尚未闡明[8],但與DLX6同家族的DLX2和DLX5在實體瘤和惡性血液病中異常表達[13-14],提示DLX家族基因可能與腫瘤發生、發展密切相關。因此,lncRNA DLX6-AS1是否調節DLX6的表達,進而參與NSCLC的發生、發展有待進一步確證。
綜上所述,本研究發現lncRNA DLX6-AS1在NSCLC癌細胞中表達上調,并參與調節癌細胞的增殖和凋亡,在NSCLC的發生、發展中起重要作用。本研究為NSCLC的防治提供新的思路和理論基礎。但lncRNA DLX6-AS1調控NSCLC細胞增殖和凋亡的具體機制尚不清楚,這將是本研究下一步工作的重點。

