白藜蘆醇對大鼠腦缺血再灌注海馬損傷的保護作用及對MMP-9表達的影響
張躍奇,王 媛,張志強,梁 霞,張桂青
(1.新疆醫科大學第五附屬醫院臨床心理門診,烏魯木齊 830000;2.新疆維吾爾自治區烏魯木齊市第四人民醫院精神一科 830000;3.石河子大學醫學院第一附屬醫院康復心理科,新疆石河子 832000)
因心臟驟停、嚴重缺氧等情況導致的短暫性腦缺血所引發的缺血性腦卒中最為多見[1]。短暫性的腦缺血會誘發大腦敏感區如海馬組織的神經細胞損傷,這些損傷往往在缺血后數天才表現出一系列的臨床癥狀,因此被稱為遲發型神經損傷。遲發型神經損傷的病理機制涉及炎癥、氧化應激、細胞凋亡、神經毒性和神經保護等多方面[2],目前尚未完全闡明。海馬區對缺血十分敏感,腦缺血會導致谷氨酸過量分泌,引發大量鈣離子進入神經細胞,從而激活多種蛋白酶,最終導致神經毒性,引起神經細胞損傷[3],甚至凋亡[4]。基質金屬蛋白酶(MMP)在中樞神經系統病理生理過程中發揮重要作用[5-6],其中MMP-2和MMP-9參與腦出血和神經損傷的病理過程[7],與腦損傷密切相關[8]。白藜蘆醇(RES)是一種有豐富生物活性的天然多酚[9],在缺血再灌注(I/R)損傷中可能起到神經保護的作用[10-11]。本研究旨在探討RES對短暫性腦缺血后大鼠神經細胞損傷的保護作用。
1 材料與方法
1.1材料 24只6周齡SPF級雄性Wistar大鼠,體質量(180±25)g,由新疆醫科大學實驗動物中心提供[許可證號:SCXK(新)2003-0001],所有大鼠為同一批次,經一般體檢均無異常。大鼠自由進食飲水,飼養于室溫20~23 ℃,濕度50%~60%,嚴格12 h∶12 h自然光照的動物房。實驗開始前適應環境1周。實驗過程嚴格遵守新疆醫科大學關于利用實驗動物開展研究的規定。
1.2方法
1.2.1實驗分組 將大鼠分為假手術組(Sham組)、I/R組和RES組,每組8只。
1.2.2右側大腦中動脈閉塞大鼠模型建立 I/R組和RES組大鼠采用國際成熟的線栓法建立動物模型[12]。Sham組大鼠操作大致與線栓法相同,區別為僅插入尼龍線約2 mm,以確保不會造成大腦中動脈阻塞。待大鼠意識恢復,將其放于通風良好的原籠中精心飼養。
1.2.3大鼠神經功能損害評價 根據預實驗情況,于手術麻醉蘇醒后10 min和I/R后72 h進行兩次大鼠神經功能損害評價。采用國際慣用5級評價標準:0分,無神經損害的癥狀;1分,不能伸展對側前爪;2分,向外側轉圈;3分,向對側傾倒;4分,不能自主行走,意識喪失[13]。
1.2.4激光多普勒大腦中動脈血流量檢測 采用激光多普勒流量計(Periflux 5000系統,Perimed公司)檢測大腦中動脈血流量,檢測的4個時間點分別為:手術麻醉蘇醒后10 min及I/R后1、24、72 h。
1.2.5RES給藥方法 采用無水乙醇溶解RES(美國Sigma公司),并用0.5%臨界膠束濃度(CMC)溶液稀釋。RES組給藥劑量為40 mg/kg,每天1次腹腔注射,造模前連續10 d給藥。Sham組和I/R組給予腹腔注射0.5%CMC,劑量及時間同給藥組。
1.2.6免疫組織化學檢測大鼠海馬MMP-9表達 造模后72 h將各組大鼠進行心臟灌注取腦,置于4 ℃的4%多聚甲醛溶液浸泡24 h。依次進行脫水、透明、浸蠟、石蠟包埋操作,之后行冠狀位連續切片,片厚3 μm。所有大鼠等間隔選取位置大致相同的海馬腦片各10張。一抗采用兔抗大鼠MMP-9(英國Abcam公司)。實驗設立空白對照(不加一抗和二抗,加磷酸鹽緩沖液)和抗體特異性對照(加一抗,不加二抗)。免疫組織化學實驗操作按照標準操作流程進行,最后中性樹脂封片鏡檢。采用Image-Pro Plus 6.0圖像分析軟件測量視野下陽性表達區域的累積光密度(IOD)和面積(area),并計算最終平均光密度值(MOD=IOD/area)。
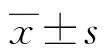
2 結 果
2.13組神經功能損傷評分 由圖1所示,手術麻醉蘇醒后10 min及I/R 72 h后進行神經功能損傷評分,I/R組和RES組的大鼠均表現出左側肢體肌力降低,而Sham組無明顯神經功能受損表現,與前兩組比較差異有統計學意義(F=75.93,P<0.01)。RES組評分明顯低于I/R組,差異有統計學意義(F=4.90,P=0.033)。I/R組I/R后72 h評分較蘇醒后10 min評分略有升高,但差異無統計學意義(P>0.05),見圖1。

圖1 3組神經功能損傷評分比較
2.2大腦中動脈血流量變化檢測 與Sham組相比,I/R組和RES組大鼠均表現腦血流量不同程度降低,差異有統計學意義(P<0.05)。隨時間延長,I/R組和RES組大鼠均表現腦血流量逐漸增加,但這兩組之間在4個時間點腦血流量比較差異無統計學意義(P>0.05),見圖2。

圖2 3組大腦中動脈血流量比較
2.3MMP-9在大鼠海馬的表達情況 3組免疫組織化學圖像由圖3所示,MMP-9主要定位于細胞質,Sham組在海馬CA1區和CA2區均未見MMP-9免疫陽性細胞表達。I/R組和RES組在海馬CA1區和CA2區均可見MMP-9免疫陽性細胞表達。Sham組在CA1區的MOD值為0.362±0.081,在CA2區的MOD值為0.349±0.044,均明顯低于I/R組(CA1區5.866±1.230,CA2區8.347±2.428)和RES組(CA1區3.715±0.925,CA2區4.582±1.642),差異有統計學意義(P<0.01)。I/R組在兩個海馬區均明顯高于RES組(P=0.011),見圖4。


圖4 MMP-9在大鼠海馬CA1區和CA2區的MOD表達水平
3 討 論
腦卒中患者認知功能、運動能力的嚴重受損大多是由于I/R損傷對大腦神經細胞的損害[14-15]。研究表明,這種缺血缺氧損傷對海馬錐體細胞的傷害尤為明顯,常引起神經細胞的凋亡改變[16]。MMP主要參與細胞外基質的降解過程,近年來病理研究發現,MMP中特別是MMP-2和MMP-9參與了中樞神經系統損傷后的許多病理過程[17]。正常狀態下,大腦MMP-9的表達處于低水平,但受到外界刺激,尤其是缺血缺氧改變,其水平會急劇升高,有研究發現,MMP表達升高可導致血糖屏障(BBB)分解,從而引發腦水腫、腦出血,甚至神經細胞不可逆損傷[18]。ZALEWSKA等[19]首次發現,MMP活性的增加可破壞細胞基質,并導致海馬神經細胞凋亡的發生。而當這種蛋白酶表達受控制時,海馬神經細胞損傷會明顯減少[20]。本研究也發現了相同的結果,即在I/R組海馬CA1區和CA2區的MMP-9水平均最高,同時這組大鼠的神經功能評分最高,因此本研究認為兩者之間可能存在相關性。通過激光多普勒儀檢測血流,本研究還發現MMP-9水平與大腦中動脈血流量之間無相關性。
RES是存在于各種植物中的多酚類物質,在植物暴露于壓力環境時會誘導這種物質的大量生成[21]。近年來研究發現RES有神經保護作用,但其機制一直未被闡明。本研究發現,大鼠I/R前預防性地給予RES 40 mg·kg-1·d-1腹腔注射,可明顯降低大鼠神經功能損傷評分。有研究表明,單次RES給藥的神經保護作用在腦內可維持4 h[22]。通過免疫組織化學研究發現RES組大鼠海馬CA1區和CA2區的MMP-9免疫陽性細胞表達均明顯低于I/R組。因此本研究認為,RES在短暫性腦缺血損傷后對大鼠海馬神經細胞有一定的保護作用,且這種神經保護作用可能與RES降低了由短暫缺血增加的MMP-9活性有關。RES在其他疾病模型的研究已多有報道[23-24],最近研究進一步發現RES參與缺血缺氧性細胞損傷中限制MMP的表達上調過程,從而抑制心臟、腎臟及大腦等臟器的缺血受損[25-26]。
綜上所述,本研究結果表明,I/R前預防性給予10 d RES 40 mg·kg-1·d-1,能有效改善大鼠神經功能損傷預后,其機制可能與RES抑制MMP-9的活性表達有關。本研究的局限性在于沒有設立RES濃度梯度,因此不能確定其劑量反應關系,還需后續進一步深入研究。

