早期白假絲酵母血流感染大鼠模型的血漿代謝組學分析
童譯慶,王秋月,李康馨,周子陽,方陽欣,唐建國
復旦大學附屬第五人民醫院創傷-急救-危重病醫學中心, 上海 200240
隨著人口老齡化、侵入性醫療操作的增加及廣譜抗生素的應用,血流感染和侵襲性真菌感染逐年增加。侵襲性真菌病是重癥監護室(intensive care unit,ICU)常見真菌病,病死率極高。白假絲酵母(Candidaalbicans,C.albicans;又稱白念珠菌)是常見的條件性致病真菌,于正常人體呼吸道、消化道、泌尿生殖道均有定植。白念珠菌移位所致感染疾病居侵襲性真菌病首位[1-3]。臨床上念珠菌血癥的診斷主要依靠血培養,但目前陽性率不高,因此尋找早期白念珠菌感染的生物標記是迄需解決的難題。
代謝組學(metabonomics)是后基因組學時代興起的跨領域學科,研究生命體被外界刺激后的病理生理變化及自身基因變化等導致的體內代謝水平的多元動態反應[4-5]。非靶向代謝組學是盡可能多地定性和相對定量生物體中的代謝物,最大限度地反映代謝物的特點。目前,超高效液相色譜-四級桿飛行時間串聯質譜(ultra-high performance liquid chromatography/quadrupole-time-of-flight tandem mass spectrometry,UHPLC-Q-TOF-MS)已廣泛用于代謝組學研究。親水互相作用色譜(hydrophilic interaction liquid chromatography,HILIC)是專門針對極性極強的代謝物而開發的色譜柱,因為其有與反相液相色譜(reversed phase liquid chromato-graphy,RPLC)互補的選擇性而得到廣泛應用[6]。研究表明,親水互相作用色譜-電噴霧電離四級桿飛行時間串聯質譜(hydrophilic interaction liquid chromatography-electrospray ionization/quadrupole-time-of-flight mass spectrometry,HILIC-ESI-Q-TOF-MS)能提供中心碳循環代謝的最大信息量,受到很大關注[7]。本研究采用HILIC UHPLC-Q-TOF-MS技術結合數據依賴性采集方式對白念珠菌感染組和對照組進行全譜分析,同時獲得一級質譜和二級質譜,然后采用XCMS軟件對數據進行峰提取和代謝物鑒定,尋找兩組的差異代謝物,為早期白念珠菌的診斷和治療提供理論基礎。
1 材料和方法
1.1 菌株來源及實驗動物
白念珠菌標準菌株ATCC 10231購自上海魯微科技有限公司。40只無特定病原體(specific pathogen free,SPF)級雄性Wistar大鼠購于上海斯萊克實驗動物有限公司,體重約250 g,其中20只用于構造白念珠菌感染模型,20只用于白念珠菌血流感染代謝組學分析。大鼠飼養于復旦大學附屬上海市第五人民醫院動物房,于實驗前適應喂養2周。
1.2 儀器和試劑
使用的儀器主要有:Triple TOF 5600+質譜儀(AB Sciex公司)、Agilent 1290 Infinity LC超高效液相色譜儀(Agilent 公司)、Eppendorf低溫高速離心機5430R (Eppendorf公司)、色譜柱(Waters公司;型號:ACQUITY UPLC BEH Amide column 1.7 μm,2.1 mm×100 mm)。試劑主要有:乙腈(Merck公司)、乙酸銨(Sigma公司)、沙氏培養基(Sabouraud dextrose agar,SDA)(上海魯微科技有限公司)、水合氯醛(廣州彬鵬公司)、氫化可的松(天津生物化學制藥有限公司)。凍存管及EP管購自生工生物工程(上海)股份有限公司,實驗用水均為Mili-Q純水儀制備的去離子水。
1.3 方法
1.3.1菌液配制及模型構造37 ℃條件下,將白念珠菌于沙氏培養基(2%瓊脂、2%蛋白胨和4%葡萄糖)行平板分離培養,隨后于沙氏液體培養基(2%蛋白胨和4%葡萄糖)中增殖培養,120 r/min搖菌48 h,測光密度(optical density,OD)并進行活菌計數,倍比稀釋至1×1010CFU/mL、1×109CFU/mL、1×108CFU/mL、1×107CFU/mL、1×106CFU/mL備用。于念珠菌感染大鼠前3 d,每只大鼠每天皮下注射氫化可的松25 mg,第4天用不同密度的菌液尾靜脈注射感染大鼠,共5組,每組4只,注射量為1 mL/100 g。感染24 h后,通過心臟取血留1 mL全血,處死大鼠,取腎臟、脾臟和肝臟組織,每只大鼠每個器官取 0.5 g組織,加入2 mL無菌生理鹽水研磨成組織勻漿。將100 μL全血和組織勻漿于37 ℃沙氏培養基行平板分離并培養48 h,然后進行菌落計數。通過觀察大鼠精神狀態、感染24 h后器官中白念珠菌負荷及該時段內大鼠存活情況來篩選合適的模型。
1.3.2動物模型建立將大鼠隨機分為白念珠菌組10只、正常對照組10只。白念珠菌組注射白念珠菌菌液(2.5×108CFU),建模方法同模型構造,正常對照組注射無菌生理鹽水,注射量均為1 mL/100 g。白念珠菌組于感染后24 h通過心臟取血收集血液標本,放入乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝管中,4 ℃ 3 000 r/min離心10 min,取上清液,分裝血漿并于 -80 ℃儲存。
1.3.3樣品預處理于4 ℃緩慢解凍后分裝,每100 μL加入400 μL預冷的甲醇/乙腈(體積比1∶1)溶液,振蕩混勻,-20 ℃靜置10 min。4 ℃ 14 000 r/min離心15 min,取上清液,凍干,用100 μL乙腈/水(體積比1∶1)溶液復溶待用。
1.3.4樣品分析條件①色譜條件:采用Agilent 1290 Infinity LC超高效液相色譜系統HILIC進行分離,柱溫25 ℃,流速 0.3 mL/min,進樣量2 μL。流動相組成A:水+25 mmol/L乙酸銨+25 mmol/L氨水;組成B:乙腈。洗脫程序如表1所示。②質譜條件:采用ESI模式。超高效液相色譜分離后,用Triple TOF 5600+質譜儀進行分析:霧化氣氣壓60 psi(413 685 Pa),輔助氣氣壓60 psi(413 685 Pa),氣簾氣壓30 psi(206 842 Pa),溫度600 ℃,毛細血管電壓 5 500 V,去簇電壓±60 V,碰撞能量(35±15)eV。TOF-MS掃描范圍:60~1 000 Da;子離子掃描范圍:25~1 000 Da。TOF-MS掃描累積時間 0.20 s/譜圖,產物離子掃描累積時間 0.05 s/譜圖。二級質譜采用信息依賴性采集(information-dependent acquisition,IDA),高靈敏度模式。
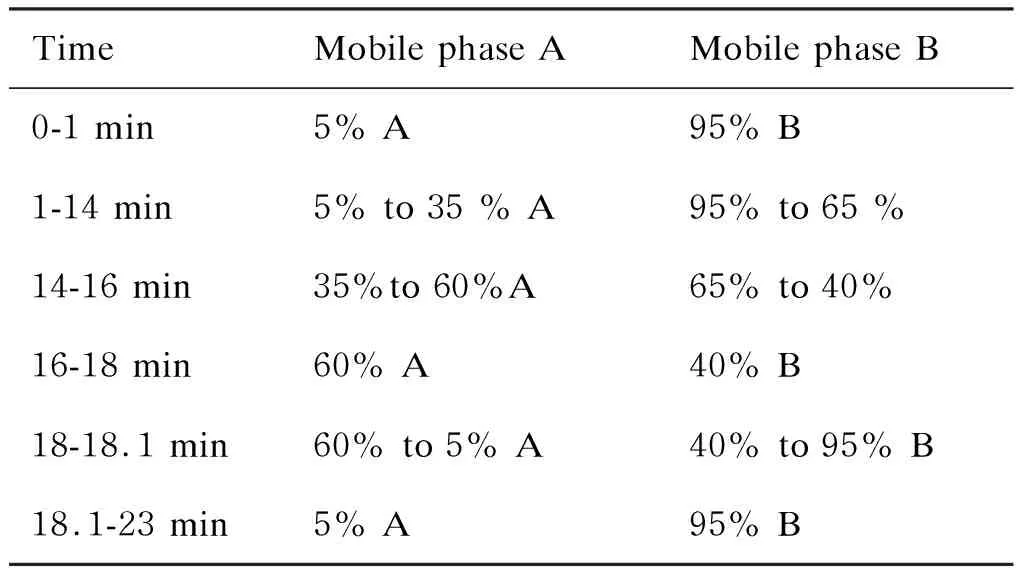
表1 色譜洗脫程序
1.4 數據分析
原始數據通過XCMS軟件進行鋒對齊、保留時間矯正和提取峰面積。對XCMS軟件提取的數據,刪除組別總和>2/3的離子峰,應用SIMCA-P14.1 版本(瑞典Umetrics公司)進行模式識別,Pareto-scaling預處理后進行多維統計分析,包括無監督的主成分分析(principal component analysis,PCA)、有監督的偏最小二乘法判別分析(partial least squares discrimination analysis,PLS-DA)和正交偏最小二乘法判別分析(orthogonal PLS-DA,OPLS-DA)。選擇變量投影重要度(variable importance in the projection,VIP)>1作為差異代謝物的選擇標準,將這些差異代謝物的質核比(m/z)與網絡數據庫如HMDB(http://hmdb.ca)、METLIN(http://metlin.scripps.edu)等對比,初步確定差異物的相對分子質量及結構式,然后根據分子式及質譜圖、標準品保留時間、質核比等確定差異代謝物。采用R(3.4.4 版本)軟件對代謝物的樣品表達進行聚類分析。采用GraphPad 6軟件進行統計分析,差異代謝物的單變量比較采用t檢驗,P<0.05為差異有統計學意義。根據白念珠菌組與對照組的差異代謝物建立受試者工作特征曲線(receiver operating characteristic curve,ROC),計算曲線下面積(area under curve,AUC)及95%CI。最后,在KEGG網站(http://www.kegg.jp)對代謝物進行Pathway富集分析。
2 結果
2.1 大鼠模型
對沙氏培養基上的菌落進行計數,大鼠內臟分布的白念珠菌負荷如表2所示。挑選感染后24 h時肝臟、脾臟、腎臟及血液中均有白念珠菌菌落且存活的大鼠的白念珠菌密度作為建模所需的白念珠菌密度。

表2 大鼠各器官及血液中白念珠菌負荷
Approximate CFU ofCandidaper 100 mL of tissue homogenates or blood cultured on SDA plates.
建模結果如表2所示,第1組大鼠(注射 2.5×1010CFU白念珠菌)于16 h內全部死亡,未取血液及器官樣本;第2組大鼠(注射 2.5×109CFU白念珠菌)于24 h內死亡3只,存活大鼠的血培養及肝、脾、腎組織勻漿中白念珠菌培養均陽性;第3組大鼠(注射 2.5×108CFU白念珠菌)于24 h內全部存活,2只血培養陽性,大部分器官組織勻漿中白念珠菌培養陽性,符合本研究系統性白念珠菌感染的建模要求;第4、5組(注射 2.5×107CFU、2.5×106CFU白念珠菌)大鼠于24 h內全部存活,僅1只血培養陽性,組織勻漿中均培養出白念珠菌,但陽性率較低,發現白念珠菌血流感染早期易發生于泌尿系統。第1~4組大鼠感染白念珠菌后24 h出現精神萎靡、飲食不積極、嗜睡、活動不積極、尾巴毛濕潤等癥狀。
2.2 血漿代謝譜圖
采用OPLS-DA、PLS-DA、PCA模型分別進行模式識別,結果見圖1。PCA、OPLS-DA及PLS-DA均能區分兩組。PCA模型的參數主要參考R2X的值,R2X越接近1,表明模型越穩定可靠,一般 R2X>0.5 的模型可靠性較好。對兩組進行PCA分析,R2X為 0.601 時PCA模型能較好地區分兩組。R2Y和Q2分別為SIMCA軟件中PLS-DA和OPLS-DA模型的參數,R2Y表示模型對Y軸的解釋能力,Q2表示模型的預測能力。R2Y和Q2越接近1,表明模型越穩定可靠,一般Q2>0.5的模型穩定可靠。PLS-DA模型中,R2Y為 0.976,Q2為 0.834,表示PLS-DA模型能解釋兩組 97.6% 的差異,準確預測樣品組別 83.4%。OPLS-DA模型中,R2Y為 0.976,Q2為 0.886,表示OPLS-DA模型能解釋兩組 97.6% 的差異,準確預測樣品組別 88.6%。結果提示,OPLS-DA、PLS-DA、PCA均能很好地鑒別白念珠菌組與對照組,兩組代謝物的生物差異明顯。
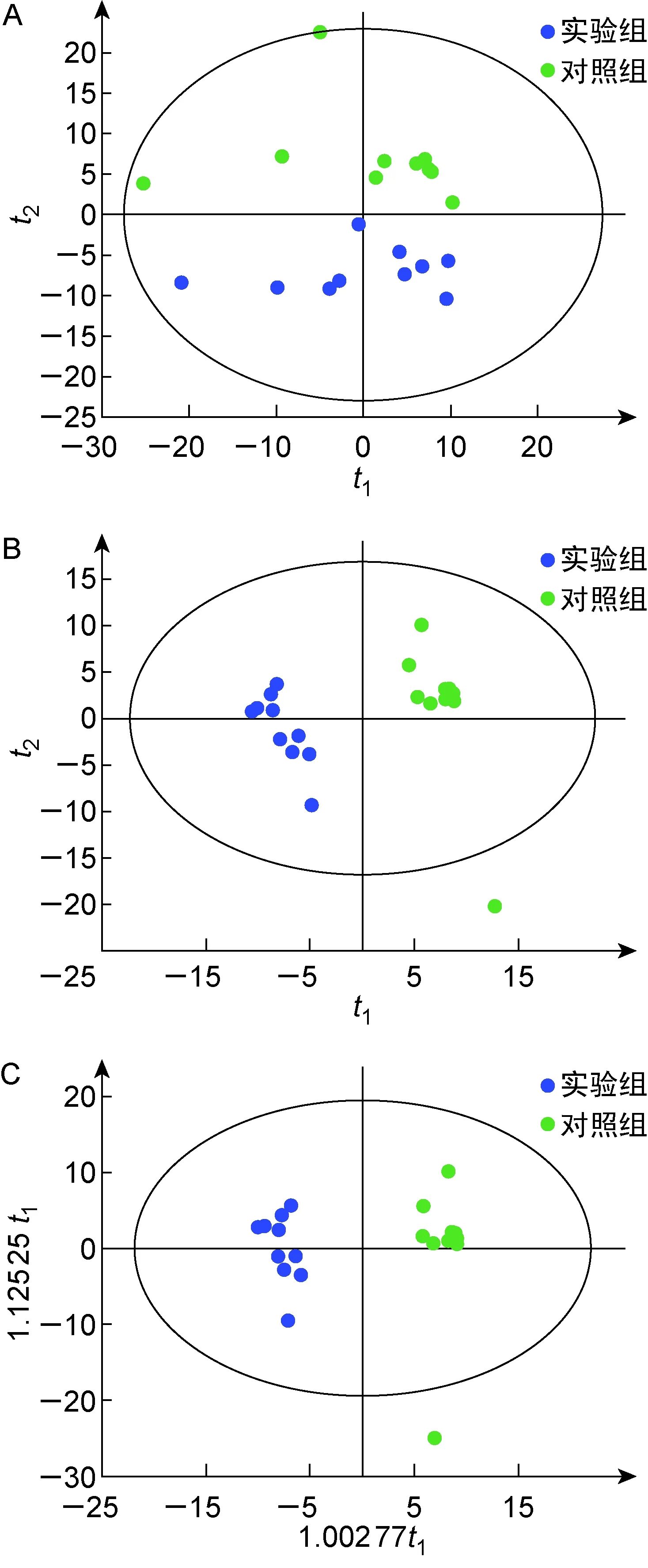
A: PCA. B: PLS-DA. C: OPLS-DA
2.3 對差異標記的篩選
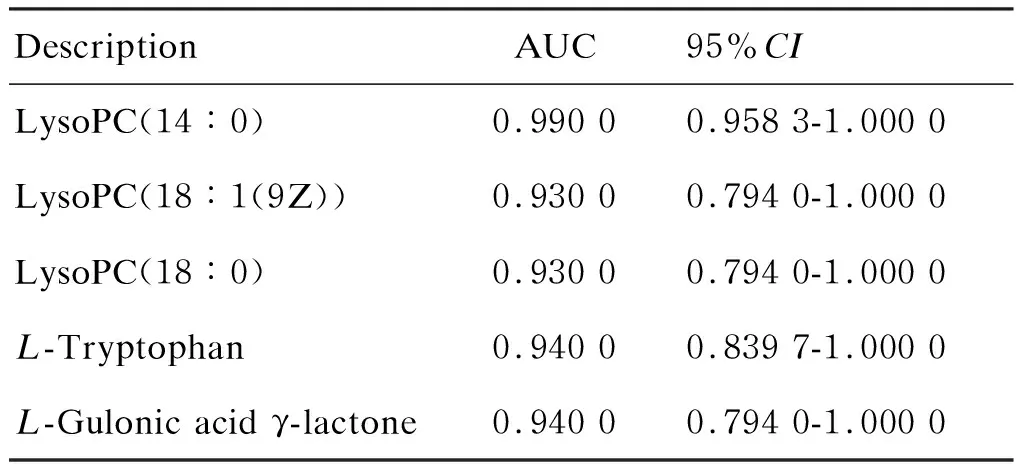
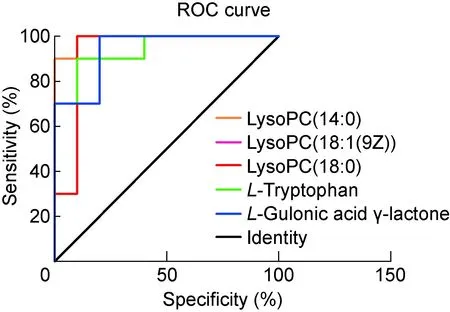
通過計算PLS-DA模型中的VIP值來衡量各代謝物的表達模式對各組樣本分類判別的影響強度和解釋能力。一般以VIP>1作為候選蛋白標記的標準。本研究選擇同時具有多維統計分析篩選標準(VIP>1)和單變量統計分析篩選標準(P<0.05)的代謝物作為具有顯著性差異的代謝物,VIP>1且 0.05 表3 代謝的差異標記 對質譜采集及篩選的候選生物標記在白念珠菌組與對照組之間的差異進行t檢驗和ROC分析,進一步篩選和評價。結果顯示,這18個代謝產物在白念珠菌組血漿與對照組血漿中有明顯差異(P<0.05)(表3)。其中LysoPC(14∶0)、LysoPC(18∶1(9Z))、LysoPC(18∶0)、L-Tryptophan、L-Gulonic acid γ-lactone這5個代謝物AUC值均>0.90(圖2,表4)。 為更加直觀地顯示代謝物的差異性及代謝物在各組中的表達差異,對差異代謝物的表達進行層次聚類(hierarchical clustering),結果見圖3。將得到的差異代謝物提交至KEGG網站,獲得33條代謝相關通路。分析相關通路,mTOR信號通路及cAMP信號通路引起了關注(圖4)。 表4 候選標記的ROC分析 圖2 候選標記的ROC分析 近年來,隨著腫瘤發病率上升、人口老齡化及廣譜抗生素應用,深部真菌感染已成為重要的醫院內感染。盡管不斷有新的抗真菌藥物出現,但侵襲性真菌病的病死率仍居高不下,帶來了沉重的醫療負擔。白念珠菌感染是ICU常見真菌病,病死率極高[8],但其確證主要依靠陽性率并不高的血培養,因此如何早期診斷和有效控制成為刻不容緩的公共衛生話題。目前,國內外對白念珠菌的研究主要集中在基因組學和蛋白組學,代謝組學研究較少。但代謝物是細胞調控過程的終產物,其種類和數量變化被視為宿主對基因或環境變化刺激的最終響應,與生物體的功能活動變化有更加直接的聯系。 本研究采用HILIC UHPLC-Q-TOF-MS技術結合數據依賴性采集方式,對白念珠菌感染組和對照組進行全譜分析,獲得一級質譜和二級質譜,尋找兩組的差異代謝物。對數據進行矯正和歸一化處理后,采用SIMCA軟件對數據進行判別。PCA是一種非監督的數據分析方法,將原本鑒定到的所有代謝物重新進行線性組合,形成一組新的綜合變量,根據所分析的問題從中選取幾個綜合變量,使它們盡可能多地反映原有變量的信息,從而達到降維的目的[9]。與PCA不同,PLS-DA和OPLS-DA為有監督的判別分析統計方法[10],采用它們建立代謝物表達量與樣品類別之間的關系模型,可實現對樣品類別的預測[11]。OPLS-DA是在PLS-DA的基礎上進行修正,濾除與分類信息無關的噪聲,提高了模型的解析能力和有效性[12]。本研究中這3種模型均能將白念珠菌組與對照組區分,表明兩組代謝物存在生物差異。OPLS-DA和PLS-DA通過R2Y和Q2對模型進行評價,比PCA通過單一的R2X對模型進行評價有更好的穩定性。PCA非監督的模型判別可能受實驗誤差、生物個體差異等因素的干擾。OPLS-DA通過正交方法濾除無關噪聲,可提高模型判別效率。 本研究結果表明,白念珠菌組與對照組大鼠血漿代謝組學存在明顯差異,最終確定18個代謝產物可能為白念珠菌代謝差異產物,大部分屬短肽類,主要參與代謝、碳循環、保持細胞膜的穩定性及維持生理穩態。其中,L-色氨酸、吲哚乳酸及L-亮氨酸已有其他文獻證實在維護腸道穩態、防止腸源性念珠菌移位、維持哺乳動物腸道免疫平衡中發揮重要作用[13-14]。白念珠菌可通過改變宿主的色氨酸代謝來抑制白細胞介素17(interleukin 17,IL-17)的產生及調節IL-22的產生,從而改變宿主抗真菌的防御能力[13,15-16]。本研究中L-色氨酸的高表達可能與宿主體液免疫激活有關。L-亮氨酸是宿主免疫和腎臟疾病中的重要代謝產物,亮氨酸及亮氨酸氨基肽酶在急性肝損傷、腎損傷和慢性腎臟疾病中升高。本研究中亮氨酸升高可能與白念珠菌血癥導致腎臟損傷有關。既往研究證實,LysoPC有抗感染和抗炎作用[17-18],本研究質譜結果也顯示LysoPC增高,可能與宿主抗感染代謝途徑有關。LysoPC(14∶0)、LysoPC(18∶1(9Z))、LysoPC(18∶0)、L-Tryptophan、L-Gulonic acid γ-lactone這5個代謝物AUC值均>0.90,高于G實驗用于深部真菌診斷的AUC值 0.83 及真菌血培養的AUC值 0.73[19-20]。本研究是對白念珠菌感染生物標記進行的初步探索,所得結論需更多臨床樣本來驗證和支持。在富集到的33條通路中,mTOR信號通路及cAMP信號通路引起注意。mTOR信號通路通過整合細胞外的營養、能量及生長因子等多種信號來調節宿主免疫應答,是細胞自噬的關鍵調節點。本研究在通路分析中所富集到的mTOR信號通路可能與宿主通過抑制mTOR來調節自身免疫應答以應對真菌感染有關。此外,cAMP信號通路是一條細胞內經典信號通路,細胞受外界刺激后可通過cAMP信號通路調節細胞內基因轉錄,這條通路的激活可能與白念珠菌引起的促炎反應有關。 本研究表明,采用UHPLC-Q-TOF-MS研究白念珠菌感染Wistar大鼠中血漿代謝物方法可行,PCA、OPLS-DA及PLS-DA均可區分代謝物的差異表達。OPLS-DA及PLS-DA通過有監督的方法減少誤差,為尋找白念珠菌早期感染的血漿代謝標記奠定了基礎。初步篩選出的18個差異代謝物,可能是大鼠血漿代謝差異物。本研究也有不足之處:首先,建立模型時,由于設備條件有限,未能在更早時間(12 h內)建立白念珠菌感染模型而更早診斷和治療白念珠菌感染以降低病死率。其次,用于質譜檢測的樣本量較小,進行標記評價時可能導致檢驗效能降低。最后,本研究為白念珠菌血癥生物標記的初步探索,缺乏后續的標記驗證。未來將在白念珠菌感染患者血漿中做進一步的靶向驗證,為早期診斷和治療提供可靠的臨床依據。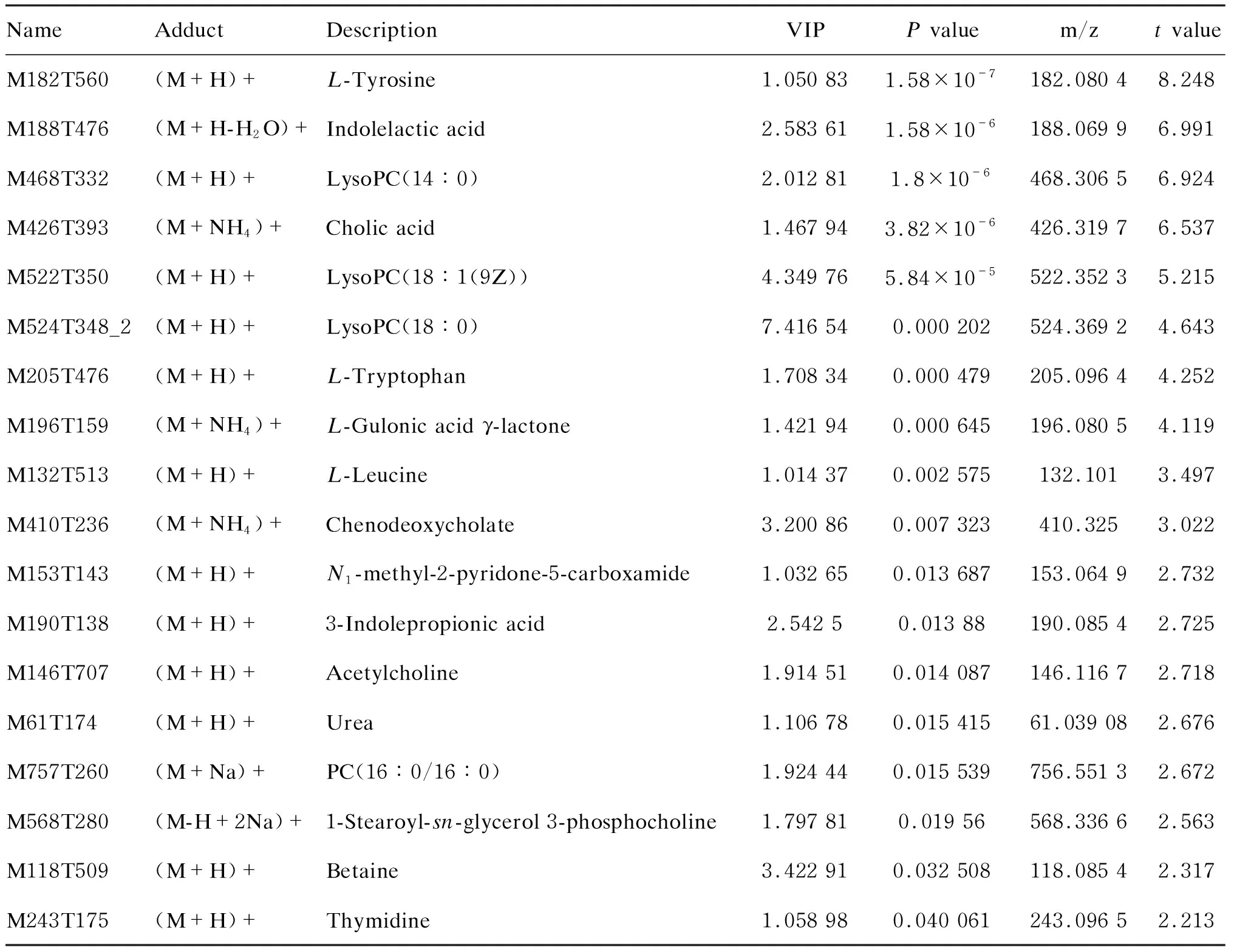
2.4 對候選標記的ROC分析
2.5 聚類分析與通路分析
3 討論

