葡萄糖轉運蛋白在血糖穩態調節中的功能
張凱藝, 謝 寧, 葉華瓊,2, 楊述林*
1.中國農業科學院北京畜牧獸醫研究所, 北京 100193;2.安徽科技學院動物科學學院, 安徽 滁州 233100
葡萄糖是人體的主要供能物質,其代謝過程中產生的各種中間產物也可為其他營養物質的代謝提供碳架和前體。機體的血糖水平受到多種因素的精密調節,血糖過低會引起中樞神經系統損傷;血糖過高則會造成多種組織器官大血管和微血管糖毒性傷害。血糖穩態失衡與肥胖、糖尿病、非酒精性脂肪肝等多種代謝性疾病的發生密切相關。國際糖尿病聯盟2017年底統計結果顯示,全世界糖尿病患者人數已達4.25億[1],其中以胰島素抵抗(insulin resistance,IR)并伴有胰島素分泌不足為特征的T2DM患者約占90%。T2DM的發生受遺傳、飲食和生活方式等綜合因素影響,病因多樣,發病機制復雜,目前仍缺乏有效治療方案。通過全基因組關聯分析,人們已經篩選出100多個T2DM易感基因[2],其中已成功應用于基因診斷和藥物開發的基因包括:鉀離子通道蛋白(KCNJ11)、胰高血糖素樣肽-1受體(GLP-1R)、過氧化物酶體增殖物激活受體γ(PPARγ)等基因[3~5],它們在胰島素分泌、糖脂代謝和細胞增殖等關鍵通路中發揮重要作用。
血糖穩態的調控依賴多個組織器官的協同作用,各組織通過吸收、消耗、儲存葡萄糖或釋放激素及代謝產物來感知或調節血糖[6]。葡萄糖轉運蛋白(glucose transporter, GluT)由SLC2A(solute linked carrier family 2, subfamily A)基因編碼,包括3組共14個成員,其中Ⅰ組GluT(GluT1、GluT2、GluT3和GluT4)在體內分布最廣泛、表達量最高,發揮最主要的葡萄糖轉運功能[7, 8]。Ⅰ組GluT成員的底物轉運特性與其分布組織在血糖穩態調節中的功能相適應(表1)。GluT1具有與基礎血糖相近的Km值,維持全身各組織器官葡萄糖攝取效率的穩定[9];GluT2對葡萄糖具有低親和力和高轉運效率,對高糖環境敏感,有助于肝臟高效發揮血糖調節的功能,并在神經系統的葡萄糖感受中起到關鍵作用,已成為糖尿病藥物研發的重要靶標[10];GluT3的底物親和力最高,保證中樞神經系統優先利用葡萄糖[11];GluT4是Ⅰ組GluT中唯一胰島素敏感的轉運蛋白,骨骼肌和脂肪的胰島素敏感性依賴于GluT4的功能;GluT4表達與囊泡轉位缺陷與T2DM患者外周組織的IR密切相關,已成為抗T2DM藥物開發研究的熱點[12]。目前,從機體血糖穩態整體調節角度對Ⅰ組GluT功能及作用的系統介紹較少。本文分別對胰島、肝臟、脂肪、骨骼肌、神經系統和大腦等關鍵組織在血糖穩態調節中的作用,以及Ⅰ組GluT在這些組織中的功能進行闡述,以期為T2DM及相關代謝疾病的診斷、治療和動物模型構建等提供參考。

表1 Ⅰ組葡萄糖轉運蛋白的分布與功能Table 1 Distribution and function of Class Ⅰ of GLUTs.
1 GluT在胰島β細胞中的作用
胰島在機體血糖穩態調控的過程中發揮核心作用,機體主要的兩大血糖調節激素——胰高血糖素和胰島素,分別由胰島α細胞和胰島β細胞合成分泌。胰島β細胞感受血糖升高并分泌胰島素的過程被稱為葡萄糖刺激的胰島素分泌(glucose-stimulate insulin secretion,GSIS):餐后血糖上升,經GluT進入β細胞的葡萄糖增加,并在葡萄糖激酶(glucose kinase,GK)的作用下迅速轉化為6-磷酸葡萄糖(G6P),其進入線粒體氧化分解,產生大量ATP;ATP/ADP比的升高導致ATP依賴性K+通道關閉,使膜發生去極化,引起電壓門控性Ca2+通道開放,Ca2+內流,導致胰島素的釋放(圖1)。葡萄糖磷酸化為G6P的過程是GSIS及胰島素釋放的限速步驟,GK基因缺陷會導致青少年患成人型糖尿病(MODY)。雖然葡萄糖轉運并不是胰島素分泌的限速步驟,但GluT與高Km的GK共同構成了β細胞對血糖的感受器,起著允許作用[13],β細胞的葡萄糖轉運過程是GSIS必須的。
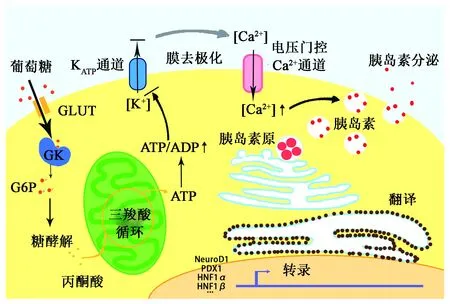
圖1 胰島β細胞GSIS的機制Fig.1 Mechanism of GSIS in islet β-cells.注:GLUT:葡萄糖轉運蛋白;GK:葡萄糖激酶;G6P:6-磷酸葡萄糖;PDX-1:胰腺十二指腸同源盒因子1;HNF1α:肝細胞核因子-1α;HNF1β:肝細胞核因子-1β。
值得注意的是,嚙齒動物與人類β細胞表面的GluT種類存在差異,嚙齒動物β細胞以低底物親和力的GluT2(Km≈16.2mmol/L)為主要葡萄糖載體,而人類β細胞以較高底物親和力的GluT1(Km≈6.9mmol/L)為主。GluT2敲除的小鼠缺乏GSIS,并且在10~15日齡即表現出胰島素分泌障礙、高血糖、血漿胰高血糖素和游離脂肪酸(free fatty acid, FFA)水平上升等T2DM癥狀,大部分個體在2~3周齡時死亡[14];而在其β細胞恢復表達GluT1或GluT2后,GSIS都可以得到恢復[15];說明β細胞的GSIS依賴于細胞膜上GluT的總體葡萄糖轉運能力,而非某一特定類型的GluT。
GluT表達的缺失造成β細胞葡萄糖攝取的障礙,從而失去GSIS[16]。例如:T2DM患者β細胞對于葡萄糖的敏感性降低與其GluT1和GluT2表達下調相關[17,18]。Zuker肥胖糖尿病大鼠、自身免疫性糖尿病大鼠等糖尿病動物胰島β細胞GluT2表達下降。高脂飲食誘導小鼠的血漿FFA水平上升,GluT2表達下降,并出現肥胖相關糖尿病的早期癥狀[19];在移植健康鼠的胰島后,糖尿病小鼠β細胞的GluT2表達和GSIS可以恢復[20,21]。以上研究表明,依賴于GluT的β細胞葡萄糖攝取障礙是糖尿病發生的機制之一。
2 GluT在肝臟中的作用
肝臟是血糖穩態調節的關鍵組織。正常情況下,肝臟的糖原合成、分解以及糖異生在維持血糖濃度穩定的過程中發揮主要作用。肝臟在餐后血糖升高和胰島素升高條件下快速攝取葡萄糖并以肝糖原形式儲存,而饑餓、運動及其他胰島素與抗胰島素因子比例降低時將葡萄糖釋放到血液循環。肝臟表面最主要的GluT是GluT2,葡萄糖的流向取決于其在肝細胞內外的濃度差。肝細胞表面的GluT2具有高Km值,因而在餐后高血糖時具有很高的葡萄糖攝取效率。通過GluT2進入肝細胞的葡萄糖在GK的作用下迅速轉化為G-6-P,維持細胞內較低的葡萄糖濃度,使血液中的葡萄糖得以持續流入肝細胞并儲存。肝細胞中升高的葡萄糖通過磷酸戊糖途徑產生的5-磷酸木糖激活蛋白磷酸酶2,使碳水化合物反應元件結合蛋白(ChREBP)去磷酸化[22,23]并進入細胞核,激活丙酮酸激酶、乙酰CoA羧激酶和脂肪酸合酶等基因的轉錄,從而加強肝細胞的糖酵解和脂合成。同時,胰島素信號通過Akt通路促進叉頭樣轉錄因子O1(FOXO1)的磷酸化,使葡糖異生相關酶表達水平下調,降低糖異生和肝糖輸出,并增加肝臟的糖原合成與儲存[10]。空腹狀態下,血液循環中低血糖、低胰島素和高胰高血糖素的環境使肝臟葡萄糖激酶活性降低,糖原分解和糖異生相關酶活性升高,導致肝細胞葡萄糖濃度的升高,并由GluT2順濃度梯度擴散入血竇。
在小鼠肝臟中特異性敲除GluT2(LG2KO)后[24],肝臟的糖攝取受阻,但LG2KO鼠的骨骼肌葡萄糖攝取能力升高,從而代償性地維持餐后血糖平衡;同時,由于LG2KO鼠缺乏依賴GluT2的肝臟糖輸出過程,空腹狀態下肝細胞內葡萄糖和G-6-P濃度升高,并通過ChREBP激活糖酵解和脂合成相關基因的表達;另外,LG2KO鼠血液和糞便膽汁酸水平下降,并逐漸表現出β細胞功能障礙和葡萄糖不耐受。以上研究結果說明,GluT2在肝臟糖代謝相關基因的表達調控中發揮了重要的作用,并可以進一步通過膽汁酸-Fxr-KATP途徑調節β細胞的GSIS效應[25,26]。雖然肝臟GluT2基因的缺失不會直接影響血糖穩態,但肝臟GluT2缺失引起的葡萄糖代謝的改變可以影響β細胞的功能,最終導致血糖穩態調節障礙。
3 GluT在脂肪中的作用
脂肪作為高容量的能量儲存庫,在維持機體血糖穩態過程中發揮著重要作用。脂肪組織是最重要的胰島素敏感組織之一,胰島素可以促進其成脂分化、葡萄糖攝取以及甘油三酯合成。脂肪也是重要內分泌器官,最早發現的瘦素[14]具有抑制食欲和抵抗肥胖功能;脂肪組織還可分泌脂聯素、抵抗素和腫瘤壞死因子α(TNF-α)等細胞因子,在肥胖介導的胰島素敏感性下降和慢性炎癥中起著至關重要的作用。脂代謝紊亂引起的甘油三酯和FFA水平升高是T2DM的典型臨床癥狀。
脂肪組織的胰島素敏感性依賴于GluT4。無胰島素作用時,GluT4主要儲存在儲存囊泡中,并通過循環囊泡實現細胞膜表面與胞內GluT4的動態平衡。胰島素信號作用于胰島素受體,通過Akt等通路激活GluT4的囊泡運輸,使GluT4迅速大量分布于細胞膜表面,從而激活脂肪的葡萄糖攝取[27]。在胰島素作用下,雖然進入脂肪組織的葡萄糖只占10%[6],但脂肪特異性敲除GluT4的小鼠出現骨骼肌和肝臟IR、高血糖以及高胰島素血癥,與GluT4全身敲除小鼠相似[28~30]。在骨骼肌敲除GluT4的小鼠的脂肪中特異性過表達GluT4后,小鼠的脂肪沉積和血液FFA水平略有上升,但卻改善了小鼠的糖耐量和全身胰島素的敏感性[31]。這些研究結果證明脂肪組織在血糖穩態中能夠起到關鍵的調控作用,而這一作用依賴于GluT4的功能。T2DM患者持續的高胰島素導致脂肪組織GluT4表達下調,并抑制GluT4囊泡對胰島素的響應[32],這可能造成T2DM患者進一步的胰島素抵抗。
4 GluT在骨骼肌中的作用
骨骼肌是機體最大的能量消耗場所和胰島素敏感組織,其能量代謝方式復雜,并受到精細的調節。休息狀態下,骨骼肌的主要能量來源是FFA;餐后或運動后,骨骼肌可以攝取葡萄糖并合成肌糖原儲存;運動或饑餓時,肌糖原反應性分解供能。餐后胰島素作用下,由骨骼肌處理的葡萄糖約占70%~85%[33]。骨骼肌也是機體最大的糖原儲存器官,但由于缺乏葡萄糖-6-磷酸酶,肌糖原只能分解供能,無法再產生葡萄糖進入血液。
葡萄糖轉運是骨骼肌吸收利用葡萄糖的限速步驟。骨骼肌細胞表面的GluT也是胰島素敏感的GluT4,在受到胰島素刺激或肌肉收縮刺激時可以迅速激活,將大量葡萄糖轉運至細胞內。骨骼肌過表達GluT4的小鼠具有更強的血糖處理能力[34]。骨骼肌特異性敲除GluT4則阻斷了小鼠骨骼肌的葡萄糖攝取,導致糖耐量受損和IR[35,36]。骨骼肌特異性敲除胰島素受體的小鼠喪失骨骼肌胰島素響應,但其脂肪胰島素敏感性代償性提高、脂沉積增加、血漿甘油三酯和FFA水平升高,小鼠具有正常的葡萄糖耐量[37,38]。這說明骨骼肌中還存在不依賴于胰島素的葡萄糖攝取信號通路。進一步研究發現,肌肉收縮刺激可以通過Ca2+濃度或腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)通路激活GluT4向膜的轉位[27]。
肌糖原缺乏是T2DM患者骨骼肌的特征之一,糖原合成的減少是由葡萄糖轉運效率下降和GK活性的改變造成的。T2DM患者的骨骼肌GluT4總蛋白水平和運動介導的葡萄糖攝取能力正常,而胰島素介導的葡萄糖攝取能力降低,這說明可能是其胰島素信號轉導系統的缺陷導致了GluT4轉位受阻,從而影響了骨骼肌葡萄糖攝取及糖原合成。研究表明,適度鍛煉可以提高骨骼肌的胰島素敏感性[39],從而緩解部分早期T2DM癥狀。
5 GluT在腸道中的作用
消化道中的葡萄糖主要依靠鈉葡萄糖同向轉運體(sodium glucose cotransporter,SGLT)的主動運輸進入小腸黏膜上皮細胞,經過細胞內運輸后,再借助于基底膜上GluT2的協助擴散作用被動地運送到全身[40]。當小腸中的葡萄糖濃度超過SGLT的最大轉運能力后,小腸黏膜上皮細胞的GluT2也可以分布至頂膜,參與葡萄糖的吸收[41];腸腔內升高的葡萄糖通過甜味受體亞基(T1R3)、α-味轉導素(α-gustducin)以及AMPK信號通路調節GluT2的表達和囊泡運輸[42]。
小腸GluT2的功能除介導葡萄糖的吸收和擴散外,還在調節小腸微絨毛長度、L細胞功能、腸道通透性和炎癥反應中發揮作用[43]。首先,GluT2小腸特異性敲除減弱了近端小腸對葡萄糖的吸收、延遲葡萄糖向腸道周圍組織的分布、減少微絨毛的長度,從而模擬營養吸收不良的狀態。其次,近端葡萄糖吸收的減少會增加葡萄糖向遠端腸道的輸送,從而為遠端腸道微生物群提供新的可發酵能量來源;這些細菌可通過產生丁酸鹽減少促炎細胞因子的表達,降低腸道通透性,對維持腸道穩態發揮積極作用。另外,GluT2的缺失雖然使腸道L細胞密度降低,但同時加強了L細胞胰高血糖素樣肽-1(GLP-1)的分泌,因而不影響血液中GLP-1的含量。因此,通過藥物特異性地阻斷小腸GluT2活性或可為防止體重增加和代謝紊亂提供新思路。
6 GluT在神經系統與大腦中的作用
大腦不儲存糖原和甘油三酯等能量,但需要持續的能量供應。大腦能夠直接利用葡萄糖,但不能直接利用FFA。早期饑餓狀態下,肝糖原分解和糖異生產生葡萄糖入血,并優先保證大腦的利用,此時葡萄糖仍是中樞神經系統的唯一燃料;其他組織葡萄糖氧化利用減少,轉而利用FFA供能。長期饑餓狀態下,大腦則可以利用由FFA轉化而來的酮體提供能量。
動物大腦的葡萄糖攝取主要依靠GluT1和GluT3。GluT1在構成血腦屏障的微血管內皮細胞和除神經元外的腦實質表達[11],Km值約為6.9 mmol/L,與基礎血糖相近。GluT1負責控制葡萄糖由血液循環穩定地通過血腦屏障進入腦脊液,以保證大腦充足、穩定的葡萄糖流量。GluT1缺陷綜合癥患者由于大腦的葡萄糖供應不足,會出現包括小兒耐藥性癲癇、發育遲緩、痙攣、共濟失調、復雜運動障礙等[44]。GluT3主要在神經元表達,相較于其他3個Ⅰ組GluT成員具有最高的底物親和力(Km≈1.4 mmol/L)和較大的轉運效率[11]。腦脊液的葡萄糖濃度平均只有1~2 mmol/L,遠低于循環系統中的平均葡萄糖濃度,因此,GluT1和GluT3的精妙組合既能消除循環系統血糖瞬時升高對大腦的沖擊,又可以確保神經元對于葡萄糖的優先使用權,且始終有充足的能量供應。
GluT除具有維持大腦和神經系統能量供應的功能之外,還在神經系統的葡萄糖感受中起到重要的作用。GluT2在下丘腦、腦干、腦室內神經元、星形膠質細胞以及肝門靜脈內葡萄糖感受器中都有表達。GluT2依賴的葡萄糖敏感神經元可以通過迷走神經和交感神經控制動物的采食、體溫調節以及胰島的增殖與功能。首先,中樞葡萄糖感受器的作用依賴GluT2的表達[45, 46]。下丘腦弓狀核能感知葡萄糖濃度的升高,并通過分泌神經肽Y(NPY)調節食欲、產熱和胰島素釋放。進一步研究發現,雖然NPY神經元不表達GluT2,但與表達GluT2的神經元存在突觸連接。中樞中GluT2依賴的葡萄糖感受器通過黑皮質素途徑影響NPY神經元對于瘦素的敏感性,調控采食和產熱[47]。其次,GluT2也參與植物性神經對于胰島功能的調控。神經特異性GluT2敲除小鼠(NG2KO)的副交感神經放電頻率下降,且腹腔葡萄糖注射無法引起副交感神經的激活或交感神經的抑制。NG2KO小鼠哺乳期的β細胞增殖相對于對照組減少了一半,并造成成年后的β細胞數減少了30%,說明副交感神經在促進細胞增殖及維持成年β細胞數量方面具有重要的作用,而GluT2的功能在其中是不可或缺的[48, 49]。最后,肝門靜脈存在豐富的迷走神經傳入支,當肝門靜脈葡萄糖濃度升高時,其中的葡萄糖感受器被激活,引起第一相胰島素分泌,抑制胰高血糖素分泌,并引起食欲抑制和骨骼肌與脂肪的糖攝取增強[50]。GluT2敲除鼠失去血糖對胰高血糖素分泌的調控,通過神經節阻滯可以恢復胰高血糖素的水平[14],表明門靜脈葡萄糖感受器的功能依賴于GluT2的表達。
7 展望
綜上所述,Ⅰ組GluT成員對于機體血糖的穩態調節至關重要,它們的異常表達會導致器官或組織的功能紊亂,與T2DM等代謝疾病甚至腫瘤的發生密切相關。當下,科學家們正致力于分析疾病發生過程中GluT表達模式的變化,將其運用于疾病診斷,并開發相應的治療方法;在針對GluT開發藥物時,不能忽視GluT在各類組織中所發揮的獨特作用,以及GluT之間可能存在的相互代償表達的關系。另外,目前仍缺少理想的大動物模型用于T2DM等慢性代謝疾病的臨床研究;GluT作為糖代謝過程中的關鍵蛋白,可能成為構建代謝疾病大動物模型時的重要基因修飾位點。從調控血糖穩態關鍵組織的功能出發解析GluT在其中發揮的作用,有助于我們更直觀地了解GluT家族各成員的特性與其分布組織器官的關系,以及相關代謝通路在血糖穩態調控中的作用。GluT及其相關生物學過程作為已知或潛在的藥物靶點,為T2DM等代謝疾病的診斷和治療提供了新的思路,值得進行更深入的研究和探討。

