404 Not Found
404 Not Found
血清MCP-1、OPG水平與急性心肌梗死患者PCI術后血管再狹窄的關系
劉瑞東,王小麗,陳莉莉
(泰山醫學院附屬萊蕪市人民醫院,山東萊蕪271100)
急性心肌梗死(AMI)的發生通常與高血壓、冠狀動脈(冠脈)粥樣硬化等有關。如不及時治療,可導致患者死亡[1]。經皮冠脈介入術(PCI)是目前治療AMI的首選,可在短期內使阻塞血管再通,并能使缺血心肌細胞恢復血流供應,減少心血管事件的發生[2]。但PCI術后部分患者依然會發生血管再狹窄,使血栓及心肌梗死的發生率明顯升高[3,4]。因此,尋找新型血生化標志物早期而準確地預測PCI術后再狹窄十分必要。細胞趨化蛋白1(MCP-1)及骨保護素(OPG)是近年來較為熱門的研究指標。MCP-1屬于趨化因子,與機體中凝血功能的異常及血栓的產生有關;OPG則是分泌性糖蛋白,可調節骨密度,并能調節血管鈣化,與動脈粥樣硬化有重要關聯[5,6]。本研究通過分析血清MCP-1、OPG水平與AMI患者PCI后血管再狹窄的關系,旨在為臨床預防PCI術后血管再狹窄提供監測靶點及數據指導。
1 資料與方法
1.1 臨床資料 選擇2015年1月~2017年6月本院接受PCI手術治療的AMI患者149例,入選標準:符合AMI的診斷標準[7];均有PCI手術指征;患者或其家屬簽署知情同意書;年齡>30歲。排除標準:患有其他心血管疾病;左室射血分數<30%;患感染性疾病或免疫性疾病、惡性腫瘤、血液疾病;嚴重的肝腎功能障礙;近3個月服用糖皮質類激素及免疫抑制劑。根據PCI術后6個月冠脈造影檢查結果,支架內狹窄程度≥50%的患者69例作為觀察組,狹窄程度<50%的患者80例作為對照組。觀察組男43例,女26例;年齡32~79(63.31±2.05)歲;PCI術后6個月梗死區域:前壁53例,其他16例;梗死血管:左前降支26例,左回旋支14例,右冠脈29例。對照組男48例,女32例;年齡34~77(63.28±2.07)歲;PCI術后6個月梗死區域:前壁59例,其他21例;梗死血管:左前降支31例,左回旋支16例,右冠脈33例。兩組臨床資料比較差異無統計學意義(P>0.05)。本研究已經醫院倫理委員會評審通過。
1.2 血脂、血糖、炎癥因子及血清MCP-1、OPG水平檢測 兩組入院時(PCI術前)抽取其晨間空腹靜脈血約4 mL,3 000 r/min離心15 min,提取血清。用Beckman AU5800型全自動生化分析儀測定總膽固醇(TC);甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、空腹血糖(FPG),試劑盒購自上海威豪生物公司;用酶聯免疫吸附法檢測血清炎癥因子白細胞介素6(IL-6)、超敏C反應蛋白(hs-CRP)、腫瘤壞死因子α(TNF-α)及MCP-1、OPG水平,試劑盒購自北京中杉金橋公司。上述檢測嚴格遵照說明書進行操作。
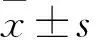
2 結果
2.1 兩組血脂、血糖水平比較 兩組血脂、血糖水平比較差異無統計學意義(P均>0.05)。見表1。
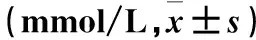
表1 兩組血脂、血糖水平比較
2.2 兩組炎癥因子水平比較 觀察組血清IL-6、hs-CRP及TNF-α水平均高于對照組(P均<0.05)。見表2。
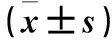
表2 兩組炎癥因子水平比較
2.3 兩組血清MCP-1、OPG水平比較 觀察組血清MCP-1、OPG水平[(35.37±3.24)ng/L、(0.17±0.03)g/L]均高于對照組[(29.42±4.08)ng/L、(0.14±0.02)g/L],比較差異有統計學意義(P均<0.05)。
2.4 AMI患者PCI術后再狹窄的影響因素 Logistic回歸分析結果顯示,AMI患者PCI術后再狹窄的影響因素為MCP-1、OPG。見表4。

表4 AMI患者PCI術后再狹窄的影響因素分析
3 討論
AMI主要發病機制為患者機體易損斑塊發生破裂,血管內皮中的膠原纖維逐漸暴露,導致血栓形成,冠脈中的正常血流受阻,最終致使心肌細胞不斷壞死。PCI是當前治療AMI的重要手段,在血管介入的條件下促使阻塞血管區域的血栓發生溶解,使血流再通,于短期內使缺血區心肌細胞的血供得到恢復[8,9]。但有研究顯示,AMI患者在接受PCI術后7 d發生血管再狹窄的發病率高達6%[10]。因此,對PCI術后發生血管再狹窄進行早期預測尤為重要。
TC、TG、HDL-C和LDL-C均為血脂指標,能有效反映患者機體的脂質代謝水平;FPG可反映患者的血糖情況。本研究發現,兩組血脂與血糖差異均無統計學意義。這提示AMI患者PCI術后是否發生再狹窄與糖脂代謝并無明顯關聯。原因可能為血脂、血糖代謝紊亂并未參與血管再次狹窄的病變過程。IL-6屬于前炎癥細胞類因子,可局部性募集機體內的單核巨噬細胞,并促進低密度脂蛋白等物質的攝取,有助于粥樣斑塊的不斷沉積。羅助榮等[11]報道指出,IL-6是AMI發生的影響因素。hs-CRP作為急性時相蛋白,能夠介導機體的炎癥反應,同時參與心肌損害進程,也是AMI患者機體中炎癥應答標記物。TNF-α通常是由活化后的單核-巨噬細胞分泌,參與心血管類疾病患者機體的炎癥反應,與AMI的發生發展有一定關聯。本研究發現,觀察組IL-6、hs-CRP及TNF-α水平均明顯高于對照組。這提示PCI術后血管再狹窄患者機體的炎癥反應較為明顯。IL-6、hs-CRP及TNF-α作為炎癥因子,增強了泡沫細胞對血管壁的黏附作用,加速了血管阻塞及狹窄形成[12~14]。
MCP-1是趨化因子的一種,是單核細胞所分泌的一種細胞炎癥因子,在結構上含有多個巰基和羥基結構,可與糖蛋白配體互相結合,促使下游單核細胞或巨噬細胞不斷被激活,促進微血管產生[15~17]。并且MCP-1還能聚集血小板,使其活性明顯提升,致使局部區域的凝血功能發生亢進,增加了血栓形成的風險。OPG作為生長因子家族的一個成員,可干預患者機體的內源凝血因子代謝,促進單核細胞或泡沫細胞對血管內皮的浸潤,最終導致血管損傷及狹窄的發生[18,19]。Silvain等[20]的研究也得出類似結論。本研究結果顯示,觀察組MCP-1、OPG水平均明顯高于對照組。提示PCI術后再狹窄患者的MCP-1、OPG水平升高。MCP-1及OPG水平升高能夠促進中性粒細胞誘導的血管內皮細胞損傷,并使纖維蛋白不斷富集,增大了交聯血栓再次發生的概率,最終誘發了PCI術后再狹窄。進一步分析發現,AMI患者PCI術后再狹窄的影響因素主要為MCP-1及OPG。
綜上所述,血清MCP-1及OPG水平均與AMI患者PCI術后再狹窄有密切關系,且二者均為AMI患者PCI術后再狹窄的影響因素。臨床可將MCP-1及OPG納入指標監測體系,從而在早期更加有效地預防AMI患者PCI術后發生再狹窄。
