血尿酸水平對擴張型心肌病患者心房顫動發生的影響
黃亞敏,全力力,黎明江
(武漢大學人民醫院,武漢430060)
擴張型心肌病(DCM)是一種異質性疾病,主要以左心室或雙心室擴大、心肌收縮功能減低為特征,是引起心力衰竭、心律失常和猝死的常見疾病之一。約30%的DCM患者發生心房顫動(房顫),增加了腦栓塞及猝死的風險。結構重構及電重構是房顫發生的原因之一,但具體機制尚未完全闡明。近年來研究發現,炎癥反應及氧化應激等也可能參與房顫的發生發展。血尿酸(SUA)作為反映炎癥及氧化應激的一個重要指標,不僅與冠心病、高血壓、糖尿病等相關,也是房顫發生的危險因素,既參與新發房顫的發生,又與房顫的維持及血栓形成等密切相關,嚴重危害患者的生命健康[1~3]。本研究擬探討SUA水平變化對DCM患者發生房顫的影響。
1 資料與方法
1.1 臨床資料 收集2016年9月~2018年1月于武漢大學人民醫院就診的DCM患者122例,均符合《心肌病診斷與治療建議》(2007年)標準[4]。其中男96例、女26例(21.31%),年齡27~89(57.43±13.58)歲。根據高尿酸血癥診斷標準分為高尿酸血癥組79例、非高尿酸血癥組43例。排除標準:伴缺血性心臟病、有大量飲酒史(女性攝入乙醇>40 g/d,男性攝入乙醇>80 g/d,飲酒時間5年以上)、先天性心臟病、心包疾病、瓣膜性心臟病、高血壓、肺心病、糖尿病、甲狀腺疾病、應激性心肌病、圍生期心肌病、急性冠脈綜合征、慢性肝腎功能不全、腫瘤、感染性疾病、近期手術史及臨床資料不全。
1.2 血壓、心率、生化指標及SUA檢測 血壓、心率測量:由同一名醫生應用水銀血壓計在安靜環境下,被測量者休息5 min以上,測量前30 min內禁止吸煙和飲咖啡,排空膀胱。取仰臥位,測量左上肢血壓,并記錄患者次日晨起前心率。生化指標檢測:于入院后第2天抽取空腹靜脈血并由武漢大學人民醫院檢驗科完成,指標包括血紅蛋白(Hb)、紅細胞比積(HCT)、總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、N末端前腦鈉尿肽(pro-BNP)、血肌酐(Cr)、超敏C反應蛋白(hs-CRP)、空腹血糖(FPG)、血鈉、SUA。用日本Olympus AU2700型全自動生化分析儀檢測。
1.3 心臟彩超檢查 用GE公司Vivid 7彩色多普勒超聲顯像儀,探頭頻率為2.5 MHz。測量左心房直徑(LAD)、左室舒張末期直徑(LVDD)、左室后壁厚度(LVPM)、室間隔厚度(IVS)、左室射血分數(LVEF)。
1.4 高尿酸血癥、房顫的診斷標準 男性SUA>420 μmol/L或女性SUA>360 μmol/L診斷為高尿酸血癥[5]。入院后患者行心電圖或者動態心電圖檢查后,由心電圖專業醫師依據正常P波消失,代之以大小不等不規則的f波,心室率完全不規則確診為房顫。
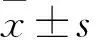
2 結果
2.1 兩組臨床資料比較 兩組年齡、靜息心率、舒張壓、HDL-C、ALT、AST、Cr比較差異有統計學意義(P均<0.05),性別、收縮壓、Hb、HCT、TC、TG、LDL-C、pro-BNP、hs-CRP、FPG、血鈉比較差異無統計學意義(P均>0.05)。雖然兩組ALT、AST及舒張壓差異有統計學意義(P均<0.05),但尚在正常范圍之內;雖然hs-CRP差異無統計學意義(P>0.05),但高尿酸血癥組hs-CRP水平高于非高尿酸血癥組。見表1。
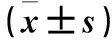
表1 高尿酸血癥組與非高尿酸血癥組臨床資料比較
2.2 兩組心臟彩超結果比較 高尿酸血癥組LAD、LVDD、IVS、LVPM高于非高尿酸血癥組,僅LAD比較差異有統計學意義(P<0.05),LVEF低于非高尿酸血癥組(P<0.05)。見表2。
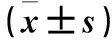
表2 兩組心臟彩超指標比較
2.3 高尿酸血癥與房顫發生的關系 高尿酸血癥組伴房顫37例(46.84%),非高尿酸血癥組伴房顫8例(18.60%),兩組比較差異有統計學意義(P=0.02)。進一步Logistic回歸分析發現,排除其他影響因素,血尿酸水平升高是房顫發生的獨立危險因素(OR=1.08,95%CI1.003~1.012,P=0.001)。
3 討論
既往研究已表明除高血壓、糖尿病、冠心病患者外,在伴有SUA升高的慢性心力衰竭患者中,房顫的發生風險顯著增加,且高尿酸血癥是判斷中重度慢性心力衰竭患者預后的獨立指標[6]。在11項關于評估SUA對慢性心功能不全患者預后重要性的研究中表明,高尿酸血癥可以顯著預測CHF患者的全因病死率,且不受射血分數的影響[7~9]。然而具體機制尚未完全闡明。SUA作為嘌呤分解代謝的主要產物,具有促氧化、激活腎素-血管緊張素系統(RAAS),降低血管壁一氧化氮生物利用度,促進炎癥反應和內皮細胞功能障礙的作用,并且在尿酸合成過程中,伴隨生成的過多氧自由基和羥自由基等亦可介導氧化應激,加重機體炎癥反應[10]。Chao等[11]研究發現,SUA水平升高的患者,其hs-CRP水平及胰島素抵抗較高,而且左心房內徑較大。近年來研究發現,C反應蛋白、白細胞介素6、腫瘤壞死因子等炎癥指標與房顫、左心房增大有關,且CRP對房顫的進展、維持及左心房擴大、血栓形成有一定的預測價值[12]。Letsas等[13]研究發現,CRP、LVEF既是陣發性房顫的獨立危險因素,也是永久性房顫的危險預測因子;而SUA僅是永久性房顫的危險預測因子。但是亦有研究表明在患有房顫不同風險因素的人群中,如果存在高尿酸血癥,新發房顫的風險也將顯著增加,其危險比可達1.191[14]。Yu等[15]研究發現,SUA可通過上調血管緊張素原、血管緊張素轉換酶和血管緊張素Ⅱ受體的表達,增加血液中血管緊張素Ⅱ的水平。血管緊張素Ⅱ通過激活血管緊張素I受體來刺激促炎細胞因子如IL-6、IL-8和TNF的產生。且動物實驗發現,用血管緊張素Ⅱ治療的小鼠心房組織中性粒細胞浸潤增加,并且血管緊張素轉化酶抑制劑、尿酸轉運體阻滯劑和抗氧化劑均可以改善這些作用[16]。臨床研究表明血管緊張素受體阻滯劑氯沙坦具有降低SUA水平的作用,已被證明能顯著減少房顫的發生[17],且在DCM患者中采用黃嘌呤氧化酶抑制劑進行降尿酸治療3個月后左室收縮功能及冠脈微血管血流均可得到明顯改善[18]。在心功能不全患者中常因為缺血缺氧導致黃嘌呤氧化酶上調及活性增加,促使腺苷和次黃嘌呤氧化為尿酸,是慢性心力衰竭患者SUA水平升高的主要因素,以及低氧時乳酸生成增加,導致尿乳酸排泄增多,從而增加尿酸鹽在近端腎小管的重吸收[19],尿酸排泄減少,加重氧化應激及炎癥反應,增加房顫的發生風險。另一方面長時間的房顫可誘導心肌組織重塑,導致傳導缺陷增加、收縮能力降低和組織病理改變[20]。因此炎癥和組織重構似乎是房顫與SUA之間的病理生理學問題。所以在DCM患者中SUA水平升高不僅是心功能不全發生的危險因素,亦與房顫的發生密不可分。且炎癥反應及氧化應激也可能參與其中。然而降尿酸治療或者抗氧化應激治療是否可以預防及改善DCM患者的房顫發生風險及心臟重構仍有待進一步研究。
此外本研究亦發現在高尿酸血癥組靜息心率較SUA正常組明顯增加,且獨立于心功能不全。靜息心率對SUA與房顫之間的關系是否有影響,目前研究較少。靜息心率反映了交感神經與副交感神經之間的平衡。在心功能不全患者中靜息心率增加是交感神經代償性持續興奮的一種表現,雖然有助于維持心輸出量,但是常因為左心室充盈受損,冠脈灌注降低,心肌能量供應不足,導致心功能進一步下降[21]。有研究發現靜息心率的增加與氧化應激及炎癥相關。在一項動物實驗中發現,通過誘導心動過速可以增加心臟氧化應激指標心臟煙酰胺腺嘌呤二核苷酸和絲裂原激活蛋白激酶的水平[22]。另一項研究[23]表明,靜息心率的增加與白細胞計數相關,白細胞計數與血管硬化相關,靜息心率導致動脈硬化可能與血管壁慢性、低度炎癥損傷有關。因此推測心率加快,舒張期縮短加上動脈硬化使血管舒縮功能障礙,心肌能量供應不足,使心率進一步加快,形成惡性循環,最終心功能下降進而發生心肌纖維化。研究發現,在伴有代謝綜合征的老年患者中靜息心率的增加受SUA水平的影響,且隨著SUA水平的增加而增加。進一步分析發現,當靜息心率達到86次/min時,靜息心率對高尿酸血癥診斷的敏感性和特異性可分別為56.1%和72.5%[23]。推測在高尿酸血癥患者中,靜息心率增加,可能是SUA水平升高介導RAAS活性增加的一種反應;也可能僅為SUA水平升高介導的氧化應激及炎癥反應的一種表現,而獨立于固有的環境因素。所以在伴有SUA升高的DCM患者中,靜息心率增加亦可能是導致心臟結構改變,促進房顫發生的危險因素之一。仍有待進一步研究證實。
目前鮮有研究探討在DCM患者中SUA與房顫發生的相關性。DCM是房顫發生的一個重要原因,心房結構重構和電重構是其發生的基礎,但具體機制尚未完全闡明。本研究發現,高尿酸血癥組LAD、高于非高尿酸血癥組,LVEF低于非高尿酸血癥組。高尿酸血癥組房顫發生率明顯高于非高尿酸血癥組。進一步分析發現,在排除其他影響因素后,SUA水平是影響房顫發生的獨立危險因素。
綜上所述,在DCM患者中血尿酸水平升高是房顫發生的獨立危險因素,炎癥和氧化應激在房顫的發生發展中起重要作用。此外靜息心率也應該被認為是有價值的預測指標,可預測SUA水平升高的風險。此外本研究尚存在不足之處。首先該研究為臨床回顧性研究、樣本量較小,且未分析藥物治療的影響,不能明確SUA是房顫的始發因素還是促進因素;其次未進一步分析SUA對不同類型房顫的影響是否存在差異;再者僅根據臨床指標進行分析,未進行具體內在機制的研究,并且目前關于SUA對房顫發生影響的研究中,尚無明確的動物實驗證實其具體作用機制。

