急性胰腺炎患者血清HMGB1、TLR4、TLR9、DAO水平變化及意義
嚴蘋,柏超,周翔宇,陳霞
(西南醫科大學附屬醫院,四川瀘州646000)
急性胰腺炎(AP)發病后,釋放各種炎癥介質,使腸黏膜通透性增強,導致腸黏膜屏障功能損傷,引發腸源性內毒素血癥,誘發或加重胰腺的改變,發生“二次打擊”,進一步導致多器官功能衰竭及嚴重感染。高遷移率族蛋白1(HMGB1)作為一種重要的晚期炎癥介質,近年來其在AP中的作用日益受到關注及重視,但在臨床AP患者腸黏膜屏障損傷中的作用尚需進一步探討。本研究觀察AP患者血清中HMGB1、TOLL樣受體(TLR)4、TLR9、二胺氧化酶(DAO)等的水平變化,探討其臨床意義。
1 資料與方法
1.1 臨床資料 選擇2015年4月~2016年4月就診于本院消化內科的AP患者59例,均發病<24 h,男38例、女22例,年齡22~66歲;依照《中國急性胰腺炎診治指南》(2013)[1]和AP亞特蘭大分類標準修訂(2012)[2]將患者分為輕型AP(MAP)組26例、中度重癥AP(MSAP)組17例、重癥AP(SAP)組16例。排除標準:發病超過24 h,患有肝炎、皰疹等病毒感染性疾病;系統性紅斑狼瘡等自身免疫性疾病;惡性腫瘤;有糖尿病史;其他與AP無關的嚴重器質性病變。選擇同期于本院體檢健康的志愿者20例為對照組,男13例、女7例,年齡28~61歲。各組性別、年齡具有可比性。
1.2 血清HMGB1、TLR4、TLR9、IL-6、TNF-α、DAO檢測 患者于入院24、48、72 h及對照組于體檢24、48、72 h,使用促凝管分別抽取兩組靜脈血3 mL,均在室溫下靜置1~2 h,于4 ℃下3 000 r/min離心15 min。將所取得的血清置于-80 ℃冰箱凍存。使用ELISA試劑盒(武漢貝茵萊公司)檢測血清HMGB1、TLR4、TLR9、IL-6、TNF-α、DAO,按說明書進行操作。

2 結果
2.1 各組不同時間點血清HMGB1水平比較 詳見表1。

表1 各組不同時間點血清HMGB1水平比較
注:與對照組同時間點比較,*P<0.05;與MAP組同時間點比較,#P<0.05;與MSAP組同時間點比較,△P<0.05;與同組入院48 h比較,★P>0.05。
2.2 各組不同時間點血清TLR4水平比較 詳見表2。

表2 各組不同時間點血清TLR4水平比較
注:與對照組同時間點比較,*P<0.05;與MAP組同時間點比較,#P<0.05;與MSAP組同時間點比較,△P<0.05;與同組入院48 h比較,★P>0.05。
2.3 各組不同時間點血清TLR9水平比較 詳見表3。

表3 各組不同時間點血清TLR9水平比較
注:與對照組同時間點比較,*P<0.05;與MAP組同時間點比較,#P<0.05;與MSAP組同時間點比較,△P<0.05;與同組入院48 h比較,★P>0.05。
2.4 各組不同時間點血清IL-6水平比較 詳見表4。

表4 各組不同時間點血清IL-6水平比較
注:與對照組同時間點比較,*P<0.05;與MAP組同時間點比較,#P<0.05;與MSAP組同時間點比較,△P<0.05。
2.5 各組不同時間點血清TNF-α水平比較 詳見表5。
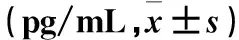
表5 各組不同時間點血清TNF-α水平比較
注:與對照組同時間點比較,*P<0.05;與MAP組同時間點比較,#P<0.05;與MSAP組同時間點比較,△P<0.05。
2.6 各組不同時間點血清DAO水平比較 詳見表6。
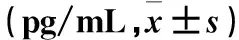
表6 各組不同時間點血清DAO水平比較
注:與對照組同時間點比較,*P<0.05;與MAP組同時間點比較,#P<0.05;與MSAP組同時間點比較,△P<0.05;與同組入院48 h比較,★P>0.05。
2.7 AP患者血清HMGB1水平與DAO的相關性 AP患者血清HMGB1水平與DAO呈正相關(r=0.908,P<0.05)。
3 討論
AP早期腸道作為全身炎癥反應的一個重要靶器官,腸黏膜屏障損害所致的腸道細菌或毒素移位是SAP細菌入侵的主要途徑。AP尤其是SAP,釋放大量的炎癥介質和細胞因子不僅引發全身炎癥反應綜合征和多器官功能障礙,還可進一步損傷腸黏膜屏障功能。本研究結果顯示,AP患者炎癥因子TNF-α、IL-6水平升高,SAP患者升高更明顯,但在起病24 h后逐漸下降,可見炎癥因子水平變化可反映疾病的嚴重程度。
HMGB1是一種廣泛存在于哺乳動物細胞核內的非組蛋白,是迄今為止發現的惟一能在胞外誘導細胞因子分泌和活化炎癥細胞DNA結合的蛋白,核內HMGB1可通過炎癥細胞的主動分泌和壞死細胞的被動釋放轉移至胞外,是重要的炎癥介質[3]。近年來Meta分析結果表明AP患者血清中HMGB1水平升高,HMGB1可作為AP的生物學指標之一[4]。現有研究顯示,AP小鼠小腸黏膜組織中HMGB1水平升高,說明HMGB1參與了AP時腸黏膜損傷。DAO是一種含有脫胺的腐胺和組胺的細胞內酶,存在于人和哺乳動物的小腸黏膜和纖毛上皮細胞中,以空、回腸活性最高,正常人血清中含量很低;腸黏膜細胞受損、壞死后該酶釋放入血,導致血清DAO活性增高,測定血中DAO的活性可反映腸黏膜損傷和修復的情況[5]。本研究采用DAO作為評估腸黏膜屏障的血清學指標,發現AP患者存在腸黏膜損傷,SAP患者損傷更明顯。本研究發現, AP患者血清HMGB1水平均較對照組高,起病48 h達峰值,MSAP及SAP患者血清HMGB1水平在起病72 h仍維持在較高水平。進一步相關分析發現AP患者血清中HMGB1水平與DAO呈正相關,提示HMGB1可能參與了AP患者腸黏膜屏障損傷的發生發展。
HMGB-1屬于損傷相關性模式分子(DAMPs)中的一種重要分子。DAMPs可以激活Toll樣受體、NOD樣受體等模式識別受體。其中Toll樣受體被認為是啟動炎癥反應的“門戶”蛋白。TLR4可與巨噬細胞、中性粒細胞分泌的HMGB1結合,招募髓系分化蛋白88和IL-1受體相關激酶,再與下游調節因子TRAF結合,進而激活MAPK途徑和核轉錄因子的核轉錄,誘導炎癥反應的發生[6]。近年來有報道[7]指出HMGB1-DNA復合體可激活TLR9信號通路,通過激活NF-κB或JAK/STAT通路高度活化,促進免疫細胞進一步成熟和分泌細胞因子(IL-1β、TNF-α)等。有研究表明,TLR4在SAP初期參與了機體炎癥反應,并導致SAP惡化[8],而TLR9拮抗劑預處理的AP小鼠其胰腺壞死和肺的炎癥均有不同程度的減輕,TLR4、TLR9通過各自相應的信號通路可使NF-κB活化,促使TNF-α、IL-1、IL-6等表達增加[9,10],造成腸道自身免疫損傷。因此,本研究同時檢測了HMGB1的下游受體TLR4、TLR9,結果顯示,AP各組血清TLR4、TLR9水平較對照組升高,且在起病48 h達峰值,但MSAP及SAP患者在起病72 h仍維持較高水平。因此,HMGB1有可能通過激活下游受體TLR4、TLR9參與了AP時的腸黏膜屏障損傷。

