人肝癌相關抗原SMP30重組慢病毒對人外周血樹突狀細胞成熟的影響
張瑤堯,黃榮師,郭晉宏,潘劍,陳承曉,黃天明,覃秋紅,羅國容
(廣西醫科大學,南寧530021)
衰老標記蛋白30(SMP30)最早作為一種鈣調節蛋白被日本學者Yamaguchi等[1]發現。隨后,Fujita等[2]發現,SMP30是一種隨年齡增加而水平不斷下降、相對分子質量約為34 kD的抗衰老蛋白。人SMP30主要存在于肝細胞中。在不同的脊椎動物中SMP30的氨基酸序列具有高度的保守性,即其同源性可達70%~90%。SMP30具有多種生物學功能,其中包括對肝細胞的保護作用和對肝細胞再生的調節作用[3]。我們在前期研究中用SEREX技術篩選出編號為HCC-22-5的人肝細胞癌(HCC)相關抗原與人SMP30羧基端100%同源,血清學初篩結果顯示在HCC患者血清中存在HCC-22-5抗原的相應抗體,從而最先提出SMP30是一種人肝癌相關抗原,具有良好的免疫原性[4]。用人SMP30重組蛋白致敏人外周血血樹突狀細胞(DC)后可對DC的成熟起到促進作用,且能有效刺激自體T淋巴細胞增殖,誘導生成對人肝癌細胞株BEL-7404有殺傷作用的細胞毒性T淋巴細胞(CTL),但致敏時間有限[5]。用與人肝癌相關抗原SMP30同源性很高的小鼠SMP30構建慢病毒載體,體外轉染小鼠外周DC并使其穩定表達SMP30蛋白,證明小鼠SMP30重組慢病毒體外轉染小鼠外周血DC對其成熟起到一定促進作用[6]。2017年7月~2018年7月,我們進一步用人肝癌相關抗原SMP30重組慢病毒轉染人外周血DC,觀察其對DC成熟的影響,為后續進一步研制人肝癌相關抗原DC疫苗提供實驗基礎。
1 材料與方法
1.1 試劑與儀器 人外周血淋巴細胞分離液購自北京索萊寶科技有限公司;人粒細胞-巨噬細胞集落刺激因子(GM-CSF)、白細胞介素4(IL-4)購自廣州賽業生物科技有限公司;人肝癌相關抗原SMP30重組慢病毒和空載慢病毒由課題組配合廣州復能基因有限公司制備;哺乳動物蛋白試劑盒和BCA蛋白定量試劑盒購自杭州弗德生物科技有限公司;Western blotting檢測試劑盒購自賽默飛世爾科技有限公司;PVDF膜購自美國BD公司;兔抗人SMP30多克隆抗體、兔抗人GAPDH多克隆抗體和HRP標記的山羊抗兔 IgG抗體購自美國Novus公司;白細胞介素12(IL-12)和干擾素γ(INF-γ)的ELISA檢測試劑盒購自武漢華美生物工程有限公司;人Fitc-CD1a、Fitc-CD80、PE-CD86流式標記抗體購自美國BioLegend公司;R/MINI-1640培養基、胎牛血清、胰酶和雙抗購自美國Giboco公司。超凈工作臺購自蘇州尚田潔凈技術有限公司;二氧化碳培養箱購自美國Thermo Fisher Scientific公司;臺式高速離心機TG16-WS購自上海盧湘儀離心機儀器有限公司;Beckman 64R 高速冷凍離心機購自上海普迪生物技術有限公司;全自動熒光倒置及相差倒置顯微鏡購自日本Olympus公司;酶標儀購自美國Thermo公司;流式細胞儀購自美國BD公司;UVI 凝膠成像分析系統購自日本Olympus公司。
1.2 人外周血DC的分離與體外培養 采用Ficoll密度梯度離心法。抽取健康志愿者外周血100 mL,加等量的PBS緩沖液稀釋。將稀釋好的血液緩慢沿離心管壁加到等量的人外周血淋巴細胞分離液上,室溫避光靜置20 min。室溫下2 000 r/min離心25 min,吸取白膜層。加等量PBS緩沖液清洗,室溫下1 500 r/min離心10 min后移去上清液,再加PBS緩沖液重復清洗1次。用R/MINI-1640完全培養基重懸分離得到的人外周血單個核細胞,接種于6孔板中,約5×106/孔,在37 ℃、5% CO2培養箱中培養2 h,移去非貼壁細胞,用PBS緩沖液清洗2次貼壁細胞,加入含100 ng/mL GM-CSF和50 ng/mL IL-4的R/MINI-1640完全培養基繼續培養,隔天半量換液。
1.3 人外周血DC的鑒定 在普通光學顯微鏡下觀察、記錄細胞形態變化。收集培養第5天的細胞,對細胞進行計數,細胞數約為5×105個,PBS緩沖液清洗2次,離心后移去上清液,用預冷的PBS緩沖液100 μL重懸細胞,加入Fitc-CD1a流式標志抗體5 μL,冰上避光孵育30 min,1 000 r/min離心5 min后移去上清液,PBS緩沖液清洗細胞1次,每管加入PBS緩沖液500 μL重懸細胞,在1 h 內用流式細胞儀進行檢測。
1.4 慢病毒體外轉染 DC培養第6天,將其隨機分為SMP30慢病毒組、空載慢病毒組和空白對照組,分別用人肝癌相關抗原SMP30重組慢病毒和空載慢病毒(感染復數=85)進行體外轉染,并加入2 μg/mL的polybrene,每組設3個復孔。轉染12 h,于普通光學顯微鏡下觀察細胞狀態,細胞無異常繼續培養至轉染24 h后,換新鮮的R/MINI-1640完全培養基繼續培養,72 h后開始用熒光顯微鏡觀察EGFP綠色熒光蛋白的表達情況。
1.5 DC中SMP30蛋白表達檢測 采用Western blotting法。在熒光顯微鏡下觀察到明顯綠色熒光后,用哺乳動物蛋白試劑盒提取各組DC的總蛋白,BCA蛋白定量法檢測提取的各組DC總蛋白濃度。具體實驗步驟按試劑盒操作說明進行。Western blotting檢測各組DC表達SMP30蛋白的表達情況。實驗前1 d制備5% SDS-PAGE濃縮膠和10% SDS-PAGE分離膠,4 ℃冰箱保存;加樣到5% SDS-PAGE濃縮膠和10% SDS-PAGE分離膠上在100 V穩電壓下電泳1.5 h;根據一抗SMP30和內參GAPDH的大小進行切膠;100 mA穩電流轉到PVDF膜上,轉膜時間為1.5 h;5%脫脂牛奶室溫下封閉2 h;PBST洗膜3次、清洗時間為10 min/次;4 ℃下孵育一抗(兔抗人SMP30多克隆抗體,1∶600稀釋和內參抗體兔抗人GAPDH多克隆抗體,1∶2 000稀釋)過夜;PBST洗膜3次、10 min/次;室溫下孵育二抗(山羊抗兔 IgG抗體,1∶10 000稀釋)2 h;PBST洗膜3次、10 min/次;在PVDF膜上滴上新鮮配好的ECL發光液,用UVI凝膠成像分析結果。
1.6 DC細胞因子的分泌情況檢測 采用ELISA法。轉染后第8天吸取各組DC的培養上清液,4 ℃、14 000 r/min離心5 min后取上清液,用ELISA試劑盒檢測各組DC細胞因子IL-12、INF-γ的分泌情況。
1.7 DC表面分子CD80、CD86表達檢測 采用流式細胞術。收集各組DC,用PBS緩沖液清洗2遍,用預冷的PBS緩沖液重懸細胞后對細胞進行計數,確保每個EP管中100 μL細胞懸液中含5×105個細胞,各管分別加入帶Fitc-CD80和PE-CD86流式標記抗體5 μL,冰上避光孵育30 min,1 000 r/min離心5 min后移去上清液,PBS緩沖液清洗細胞1次,每管加入PBS緩沖液500 μL重懸細胞,在1 h 內用流式細胞儀測算CD80、CD86表達率。
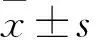
2 結果
2.1 人外周血DC的體外培養與鑒定結果 分離人外周血獲得單個核細胞后,用細胞因子GM-CSF和IL-4誘導其生成DC。普通光學顯微鏡下觀察到未成熟的DC細胞形態不規則,細胞集落明顯,貼附在孔板壁上生長;成熟的DC細胞形態呈類圓形,集落不再明顯,細胞表面有短的毛刺狀突起,多呈懸浮生長。誘導培養第5天,流式細胞術檢測DC表面分子CD1a的表達率為68.2%,說明成功將人外周血單個核細胞誘導培養成DC。
2.2 慢病毒轉染人外周血DC結果 轉染第5天在熒光顯微鏡下可觀察到SMP30慢病毒組和空白對照組出現少量綠色熒光,第7天熒光蛋白表達趨于穩定,DC轉染率75%左右,空白對照組熒光顯微鏡下未觀察到綠色熒光。
2.3 各組SMP30蛋白表達比較 SMP30慢病毒組在34 kD處出現明顯反應條帶,與目的SMP30蛋白的相對分子質量大小一致;而空載慢病毒組和空白對照組無明顯反應條帶。SMP30慢病毒組成功過表達目的蛋白SMP30。
2.4 各組細胞因子分泌情況比較 SMP30慢病毒組、空載慢病毒組和空白對照組上清液中IL-12水平分別為(32.56±2.93)、(21.13±1.55)、(15.68±1.73)pg/mL,INF-γ水平分別為(42.34±5.82)、(21.68±2.23)、(14.14±2.16)pg/mL。SMP30慢病毒組上清液中IL-12、INF-γ水平高于空載慢病毒組、空白對照組(P均<0.05)。
2.5 各組CD80、CD86表達比較 SMP30慢病毒組、空載慢病毒組和空白對照組上清液中CD80表達率分別為48.7%、32.4%、18.1%,CD86表達率分別為21.0%、18.0%、10.2%。SMP30慢病毒組CD80、CD86表達率高于空載慢病毒組、空白對照組(P均<0.05)。
3 討論
腫瘤免疫治療近年來受到了眾多學者的關注,主要原因是腫瘤免疫治療可以減少手術、放療、化療等傳統常規療法對腫瘤患者免疫系統的損傷,并對晚期腫瘤患者的療效優于傳統常規療法。DC是目前發現的機體內功能最強大的抗原呈遞細胞,在免疫應答過程中具有無法取代的地位,并且DC可在體外成功培養,使得以DC為基礎的腫瘤免疫治療成為國內外的研究熱點[7]。Sipμleucel-T 在2010年成為第一個被FDA批準的治療性腫瘤DC疫苗[8]。
目前,用于腫瘤免疫治療的DC疫苗大致分為腫瘤抗原或多肽致敏的DC疫苗和基因修飾的DC疫苗兩類[9]。本課題組在前期實驗中證明人肝癌相關抗原SMP30重組蛋白致敏人外周血DC后可促進DC的成熟和活化,但是這種方式獲得的DC疫苗持續作用時間有限。與腫瘤抗原或多肽致敏的DC疫苗相比,基因修飾的DC疫苗具有可長期表達抗原和細胞因子或共刺激分子、促進DC的成熟和活化、增強DC的抗原呈遞能力、誘導T淋巴細胞生成特異性CTL以及對抗腫瘤對DC的抑制等優點[10,11]。基因修飾的DC疫苗是借助分子生物學手段將外源性基因以基因轉移的方式導入DC內部來獲得的,目前最為常用的方式之一是用慢病毒載體將目的基因轉至DC[12]。主要原因為慢病毒載體具有可轉染非分裂細胞、轉染率高、可承載較大的外源基因片段且穩定表達的優點[13]。本課題通過用構建肝癌相關抗原SMP30慢病毒載體后再用其轉染DC的方式,以求獲得SMP30相關的更穩定、更持續作用的DC疫苗。在前期實驗中,本課題組發現用與人SMP30有高度同源性的小鼠SMP30慢病毒轉染小鼠DC后可以促進DC的成熟,且比SMP30蛋白致敏的DC疫苗持續時間更長。在此研究基礎上,本研究用人肝癌相關抗原SMP30重組慢病毒在體外轉染人外周血DC后,檢測其對DC功能的成熟狀況的影響,從而探討該種方式是否適用于人。CD1a是目前最常用來鑒定人DC細胞的檢測指標,在人外周血DC誘導培養的過程中,先通過對細胞形態的觀察和流式細胞術鑒定DC表面因子CD1a的表達情況來確定了人外周血DC的成功培養。結果說明成功用人SMP30重組慢病毒在體外轉染人外周血DC,并且使DC成功過表達目的蛋白SMP30。DC在不同的狀態下表達的表面免疫分子和分泌的細胞因子有所不同,其中,只有成熟的DC才會高表達協同刺激分子(CD80、CD86)、黏附分子、特征性標記等,并分泌IL-12、TNF-α、IFN-α、IFN-γ等細胞因子[14]。本研究采用ELISA和流式細胞術來檢測DC的成熟情況,兩種檢測結果均顯示人SMP30慢病毒轉染人外周血DC后能促進DC的成熟。該結果與本課題組在前期研究中發現的小鼠SMP30慢病毒可以促進小鼠DC成熟具有一致性,為后續實驗進一步研究人肝癌相關抗原SMP30致敏的DC疫苗及其對肝癌的殺傷作用提供了實驗基礎。

