Twist在宮頸癌細胞株Hela中的表達變化及其對細胞侵襲轉移的影響
程鳳鳳,于靜,張曉瑩,房愛菊,金作偉
(1山東省立第三醫院,濟南 250031;2濟南齊魯醫學檢驗所)
宮頸癌是嚴重威脅女性健康的惡性腫瘤,其發病率位居女性惡性腫瘤的首位,全世界每年大約有53萬新發病例和27萬死亡病例,且大約85%死亡病例發生在不發達國家或者發展中國家,其病死率是發達國家的18倍[1]。目前雖然宮頸癌手術以及放化療技術取得了突破性的進展,但絕大多數中晚期患者仍然預后不良。宮頸癌分子的異質性改變是導致宮頸癌放化療抵抗、遷移及進展的主要原因[2]。因此,進一步尋找宮頸癌發生發展的分子機制,對于提高中晚期宮頸癌患者生存率、提高生存質量意義重大。Twist即扭曲因子,具有高度保守的堿性螺旋—環—螺旋結構,是一種具有調控作用的轉錄因子,在腫瘤細胞增殖、凋亡以及侵襲轉移中均具有重要的調控作用[3]。目前研究已經證實Twist參與多種腫瘤的形成,包括乳腺癌以及前列腺癌等[4,5]。研究發現,Twist在宮頸癌組織中高表達,且Twist高表達的患者預后不良[6],但其在宮頸癌侵襲轉移中的作用機制尚未闡明。2014年10月~2017年12月,本研究以宮頸癌癌細胞株Hela以及人宮頸永生化上皮細胞H8為研究對象,旨在觀察Twist在宮頸癌細胞系侵襲轉移中的作用,為開發宮頸癌新基因靶向治療提供實驗數據。
1 材料與方法
1.1 主要試劑與儀器 DMEM高糖培養基、RPMI1640培養基、胎牛血清以及胰酶等購自美國Hyclone公司;由Invitrogen公司構建慢病毒載體;Twist抗體購自美國GeneTex公司;Rac1以及MMP-2抗體購自Cell Signaling Technology公司;BCA蛋白濃度測定試劑盒購自北京碧云天生物技術公司;高速冷凍多用途離心機購自德國Eppendorf Centyifuge。
1.2 細胞來源、分組及培養 宮頸癌細胞株Hela以及人宮頸永生化上皮細胞H8細胞購自上海生命科學院細胞和生物化學研究所。Hela細胞生長于含10%胎牛血清的DMEM高糖培養基中(加入100 U/mL青霉素以及50 U/mL鏈霉素),于37 ℃、5% CO2的細胞培養箱中培養,每天換液1次,融合度長至80%左右時用0.25%胰酶消化后接種至6孔板中。每孔加入含10%胎牛血清的DMEM高糖培養基3 mL繼續培養。
1.3 Twist慢病毒過表達或沉默載體轉染Hela細胞 構建Twist基因過表達質粒以及敲減質粒,并將其與病毒包裝質粒轉入293T,48 h后收集病毒,0.22 μm的濾器過濾后濃縮病毒,-80 ℃保存。實驗前保證細胞的良好生長狀態,取8×104個處于對數生長期的Hela細胞,接種于6孔板中,接種3個孔,分別為對照組、過表達組、沉默組。感染前為細胞換新鮮基礎培養基,以復感染指數(MOI)值20,加入感染培養基(基礎培養基1 mL+5 mg/L Polybrene)和相應的病毒量(病毒量體積=MOI×細胞數目/病毒滴度,對照組1.8 μL,過表達組3.4 μL,沉默組4 μL)。24 h后,37 ℃、5% CO2培養12 h,更換新鮮基礎培養基,72 h后熒光鏡觀察感染率。
1.4 細胞侵襲能力檢測 采用boyden侵襲實驗。用胰酶將上述過表達組、沉默組以及對照組對數生長期的Hela消化制成單細胞懸液。聚碳酸酯微孔膜(孔徑8 μm)分布于運動小室和侵襲小室的上下室之間,侵襲小室濾膜上包被人工基底膠,將人工基底膠置于室溫下,無血清的培養基水化2 h。小室的下室均加含10%胎牛血清的完全培養基作為趨化因子,上室加入細胞懸液(細胞數約1×105)。37 ℃、5% CO2飽和濕度下培養,12 h后,分別取出聚碳酸酯微孔膜,中性甲醛固定,蘇木素染色。在200倍光鏡下隨機計數5個視野計數,取其均值代表細胞侵襲力。
1.5 細胞遷移能力檢測 采用細胞劃痕實驗。用胰酶將上述過表達組、沉默組以及對照組的對數生長期的Hela消化制成單細胞懸液。將細胞均勻鋪置6孔板中,每孔2×106個細胞,將其置于培養箱中,待細胞貼壁后約8 h,用10 μL的槍頭沿直尺方向做兩條劃痕,PBS沖洗3次后,加入無血清培養基培養。于倒置顯微鏡下每24 h記錄1次細胞遷移情況。
1.6 細胞中Twist、MMP-2、Rac1表達檢測 采用Western blotting法。收集H8、Hela細胞及Twist對照組、過表達組、沉默組細胞,RIPA冰上液裂解細胞15 min后將其置于超聲儀中繼續裂解10 min后離心(12 000 g,4 ℃,15 min);蛋白濃度用BCA分析試劑測定;配膠,上樣50 μg/孔,跑膠,濕轉法轉膜,5% BSA封閉2 h,加一抗孵育過夜,TBST洗滌,二抗孵育2 h,TBST洗滌,化學發光底物檢測;X光片曝光顯影、定影顯示陽性條帶,GAPDH作為內參。Image J軟件測量灰度值并進行統計學分析。
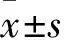
2 結果
2.1 各組細胞中Twist蛋白表達比較 H8、Hela細胞中Twist蛋白的相對表達量分別為1.67±0.31、6.87±2.17,兩者比較P<0.05。轉染Twist基因過表達載體后,對照組、過表達組、沉默組中Twist蛋白的相對表達量分別為3.97±0.48、8.23±0.74、0.48±0.23,過表達組、沉默組與對照組相比,P均<0.05。
2.2 各組細胞侵襲能力比較 對照組、過表達組、沉默組穿膜細胞數分別為(41.38±11.32)、(281.38±12.32)、(11.28±14.32)個,過表達組、沉默組與對照組相比,P均<0.05。
2.3 各組細胞遷移能力比較 對照組、過表達組、沉默組細胞劃痕愈合比分別為(31.43±5.22)%、(64.27±9.43)%、(14.16±5.21)%,過表達組、沉默組與對照組相比,P均<0.05。
2.4 各組細胞Rac1、MMP-2蛋白表達比較 對照組Rac1、MMP-2相對表達量分別為1.76±2.35、1.07±2.13,過表達組分別為3.78±2.76、4.24±1.97,沉默組分別為0.46±1.43、0.37±1.53,過表達組、沉默組與對照組相比,P均<0.05。
3 討論
宮頸癌是嚴重威脅女性健康的惡性腫瘤,其早診率低,復發及轉移率高,預后較差。目前研究已經表明,基因突變是導致腫瘤發生發展的關鍵因素,尋找導致宮頸癌發生的特異性基因對于宮頸癌的診斷及治療都有著重要意義。Twist基因在動物與人類的生長發育以及胚胎形成中起關鍵調控作用,可以誘導細胞移動以及組織塑性[13]。有研究發現Twist與腫瘤的發生關系密切。如Han等[14]發現在乳腺癌中,Twist的表達明顯升高,且與復發轉移呈正相關;此外,一方面Twist可以調控EMT促進骨肉瘤的增殖、侵襲以及轉移[15],另一方面Twist還可通過調控血管內皮生長因子促進腫瘤新生血管形成,進而促進腫瘤細胞的侵襲轉移等[16]。由此推測Twist在宮頸癌中也有同樣作用。因此,本研究以Hela細胞以及H8細胞為實驗材料,檢測Twist在宮頸癌細胞以及正常細胞株中的表達情況,結果發現Twist在Hela細胞中表達顯著高于H8;繼而采用慢病毒轉染技術過表達和沉默Twist基因后轉染細胞進一步研究Twist在宮頸癌細胞中發揮的作用,結果發現轉染Twist慢病毒過表達載體后細胞中Twist表達明顯升高,功能實驗顯示細胞的侵襲能力和遷移能力顯著升高。上述結果提示高表達的Twist促進宮頸癌細胞侵襲轉移,與李雪蓮等[17]研究發現Twist高表達促進宮頸癌侵襲轉移的結果一致,但其作用的具體機制尚不明確。
侵襲轉移是腫瘤的主要惡性生物學行為,是導致大部分腫瘤治療失敗的主要原因。腫瘤TNM分期高低的一個主要指標是有無遠處侵襲轉移。大部分癌基因之所以在腫瘤進展中發揮著關鍵調控作用,其主要原因是其可以促使腫瘤早期轉移,而腫瘤是否發生早期轉移決定了患者的預后[18]。研究[19]發現,Twist可以調控Rac1進而調控細胞遷移。Rac1是細胞內重要的信號轉導分子,可以調控腫瘤的惡性轉化、侵襲轉移以及腫瘤血管形成等[20]。目前有研究報道Rac1可以通過調控基質金屬蛋白酶2(MMP-2)促進腫瘤細胞侵襲轉移[21]。MMP-2主要作用是降解細胞外基質[22]。MMP-2編碼基因位于16q21上,較其他MMP相比,MMP-2催化區含有半胱氨酸嵌入物,在與膠原蛋白以及彈力蛋白結合過程中發揮關鍵作用[23]。有研究[21]證實,MMP-2在腫瘤細胞的生長、侵襲轉移、腫瘤血管形成以及免疫調節等過程中均起著重要作用。本研究通過轉染Twist慢病毒過表達載體和Twist慢病毒沉默載體至Hela細胞中發現,敲減Twist后,細胞中Rac1和MMP-2的表達顯著降低,過表達Twist后,Rac1與MMP-2的表達水平顯著升高,表明Twist可能通過促進Rac1和MMp-2的表達促進宮頸癌細胞的侵襲轉移。
綜上所述,Twist在宮頸癌細胞株Hela中高表達,促進/抑制其表達可以顯著增強/降低Hela的侵襲轉移,機制可能是通過作用于侵襲轉移相關蛋白Rac1、MMP-2的表達進而調控細胞的侵襲轉移。本研究為治療宮頸癌提供新的策略,Twist可能成為宮頸癌治療的潛在靶點。

